Acido poliprotico buffer hidrolisis
- 1. Soluciones Buffer o Amortiguadores Tampón, reguladoras Son aquellas sustancias que resisten cambios de pH, cuando se le añade pequeñas cantidades de un ácido o base. Prof. Jesús Rivero Química I Ing. Agroindustrial -UCLA
- 2. Toda solución amortiguadora • Están constituida por: • Un acido débil y su sal CH3COOH y CH3COONa • Una base débil y su sal NH3 (amoniaco) y NH4Cl (cloruro de Amonio) Prof. Jesús Rivero Química I Ing. Agroindustrial -UCLA
- 3. Determinación del pH de la solución amortiguadora • Calcula la concentración de protones de H+ por el método de los ácido o base débiles utilizando Ka – Explicación el pizzarra. • pH=- Log (H+ ) Prof. Jesús Rivero Química I Ing. Agroindustrial -UCLA
- 4. Determinación por la ecuación de Henderson-Hasselbalch (HH) Prof. Jesús Rivero Química I Ing. Agroindustrial -UCLA Pizarra el mismo ejercicio
- 5. Hidrólisis Son reacciones de iones o compuestos iónicos con el agua (H2O) para dar soluciones acidas, alcalinas o neutras. Es decir la reacción del ión con el agua para dar H3O+ u OH- Prof. Jesús Rivero Química I Ing. Agroindustrial -UCLA
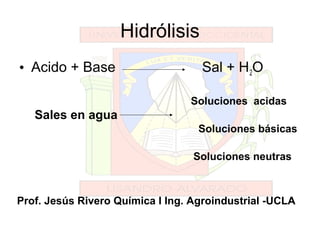
- 6. Hidrólisis • Acido + Base Sal + H2O Sales en agua Soluciones acidas Soluciones básicas Soluciones neutras Prof. Jesús Rivero Química I Ing. Agroindustrial -UCLA
- 7. Hidrólisis de sales Las sales pueden provenir de 4 combinaciones, según sea el tipo de ácido o base 1.- Sales de ácido fuerte y base fuerte solubles. 2.- Sales de base fuerte y ácido débil solubles. 3.- Sales de bases débiles y ácidos fuertes solubles. Prof. Jesús Rivero Química I Ing. Agroindustrial -UCLA
- 8. 1- SALES DE ÁCIDO FUERTE Y BASE FUERTE NaOH + HCl NaCl (s) → Na+ (ac) + Cl− (ac) BF AF Ion debil ion debil no reaccionas H2O (l) + H2O (l) ⇐⇒ OH− (ac) + H3O+ (ac) Las soluciones de este tipo de sales son neutras (pH= 7), porque ni su catión (Na+) , ni su anión (Cl-) reaccionan con el agua. Prof. Jesús Rivero Química I Ing. Agroindustrial -UCLA
- 9. 2- SALES DE BASE FUERTE Y ÁCIDO DÉBIL SOLUBLES CH3COOH + NAOH CH3COONa + H2O→ Na+ (ac) + CH3COO − AD BF no reacciona si reacciona Kb = [CH3COO H] . [OH− ] . [CH3COO − ] CH3COO − H-O-H+ CH3COOH + OH- hidrólisis Aumento el pH >7 solución es básica Prof. Jesús Rivero Química I Ing. Agroindustrial -UCLA
- 10. 3- SALES DE BASES DÉBILES Y ÁCIDOS FUERTES SOLUBLES. NH3 + HCl NH4Cl (s) → Cl− (ac) + NH4 + (ac) BD AF sal ion débil ion fuerte (catión) NH4 + + H-O-H Cede un H+ NH3 + amoniaco H3O+ IÓN HIDRONIO Aumenta el pH < 7 Esta reacción provocará un exceso de H3O+ y la solución se hará ácida (pH < 7).







![2- SALES DE BASE FUERTE Y
ÁCIDO DÉBIL SOLUBLES
CH3COOH + NAOH CH3COONa + H2O→ Na+
(ac) + CH3COO −
AD BF no reacciona si reacciona
Kb = [CH3COO H] . [OH−
] .
[CH3COO −
]
CH3COO −
H-O-H+ CH3COOH + OH-
hidrólisis
Aumento el pH >7
solución es básica
Prof. Jesús Rivero Química I Ing. Agroindustrial -UCLA](https://image.slidesharecdn.com/acidopoliproticobufferhidrolisis-181012195739/85/Acido-poliprotico-buffer-hidrolisis-9-320.jpg)
