Guia tematica
- 1. ASESORIAS BUAP 2015 ASESORIAS PARA EL EXAMEN DE ADMISION BUAP 2015 GUIA TEMÁTICA Prueba de Área por Conocimiento Naturales y de la Salud Admisión 2015
- 2. ADMISION 2015 BENEMÉRITA UNIVERSIDAD AUTÓNOMA DE PUEBLA GUÍA TEMÁTICA DEL ÁREA DE CIENCIAS NATURALES Y DE SALUD 1 Ciencias Naturales y de Salud 2015.
- 3. ÁREA DE CIENCIAS NATURALES Y DE SALUD INTRODUCCIÓN El propósito de este temario es proveer información que contribuya a la preparación del aspirante para presentar el examen del área de Ciencias Naturales y de Salud. Carreras del área: MEDICINA MEDICINA FAMILIAR Y COMUNITARIA (TEZIUTLÁN)* BIOMEDICINA FISIOTERAPIA NUTRICIÓN CLÍNICA NUTRICIÓN CLÍNICA (TEZIUTLÁN)* MEDICINA (TEHUACÁN) PROFESIONAL ASOCIADO EN IMAGENOLOGÍA ESTOMATOLOGIA ESTOMATOLOGIA (TEHUACÁN) ESTOMATOLOGIA (TEZIUTLÁN) ENFERMERÍA ENFERMERÍA (TETELA DE OCAMPO) BIOLOGÍA BIOTECNOLOGÍA QUÍMICO FARMACOBIÓLOGO QUÍMICA FARMACIA INGENIERÍA AGROHIDRÁULICA(TEZIUTLÁN) INGENIERÍA AGRONÓMO ZOOTECNISTA (TLATLAUQUITEPEC) MEDICINA VETERINARIA Y ZOOTECNIA (TECAMACHALCO) INGENIERÍA AGROFORESTAL (TETELA DE OCAMPO) 2 Ciencias Naturales y de Salud 2015.
- 4. Materias Número de ejercicios Biología Química Física/Matemáticas Total 37 18 15 70 Partes Número de ejercicios Tiempo límite (minutos) I II III Total 37 18 15 70 45 25 20 90 Prueba de Ciencias Naturales y de la Salud DESCRIPCIÓN DE LA PRUEBA La Prueba de Ciencias Naturales y de la Salud es un instrumento de evaluación diseñado para medir el conocimiento básico en ciencias exactas que poseen los alumnos de Preparatoria aspirantes a carreras del área de Ciencias Naturales y de Salud. La Prueba consiste de 70 ejercicios de selección múltiple de las siguientes materias: Biología, Química, Física, y Matemática. Estos ejercicios están relacionados con los diferentes niveles del conocimiento, tales como, memorización, comprensión, aplicación y análisis. Además, se incluyen ejercicios para probar competencias en resolución de problemas en los que se destaca la aplicación práctica de las ciencias naturales y de la salud. En la Tabla 1 se presenta la cantidad de ejercicios correspondientes a cada materia. Tabla 1 - Distribución de los ejercicios por materias La Prueba tiene tres partes y los alumnos cuenta con un total de 90 minutos para contestar los ejercicios. En la tabla 2 aparece la estructura de la Prueba. Tabla 2 – Distribución de los ejercicios por partes 3 Ciencias Naturales y de Salud 2015.
- 5. TEMARIO BIOLOGÍA I. TEORIAS DEL ORIGEN DE LA VIDA A. Vitalismo B. Creacionismo C. Generación Espontánea D. Materialismo, Mecanicismo E. Panspermia F. Teoría Físico-Química G. Planteamiento de la Teoría de Oparin II. BIOMOLÉCULAS Elementos biogenésicos Bioelementos primarios o principales Bioelementos secundarios Oligoelementos Biomoléculas inorgánicas Agua Sales minerales Biomoléculas orgánicas Aminoácidos Proteínas Biocatalizadores a) Funcionamiento Carbohidratos Clasificación Lípidos Clasificación Esteroides y hormonas esteroideas Vitaminas Hidrosolubles Liposolubles Nucleótidos y ácidos nucleicos ADN ARN 4 Ciencias Naturales y de Salud 2015.
- 6. III. LA CÉLULA Componentes celulares Sistemas membranosos Sistemas no membranosos Organelos celulares Respiración Respiración anaerobia Fermentación láctica Fermentación alcohólica Respiración aerobia Ciclo de Kebs Síntesis de proteínas Transcripción y síntesis de ARM Traducción. Síntesis de proteínas División celular Mitosis Meiosis IV. HUMANO HEREDITARIA Genética Leyes de Mendel Mutaciones Anatomía y Fisiología Humana Sistema tegumentario a) Anexos b) Funciones Sistema esquelético a) Estructura b) Funciones Sistema digestivo a) Estructura b) Funciones 5 Ciencias Naturales y de Salud 2015.
- 7. Sistema respiratorio a) Estructura b) Funciones Sistema circulatorio a) Estructura b) Funciones V. EVOLUCIÓN Y MEDIO AMBIENTE Evolución Teoría de la evolución (Charles Darwin) Teoría sintética de la evolución Biodiversidad Virus a. Estructura b. Clasificación c. Replicación Reino Monera a. Estructura interna b. Formas Reino Protista a. Clasificación b. Importancia Reino Fungi: a. Importancia Reino animal a. Características únicas del phylum 1. platelminto 2. nematodo, 3. artrópodo, 4. cordados (vertebrados) Ecología Definición Concepto ecosistema Estudio ecosistema Relaciones inter e intraespecie 1. Parasitismo 2. Depredación 6 Ciencias Naturales y de Salud 2015.
- 8. QUÍMICA VI. ELEMENTOS QUÍMICOS o Estructura atómica Electrones Núcleo atómico o Clasificación periódica Metales, No-metales Metaloides o o o o o Propiedades periódicas Radio atómico Afinidad electrónica Potencial de ionización Electronegatividad VII. COMPUESTOS QUÍMICOS Formación de compuestos químicos a. Tipos de enlaces en los compuestos químicos b. Formulación de los compuestos químicos c. Nomenclatura de compuestos orgánicos e inorgánicos d. Reacciones y ecuaciones químicas VIII. SISTEMAS DISPERSOS Dispersiones coloidales Disoluciones Potencial de hidrógeno (pH) FÍSICA / MATEMÁTICA IX. CONCEPTOS FUNDAMENTALES DE FÍSICA Cinemática 1. Punto o cuerpo de referencia 2. Distancia y desplazamiento 3. Aceleración 4. Movimiento vertical 7 Ciencias Naturales y de Salud 2015.
- 9. a. b. c. d. e. f. g. a. b. c. d. e. Dinámica Fuerza Leyes de Newton Masa Peso Diagrama de fuerzas Ley de Gravitación Universal Cantidad de movimiento Energía Energía cinética Energía potencial gravitatoria Colisiones elásticas Principios de conservación de la cantidad de movimiento Principios de conservación de la energía Termodinámica 1. Temperatura 2. Calor 3. Propagación del calor X. CONCEPTOS FUNDAMENTALES DE MATEMÁTICAS a. b. c. d. Números reales Combinación de operaciones con fracciones Conversión de fracciones decimales Razones y proporciones Regla de 3 simple, directa o inversa Productos notables y factorización a. El cuadrado de un binomio b. La factorización de un trinomio cuadrado perfecto Exponentes a. Exponentes enteros b. Leyes de exponentes Funciones a. Parejas ordenadas en un plano cartesiano Ecuaciones de primer grado a. Resolución de ecuaciones de primer grado con una incógnita. 8 Ciencias Naturales y de Salud 2015.
- 10. 9 Ciencias Naturales y de Salud 2015.
- 11. 10 Ciencias Naturales y de Salud 2015.
- 12. 11 Ciencias Naturales y de Salud 2015.
- 13. PCCNS (Ciencias Naturales y de la Salud) 10 ejercicios # Clave 1 A 2 D 3 D 4 C 5 D 6 B 7 B 8 E 9 D 10 B Relación de Respuestas Correctas (Clave) para los ejercicios de práctica. 12 Ciencias Naturales y de Salud 2015.
- 15. CAPÍTULO XIV Mecanicismo y Materialismo n el orden llamado «científico», el primer producto del racionalismo fue el mecanicismo cartesiano; el materialismo había de llegar más tarde, puesto que, como ya hemos explicado, tanto la doctrina como su denomina- ción datan en realidad del siglo XVIII; por otra parte, cualesquiera fueran las intenciones del propio Descartes (y, de hecho, se han podido deducir buen nú- mero de ideas de él por el procedimiento de llevar al límite sus consecuencias lógicas originándose así un cierto número de teorías harto contradictorias) exis- te entre uno y otro una filiación directa. A este respecto no es del todo inútil recordar que, si bien las antiguas concepciones atomistas como las de Demócri- to y sobre todo la de Epicuro pueden ser consideradas como mecanicistas, por ser estos autores los únicos «precursores» de la Antigüedad de los que los mo- dernos pueden considerarse herederos con cierto fundamento, a menudo se pretende erróneamente convertirles en defensores de una primera formulación del materialismo por implicar éste de manera fundamental la noción de «mate- ria» utilizada por los físicos modernos y que en esta época todavía no había vis- to la luz. La verdad es que el materialismo representa sencillamente una de las dos mitades del dualismo cartesiano, precisamente aquélla a la que su autor ha- bía aplicado la concepción mecanicista; bastaba a partir de este momento con despreciar o negar la mitad restante o, lo que es lo mismo, con pretender reducir a ésta la realidad entera para que el materialismo surgiese de forma natural. E
- 16. Contra Descartes y sus principios, Leibniz ha demostrado correctamente la insuficiencia de una física mecanicista que, por su propia naturaleza, no puede dar cuenta sino de la apariencia exterior de las cosas y resulta de todo punto incapaz de explicar cualquier elemento de su verdadera esencia; así, po- dría decirse que el mecanicismo sólo tiene un valor «representativo» y en modo alguno explicativo; mas, ¿no es éste exactamente el caso en el que se encuentra toda la ciencia moderna? Así ocurre en un ejemplo tan sencillo como el del movimiento, no obstante ser éste uno de esos fenómenos que, por excelencia, suelen considerarse como susceptibles de una explicación mecánica; tal expli- cación, dice Leibniz, no es válida más que en la medida en que no se considere en el movimiento nada más que un cambio de situación y, a este respecto, cuando cambia la situación respectiva de dos cuerpos, lo mismo da decir que el primero se desplaza respecto al segundo o bien que el segundo lo hace respecto al primero, pues en el proceso hay una perfecta reciprocidad; mas algo comple- tamente diferente ocurre cuando se toma en consideración la razón del movi- miento, pues, dado que esta razón sólo reside en uno de los cuerpos, éste será el único del que podrá decirse que se mueve mientras que el otro sólo desempeña en el cambio considerado un papel puramente pasivo; mas esto es algo que es- capa por completo a las consideraciones de orden mecánico y cuantitativo. En definitiva, el mecanicismo se limita, pues, a ofrecer una simple descripción del movimiento, tal como aparece exteriormente, resultando incapaz de compren- der su razón y por tanto de expresar ese aspecto esencial o cuantitativo que únicamente puede suministrar su verdadera explicación; con mayor motivo ocurrirá lo mismo en cualquier otra cuestión más compleja y en la que predo- mine más la cualidad sobre la cantidad; una ciencia constituida así no podrá, por tanto, tener ningún valor de conocimiento efectivo incluso en cuanto con- cierne al ámbito relativo y limitado en el que se ve encerrada. RENÉ GUÈNON 2
- 17. Sin embargo, Descartes ha querido aplicar a todos los fenómenos del mundo corpóreo una concepción tan notoriamente insuficiente, dado que pre- tendía reducir toda la naturaleza de los cuerpos a la mera extensión enfocándo- la, por añadidura, desde un punto de vista cuantitativo; ya entonces, al igual que los mecanicistas más recientes y que los mismos materialistas, no hacía ninguna diferencia entre los cuerpos llamados «inorgánicos» y los seres vivien- tes. Aludimos a los seres vivientes y no sólo a los cuerpos organizados porque el propio ser se ve aquí reducido a su cuerpo en virtud de la famosa teoría carte- siana de los «animales-máquinas», que seguramente constituye uno de los pro- ductos más absurdos engendrados por el espíritu sistemático; sólo al considerar al ser humano se cree obligado Descartes, en su física, a especificar que alude simplemente al «cuerpo del hombre», y ¿qué valor puede tener en realidad esta restricción cuando, por hipótesis, todo lo que ocurre en el cuerpo humano se- guiría ocurriendo igual si estuviese el «espíritu» ausente de él? En efecto, el ser humano, por este mismo dualismo, se ve cortado en dos partes que no llegan a reunirse y que no pueden formar un compuesto real ya que, al ser imaginadas como absolutamente heterogéneas, en modo alguno pueden entrar en comuni- cación, de manera que toda acción efectiva de una de ellas sobre la otra resulta por ello imposible. Además, se ha pretendido explicar mecánicamente todos los fenómenos que se producen en los animales, incluidas aquellas manifestaciones cuyo carácter es más obviamente psíquico; podemos, por tanto, preguntarnos por qué no habría de ocurrir lo mismo en el hombre y también si no está per- mitido menospreciar la otra vertiente del dualismo como si en nada contribuye- se a la explicación de las cosas; de esto a considerarlo como una complicación inútil y a tratarlo como si no existiese de hecho para negarlo sencillamente des- pués no hay demasiada distancia, sobre todo para unos hombres cuya atención se vuelve continuamente y por entero hacia el ámbito sensible, como es el caso MECANICISMO Y MATERIALISMO 3
- 18. de los occidentales de nuestro tiempo; esta es la forma en que la física mecani- cista de Descartes se veía abocada indefectiblemente a preparar el camino al materialismo. Teóricamente, la reducción de todas las cosas a lo cuantitativo se había operado ya en todo lo que pertenece en rigor al orden corpóreo, en la medi- da misma que la propia constitución de la física cartesiana implicaba la posi- bilidad de tal reducción; sólo restaba extender esta concepción al conjunto de la realidad tal como entonces se comprendía, mientras que, según los princi- pios del racionalismo, ésta, por otra parte, quedaba restringida a la existencia individual como único ámbito posible. Partiendo del dualismo, esta opera- ción necesariamente debía presentarse como una reducción del «espíritu» a la «materia», consistente en incluir en ella exclusivamente cuanto Descartes había incluido en uno u otro de los términos con el fin de poder reducirlo to- do a la cantidad por igual; así, tras haber relegado hasta cierto punto el as- pecto esencial de las cosas «más allá de las nubes», ello suponía su completa supresión de forma tal que no volviese a ser considerada y admitida más que su faceta substancial, por ser a estos dos aspectos a los que corresponden res- pectivamente el «espíritu» y la «materia» y a pesar de ofrecer una imagen considerablemente empequeñecida y deformada de ambos conceptos. Des- cartes había incluido en el ámbito cuantitativo la mitad del mundo tal como él lo concebía y es posible incluso que ésta fuese la mitad más significativa en su opinión, pues en el fondo de su pensamiento y fueran cuales fuesen las apariencias, su deseo fundamental era el de ser un físico; a su vez, el materia- lismo pretendió integrar en dicho ámbito al mundo entero; por consiguiente, en lo sucesivo sólo le restaba esforzarse en elaborar efectivamente esta reduc- ción por medio de una serie de teorías cada vez más apropiadas a este fin, y RENÉ GUÈNON 4
- 19. esta era la tarea a la que debía consagrarse toda la ciencia moderna aun en el caso de no declararse abiertamente materialista. Y es que, además del materialismo explícito y formal también existe lo que puede llamarse un materialismo de hecho cuya influencia llega mucho más lejos, pues muchas gentes que no se toman en modo alguno por materialistas se comportan prácticamente como tales en todas las circunstancias; en definitiva, existe entre estos dos materialismos una relación bastante similar a la que se establece, como decíamos antes, entre el racionalismo filosófico y el vulgar, sal- vo en el hecho de que el simple materialista práctico generalmente no reivindi- ca esta etiqueta, llegando incluso a protestar si se le aplica, mientras que el ra- cionalista vulgar, aunque sea el hombre más ignorante de la filosofía, se apresu- ra a proclamarse como tal al tiempo que se adorna orgullosamente con el más bien irónico título de «libre pensador», paradójico si se considera que en reali- dad no es más que el esclavo de todos los prejuicios corrientes de su época. Sea como fuere, al igual que el racionalismo vulgar es el producto de la difusión del racionalismo filosófico entre el «gran público», con todo lo que supone forzo- samente el hecho de ser puesto «al alcance de todo el mundo», también es el materialismo propiamente dicho el que se encuentra en el punto de partida del materialismo de hecho, en la medida misma que ha sido él el agente de este es- tado de ánimo general contribuyendo eficazmente a su formación; por supues- to la totalidad del problema se explica siempre en definitiva por el desarrollo de idénticas tendencias constitutivas del substrato del espíritu moderno. Es eviden- te que un sabio, en el sentido que actualmente se da a la palabra, aun cuando no haga profesión de fe de materialismo, se verá tanto más influenciado por él cuanto que toda su educación específica esté orientada en dicho sentido; inclu- so si, como suele ocurrir, este sabio cree que no carece de «espíritu religioso», MECANICISMO Y MATERIALISMO 5
- 20. siempre encontrará un medio de separar tan completamente su religión de su actividad científica que su obra no se distinguirá en nada de la realizada por el materialista más consumado, y que desempeñará así su papel, tan bien como pueda hacerlo este último, en la «progresista» construcción de la ciencia más exclusivamente cuantitativa y más groseramente material que es posible imagi- nar; esta es la forma en que la acción antitradicional consigue utilizar en su be- neficio incluso a aquellos que, por el contrario, deberían lógicamente ser sus adversarios, si la desviación de la mentalidad moderna no hubiese generado unos seres repletos de contradicciones e incapaces incluso de darse cuenta de ello. También en esto la tendencia a la uniformidad encuentra su realización ya que todos los hombres llegan prácticamente a pensar y actuar de un modo idéntico y que lo que les hace diferentes, a pesar de todo, no tiene más que un mínimo de influencia efectiva y no se traduce exteriormente en nada real; así suele ocurrir que, en un mundo como este, salvo muy escasas excepciones, un hombre que se declara cristiano no deje de comportarse de hecho como si no hubiera ninguna realidad fuera de la mera existencia corpórea, y un sacerdote que cultive la «ciencia» no difiera gran cosa de un universitario materialista; cuando se ha llegado a este punto, ¿pueden todavía evolucionar las cosas antes de que el punto más bajo de la «bajada» sea finalmente alcanzado? RENÉ GUÈNON 6
- 21. 1. ORIGEN PREBIÓTICO 1.1 Panspermia, origen extraterrestre de la vida La Teoría de la Panspermia afirma que la vida aparecida en la Tierra no surgio aqui, sino en otros lugares del Universo, y que llego a nuestro planeta utilizando los meteoritos y los asteroides como forma de desplazarse de un planeta a otro. Dicha teoría parece confirmada en algunos puntos, si tenemos en cuenta que los componentes que componen las formas de vida que nosotros conocemos (las basadas en la química del carbono) se pueden encontrar en muchos lugares del Universo. La Panspermia puede ser de 2 tipos: -Panspermia interestelar. El intercambio de formas de vida se producen entre sistemas solares. -Panspermia interplanetaria. El intercambio de formas de vida se producen entre planetas pertenecientes al mismo sistema solar. 1.2 Teoría de Oparin Su hipótesis basándose en la posibilidad de que se hubieran producido reacciones químicas espontáneas entre los componentes de la atmósfera primitiva, de las cuales pudieron formarse en sustancias orgánicas. Las fuentes para producir estas energías serían: - Descargas eléctricas producidas en las numerosas tormentas que debieron tener lugar al existir mucho vapor de agua - Las radiaciones del sol serían muy intensas al no existir capa de ozono - La energía geotérmica procedente de la actividad volcánica El vapor de agua se condensó, al descender la temperatura y se produjeron lluvias torrenciales, que originaron los océanos primitivos, en los que reacciones químicas dieron lugar a compuestos orgánicos simples. Luego todas las moléculas se irían acumulando progresivamente y formarían lo que Oparin denominó sopa o caldo primitivo, que constituirían mares cálidos con materia orgánica. Los compuestos debieron aislarse del medio y formaron unas estructuras que se denominaron coacervados. La última condición necesaria para que se originara un sistema biológico sería la capacidad de reproducirse. El primer sistema físico-químico estable y autoreplicable se denominó progenota, que es el origen de todas las células. CHARLES DARWIN La contribución de Charles Darwin a los conocimientos científicos fue doble: presentó las pruebas para demostrar que la evolución había ocurrido, a la vez que formuló una teoría, la de la selección natural, para explicar el mecanismo de la evolución. Darwin entendió que toda población consiste de individuos ligeramente distintos unos de otros La explicación propuesta por Darwin y Wallace respecto a la forma en que ocurre la evolución, puede resumirse en la forma siguiente:
- 22. - La posibilidad de variación es característica de todas las especies de animales y plantas. Darwin y Wallace suponían que la variación era una de las propiedades innatas de los seres vivos. Hoy sabemos distinguir las variaciones heredadas de las no heredadas. Sólo las primeras, producidas por mutaciones, son importantes en la evolución. - De cualquier especie nacen más individuos de los que pueden obtener su alimento y sobrevivir. Sin embargo, como el número de individuos de cada especie sigue más o menos constante bajo condiciones naturales, debe deducirse que perece un porcentaje de la descendencia en cada generación. Si la descendencia de una especie prosperara en su totalidad, y sucesivamente se reprodujera, pronto avasallaría cualquiera otra especie sobre la Tierra. - Sentado que nacen más sujetos de los que pueden sobrevivir, tiene que declararse una lucha por la existencia, una competencia en busca de espacio y alimento. Esta lucha es directa o indirecta, como la de los animales y vegetales para sobrevivir ante condiciones de falta de agua o de bajas temperaturas o a otras condiciones desfavorables del medio ambiente. - Aquellas variaciones que capacitan mejor a un organismo para sobrevivir en un medio ambiente dado favorecerán a sus poseedores sobre otros organismos menos bien adaptados. Las ideas de la "lucha por la supervivencia" y "supervivencia del más apto" son la esencia de la teoría de la selección natural, de Darwin y Wallace. - Los individuos supervivientes originarán la siguiente generación, y de este modo se transmiten variaciones "aventajadas" a la siguiente generación y a la siguiente. TEORÍA ENDOSIMBIÓTICA La teoría endosimbiótica fue popularizada por Lynn Margulis en 1967, quien describió el origen simbiogenético de las células eucariotas. La teoría endosimbiótica explica que algunos orgánulos propios de las células eucariotas, habrían tenido su origen en organismos procariotas que después de ser englobados por otro microorganismo habrían establecido una relación endosimbiótica con éste. DEL FIJISMO AL EVOLUCIONISMO El fijismo o teoría fijista es una creencia que sostiene que las especies actualmente existentes han permanecido básicamente invariables desde la Creación. Las especies serían, por tanto, inmutables, tal y como fueron creadas. Los fósiles serían restos de los animales que perecieron en los diluvios bíblicos o bien caprichos de la naturaleza. El fijismo describe la naturaleza en su totalidad como una realidad definitiva, inmutable y acabada.
- 23. ,(6 %$55,2 /25$1&$ 7(0$ (92/8,Ð1 )8(1/$%5$'$ 3iJLQD 3HGUR RERV 7(25Ì$6 62%5( (/ 25,*(1 '( /$ 9,'$ /$ (92/8,Ð1 3RU HYROXFLyQ HQWHQGHPRV DO FRQMXQWR GH WUDQVIRUPDFLRQHV TXH FRQGXFHQ D OD DGTXLVLFLyQ GH XQ PDRU QLYHO GH FRPSOHMLGDG (Q OD HYROXFLyQ OD PDWHULD LQRUJiQLFD SURFHGHQWH GHO RULJHQ GHO XQLYHUVR VH WUDQVIRUPD HQ PDWHULD RUJiQLFD OD FXDO RULJLQD ORV RUJDQLVPRV YLYRV VHQFLOORV TXH SDUD DGDSWDUVH DO PHGLR DPELHQWH FDPELDQWH VH WUDQVIRUPDQ HQ RUJDQLVPRV YLYRV FRPSOHMRV $ ORV FDPELRV TXH OOHYDQ D OD IRUPDFLyQ GH RUJDQLVPRV YLYRV VHQFLOORV VH OH OODPD RULJHQ GH OD YLGD D ORV FDPELRV TXH OOHYDQ D RUJDQLVPRV YLYRV FRPSOHMRV VH OH OODPD HYROXFLyQ ELROyJLFD $
- 24. 7(25Ì$6 62%5( (/ 25,*(1 '( /$ 9,'$ $ OR ODUJR GH OD KLVWRULD GH OD KXPDQLGDG HO KRPEUH VH KD SODQWHDGR HO RULJHQ GH OD YLGD HQ JHQHUDO GHO KRPEUH HQ SDUWLFXODU UHVSRQGLHQGR GH GLIHUHQWH IRUPD VHJ~Q HO PRPHQWR KLVWyULFR HQ HO TXH VH SURGXMHUD OD UHVSXHVWD DVt
- 25. 7HRUtD FUHDFLRQLVWD (V OD DUJXPHQWDGD SRU OD PDRUtD GH ODV UHOLJLRQHV TXH VXSRQHQ HO RULJHQ GH OD YLGD HQ XQ 'LRV VREUHQDWXUDO DOHMDGR GH ODV UHDFFLRQHV ItVLFR TXtPLFDV TXH VH GDQ HQ HOOD
- 26. 7HRUtD GH OD JHQHUDFLyQ HVSRQWiQHD (QXQFLDGD SRU $ULVWyWHOHV KD SHUGXUDGR GXUDQWH PXFKR WLHPSR VXSRQH TXH OD YLGD VXUJH GHO ORGR R GHO DJXD R GH OD FRPELQDFLyQ GH ORV FXDWURV HOHPHQWRV IXQGDPHQWDOHV DLUH IXHJR DJXD WLHUUD )XH DSRDGD SRU JUDQGHV LQYHVWLJDGRUHV FRPR HO JHyJUDIR +HOPRQW ;9,,
- 27. TXLHQ LQFOXVR SURSXVR XQD UHFHWD SDUD JHQHUDU UDWRQHV GH IRUPD HVSRQWiQHD
- 28. 7HRUtD GH ELRJpQHVLV )XH SURSXHVWD SRU 5HGGL TXLHQ D ILQDOHV GHO VLJOR ;9,, KL]R XQ H[SHULPHQWR SDUD GHPRVWUDU OD IDOVHGDG GH OD WHRUtD GH OD JHQHUDFLyQ HVSRQWiQHD /OHJy D OD FRQFOXVLyQ GH TXH OD YLGD VyOR SXHGH RULJLQDUVH D SDUWLU GH OD YLGD /D SXJQD HQWUH ODV WHRUtDV DQWHULRUHV JHQHUDFLyQ HVSRQWiQHD ELRJpQHVLV
- 29. VLJXLy KDVWD HO VLJOR ;,; PRPHQWR HQ HO TXH /RXLV 3DVWHXU FRPSUREy TXH OD PDWHULD QR YLYD VH FRQWDPLQD FRQ PDWHULD YLGD PLFURRUJDQLVPRV
- 30. H[LVWHQWH HQ HO DLUH FRQILUPDQGR FRQ HOOR OD 7HRUtD GH ELRJpQHVLV
- 31. 7HRUtD GHO RULJHQ ItVLFRTXtPLFR GH OD YLGD 6XSRQH TXH HQ OD VHJXQGD DWPyVIHUD QR UHGXFWRUD GH OD 7LHUUD +Y 2 +6 1 +
- 32. OD
- 33. ,(6 %$55,2 /25$1$ 7(0$ (92/8,Ð1 )8(1/$%5$'$ 3iJLQD 3HGUR RERV UDGLDFLyQ XOWUDYLROHWD ORV UDRV FyVPLFRV ODV GHVFDUJDV HOpFWULFDV DFWXDURQ VREUH ORV JDVHV GH OD DWPyVIHUD FUHDQGR PROpFXODV RUJiQLFDV VHQFLOODV FRPSOHMDV DOJXQDV GH ODV FXDOHV VHUtDQ LQHVWDEOHV VH GHVWUXLUtDQ PLHQWUDV TXH RWUDV FRPR DPLQRiFLGRV D]~FDUHV iFLGRV JUDVRV DOFRKROHV DGHKtGRV WHUSHQRV RWURV VHUtDQ HVWDEOHV SHUGXUDUtDQ HVWH KHFKR IXH GHPRVWUDGR SRU 0LOOHU 8UH HQ HO ODERUDWRULR
- 34. /DV PROpFXODV PiV SHVDGDV FDHQ SRU VX SHVR D ORV PDUHV SULPLWLYRV GRQGH VXIUHQ OD SROLPHUL]DFLyQ FUHDQ SROtPHURV SURWHtQDV iFLGRV QXFOHLFRV JO~FLGRV«
- 35. TXH FRQVWLWXHQ HO FDOGR R VRSD SULPLWLYR (VWDV PDFURPROpFXODV VH DJUXSDQ HQ SHTXHxDV JRWDV TXH VRQ FDSDFHV GH LQWHUFDPELDU PDWHULD HQHUJtD FRQ HO PHGLR FRQYLUWLpQGRVH DVt HQ SURWRELRQWHV X RUJDQLVPRV SULPLWLYRV TXH VH DOLPHQWDQ GH OD VRSD SULPLWLYD SHUR TXH x 7LHQHQ TXH YLYLU HQ HO IRQGR GH ODV DJXDV R EDMR URFDV GH FRVDV SDUD SURWHJHUVH GH OD UDGLDFLyQ XOWUDYLROHWD x 'HVDUUROOD PHFDQLVPRV UHSURGXFWLYRV SDUD DVHJXUDU OD GHVFHQGHQFLD SDUHFH VHU TXH IXH XQD PROpFXOD GH $51
- 36. +D GLVSDULGDG GH FULWHULRV HQ FXDQWR D OD DSDULFLyQ GH OD FDSDFLGDG UHSURGXFWRUD DVt D 2SDUtQ 3URSRQH TXH HO SURERWLRQWH HV HO SULPHUR HQ IRUPDUVH HVWH DGTXLULUi SRVWHULRUPHQWH OD FDSDFLGDG UHSURGXFWRUD E +DOGDQH 3URSRQH OD KLSyWHVLV GHO JHQ GHVQXGR LQGLFDQGR TXH SULPHUR VH IRUPD HO $51 HO FXDO DJOXWLQD DO UHVWR GH ODV PDFURPROpFXODV SDUD IRUPDU HO SURWRELRQWH HV OD WHRUtD PiV DFHSWDGD
- 37. /D HYROXFLyQ GHO SURWRELRQWH RULJLQD OD SULPHUD FpOXOD TXH UHDOL]D ODV WUHV IXQFLRQHV YLWDOHV GH QXWULFLyQ UHODFLyQ UHSURGXFFLyQ (VWD FpOXOD VHUtD XQ SURFDULRWD KHWHUyWURIR DQDHURELR TXH VH DOLPHQWDED GHO PHGLR /D SREODFLyQ GHO SURFDULRWD DXPHQWy FRPHQ]y D HVFDVHDU HO DOLPHQWR SURGXFLpQGRVH OD SULPHUD FULVLV HFROyJLFD $OJXQRV DSUHQGHQ D DWDFDU D VXV VHPHMDQWHV DSDUHFLHQGR DVt ORV FDUQtYRURV SHUR HO DOLPHQWR VHJXtD HVFDVHDQGR DOJXQRV GH HVWRV DSUHQGLHURQ D XVDU OD OX] PHGLDQWH OD FORURILOD FUHiQGRVH DVt ORV SULPHURV SURFDULRWDV DXWyWURIDV TXH SURGXFtDQ PDWHULD RUJiQLFD D SDUWLU GH PDWHULD LQRUJiQLFD SHUR TXH HOLPLQDEDQ R[tJHQR FRPR SURGXFWR UHVLGXDO HO FXDO DO DFXPXODUVH HQ OD DWPyVIHUD WUDQVIRUPy OD DWPyVIHUD UHGXFWRUD HQ R[LGDQWH SURGXFLpQGRVH DVt OD VHJXQGD
- 38. ,(6 %$55,2 /25$1$ 7(0$ (92/8,Ð1 )8(1/$%5$'$ 3iJLQD 3HGUR RERV FULVLV HFROyJLFD $OJXQDV DSUHQGLHURQ D XVDU HO R[tJHQR HQ VX SURSLR EHQHILFLR FUHiQGRVH DVt ODV KHWHUyWURIDV DHURELDV /D DSDULFLyQ GH HXFDULRQWHV VH H[SOLFD SRU GRV WHRUtDV x $XWyJHQD 6XSRQH OD IRUPDFLyQ GHO HXFDULRWD SRU HYROXFLyQ GH ORV SURFDWLRWDV x (QGRVLPELRQWH 6XSRQH OD IRUPDFLyQ GHO HXFDULRWD SRU DVRFLDFLyQ GH ORV SURFDWLRWDV DQFHVWUDOHV (V GHFLU TXH ODV PLWRFRQGULDV ORV FORURSODVWRV VRQ HQ VX RULJHQ RUJDQLVPRV SURFDULRWDV LQGHSHQGLHQWHV TXH VH DVRFLDURQ VLPELyQWLFDPHQWH HQWUH Vt SHUGLHURQ VX LQGLYLGXDOLGDG (VWD WHRUtD HV OD PiV DFHSWDGD FRPSUREiQGRVH TXH HVWRV RUJiQXORV SRVHHQ XQ FURPRVRPD FLUFXODU $51 SURWHtQDV LQGHSHQGLHQWHV D ORV GH OD FpOXOD HQ OD TXH VH HQFXHQWUDQ DGHPiV GH SRVHHU ULERVRPDV FRQ YHORFLGDG GH VHGLPHQWDFLyQ 6 FRPR ORV SURFDULRWDV DFWXDOHV
- 39. HQ OXJDU GH 6 FRPR ORV HFXDULRWDV DFWXDOHV
- 40. /D IRUPDFLyQ GH ORV SOXULFHOXODUHV VH H[SOLFD R ELHQ SRU IXVLyQ GH HXFDULRWDV XQLFHOXODUHV LQGHSHQGLHQWHV R ELHQ SRU GLYLVLyQ P~OWLSOH GHO Q~FOHR SRVWHULRU WDELFDFLyQ /D IRUPDFLyQ GH YLUXV VH H[SOLFD SRU OD DGDSWDFLyQ GH SURFDULRWDV D OD YLGD SDUiVLWD
- 41. 7HRUtD GH 3DQVSHUPLD ([SOLFD HO RULJHQ GH OD YLGD HQ HO SODQHWD GHELGR D HVSRUDV H[WUDWHUUHVWUHV TXH OOHJDQ D OD 7LHUUD GHVGH HO HVSDFLR %
- 42. 7(25Ì$6 62%5( /$ (92/8,Ð1 7LHQHQ SRU REMHWR HO HVWXGLR GH ODV FDXVDV GH ORV FDPELRV WHPSRUDOHV GH ORV RUJDQLVPRV HV GHFLU LQWHQWDQ H[SOLFDU x /D HVSHFLDFLyQ x /D FUHDFLyQ GH QXHYRV WLSRV GH RUJDQL]DFLyQ x /D DSDULFLyQ GH DGDSWDFLRQHV /DV SULQFLSDOHV WHRUtDV HYROXWLYDV VH FODVLILFDQ HQ )LMLVWDV 6RQ ODV TXH LQGLFDQ TXH ODV HVSHFLHV VRQ LQPXWDEOHV GHVGH VX FUHDFLyQ HV GHFLU VRQ FUHDFLRQLVWDV )XH GHIHQGLGD SRU /LQQHR XYLHU TXLHQ LQGLFy TXH ODV HVSHFLHV SRVHHQ LQGLYLGXRV TXH SURFHGHQ XQRV GH RWURV HV GHFLU TXH VH SDUHFHQ D VXV SDGUHV XYLHU SRVWXOy OD WHRUtD GH ODV FUHDFLRQHV VXFHVLYDV LQWHUFDODGDV FRQ OD LQFLGHQFLD GH FDWDFOLVPRV TXH GHVWUXHQ WRGD OD YLGD SUHH[LVWHQWH SRU OR TXH 'LRV FUHD RWURV VHUHV YLYRV QXHYRV WDPELpQ VH OODPDQ FDWDVWURILVWDV
- 43. (YROXFLRQLVWDV 6XSRQHQ TXH ORV VHUHV YLYRV SURFHGHPRV GH XQ DQWHSDVDGR FRP~Q TXH KD VXIULGR FDPELRV FRQ HO WLHPSR GHELGR D GLYHUVRV IDFWRUHV HYROXWLYRV TXH
- 44. ,(6 %$55,2 /25$1$ 7(0$ (92/8,Ð1 )8(1/$%5$'$ 3iJLQD 3HGUR RERV KDQ REOLJDGR D OD IRUPDFLyQ GH QXHYDV HVSHFLHV D OD DSDULFLyQ GH QXHYRV WLSRV GH RUJDQL]DFLyQ 3DUD H[SOLFDU ODV FDXVDV TXH SURYRFDQ HO FDPELR VH KDQ GDGR GLYHUVDV WHRUtDV /DPDUFNLVPR )XH GDGD SRU /DPDUFN SDUD pO HO PRWRU GH OD HYROXFLyQ HV OD DGDSWDFLyQ DO PHGLR 6XSRQH TXH WRGRV ORV RUJDQLVPRV WLHQGHQ D XQD PDRU FRPSOHMLGDG HVWUXFWXUDO VXSRQH D 8QD HVSHFLH SURFHGH GH RWUD SRU FDPELR HQ OD SULPHUD E (V HO PHGLR OD FDXVD GHO FDPELR HQ OD HVSHFLH SULPHUD TXH KDFH DSDUHFHU FDUDFWHUHV TXH QR HVWDEDQ DQWHV FDUiFWHU DGTXLULGR
- 45. (V GHFLU OD IXQFLyQ FUHD HO yUJDQR F (O FDUiFWHU DGTXLULGR FRPR FRQVHFXHQFLD GH XQD DGDSWDFLyQ DO PHGLR VH WUDQVPLWH D OD GHVFHQGHQFLD (VWD WHRUtD HVWi KR WRWDOPHQWH GHVHFKDGD D TXH ORV FDUDFWHUHV DGTXLULGRV QR VH KHUHGDQ FRPR VDEHPRV SRU JHQpWLFD
- 46. 7HRUtD GH OD VHOHFFLyQ QDWXUDO )XH GDGD SRU 'DUZLQ :DOODFH GH IRUPD LQGHSHQGLHQWH SDUD HOORV OD FDXVD R PRWRU GH OD HYROXFLyQ HV OD VHOHFFLyQ QDWXUDO 6XSRQH D /XFKD SRU OD H[LVWHQFLD (V GHFLU HQ OD SREODFLyQ VH SURGXFHQ PiV LQGLYLGXRV TXH ORV TXH HO PHGLR SXHGH VRSRUWDU SHUR VH PDQWLHQH HVWH Q~PHUR GH LQGLYLGXRV SRUTXH OD PDRUtD GH HOORV PXHUHQ DQWHV GH DOFDQ]DU OD FDSDFLGDG UHSURGXFWRUD DO QR FRQVHJXLU DOLPHQWR E 9DULDELOLGDG LQWUDHVSHFtILFD +D YDULDFLRQHV LQGLYLGXDOHV HQWUH ORV LQGLYLGXRV GH XQD PLVPD HVSHFLD TXH KDFHQ TXH DOJXQRV GH HOORV HVWpQ PHMRU DGDSWDGRV DO PHGLR TXH RWURV /RV PHMRU DGDSWDGRV FRQVHJXLUiQ PHMRU HO DOLPHQWR SRGUiQ DFFHGHU D OD UHSURGXFFLyQ GHMDQGR GHVFHQGHQFLD PLHQWUDV TXH ORV SHRU DGDSWDGRV R PXHUHQ DQWHV GH DOFDQ]DU OD PDGXUH] VH[XDO R VL OD DOFDQ]DQ QR WLHQHQ DFFHVR D OD UHSURGXFFLyQ SRU OR TXH VXV JHQHV GHVDSDUHFHQ GH OD SREODFLyQ (V GHFLU HO SURFHVR HYROXWLYR HV JUDGXDO FRQWLQXR F 6HOHFFLyQ QDWXUDO (V GHFLU HV HO PHGLR DPELHQWH TXLHQ VHOHFFLRQD D ORV LQGLYLGXRV TXH HVWiQ PHMRU DGDSWDGRV D pO HV GHFLU VHOHFFLRQD ORV FDUDFWHUHV PiV EHQHILFLRVRV ORV JHQHV GH ORV TXH GHSHQGHQ HVWRV FDUDFWHUHV HQ GHWULPHQWR GH ORV QR VHOHFFLRQDGRV /D VHOHFFLyQ QDWXUDO DFXPXOD HVWRV FDPELRV ORV JHQHV UHVSRQVDEOHV
- 47. KDFLHQGR TXH VH IRUPHQ GRV R PiV JUXSRV GH LQGLYLGXRV HQ OD PLVPD SREODFLyQ DSDUHFLHQGR DVt ODV QXHYDV
- 48. ,(6 %$55,2 /25$1$ 7(0$ (92/8,Ð1 )8(1/$%5$'$ 3iJLQD 3HGUR RERV HVSHFLHV (V GHFLU OD HYROXFLyQ HV HO UHVXOWDGR GH OD VHOHFFLyQ QDWXUDO G /RV RUJDQLVPRV HVWiQ WDQWR PiV SUy[LPRV HQ OD HYROXFLyQ FXDQWR PiV VHD HO ´SDUHFLGRµ HQWUH HOORV GH PRGR TXH WRGRV ORV RUJDQLVPRV VHPHMDQWHV HQWUH Vt WLHQHQ XQ RULJHQ FRP~Q /RV GHWUDFWRUHV GH HVWD WHRUtD IXHURQ /RV ILQDOLVWDV ,QGLFDQ TXH HO DPELHQWH QR LQIOXH HQ OD HYROXFLyQ VLQR TXH KD XQ GHWHUPLQLVPR VXSUHPR XQ ILQ ~OWLPR
- 49. 'HIHQGLGR SRU 7HLOKDUG GH KDUGLQ /RV VDOWDFLRQLVWDV ,QGLFDQ TXH OD HYROXFLyQ QR HV FRQWLQXD VLQR TXH VH SURGXFH D VDOWRV GHELGR D ODV PXWDFLRQHV 'HIHQGLGD SRU 'H 9ULHV 1HRGDUZLQLVPR 7DPELpQ OODPDGD WHRUtD VLQWpWLFD SRUTXH UHFRJH ODV LGHDV GH YDULRV LQYHVWLJDGRUHV IXH GDGD SRU +X[OH VXSRQH TXH OD VHOHFFLyQ QDWXUDO SURYRFDUtD TXH ORV JHQRWLSRV IDYRUDEOHV HQ ODV FRQGLFLRQHV DPELHQWDOHV GHMDVHQ XQD PDRU GHVFHQGHQFLD SRU WDQWR VH DFXPXODUtDQ HQ OD SREODFLyQ ORV JHQHV PiV DSWRV SDUD HVH DPELHQWH /RV SRVWXODGRV GH HVWD WHRUtD VRQ
- 50. 0HFDQLVPRV GH OD HYROXFLyQ /D YDULDELOLGDG JHQpWLFD HQ OD SREODFLyQ VH FRQVLJXH SRU PXWDFLyQ UHFRPELQDFLyQ UHRUJDQL]DFLyQ GH ODV PXWDFLRQHV DFXPXODGDV GXUDQWH HO SURFHVR GH PHLRVLV /D JUDQ GLYHUVLGDG JHQpWLFD FUHDGD GD D OD SREODFLyQ OD SRVLELOLGDG GH XQD JUDQ DGDSWDELOLGDG D XQ PHGLR DPELHQWH FDPELDQWH SRU OR WDQWR OH GD PDRU SUREDELOLGDG GH VREUHYLYLU
- 51. ,(6 %$55,2 /25$1$ 7(0$ (92/8,Ð1 )8(1/$%5$'$ 3iJLQD 3HGUR RERV
- 52. /D VHOHFFLyQ QDWXUDO DFW~D HOLPLQDQGR GH IRUPD DOHDWRULD D ORV JDPHWRV FLJRWRV ODUYDV GH DTXHOORV LQGLYLGXRV TXH WLHQHQ XQDV FDUDFWHUtVWLFDV TXH OHV FRQILHUHQ PHQRU p[LWR UHSURGXFWLYR
- 53. $LVODPLHQWR UHSURGXFWLYR FRPR UHVSRQVDEOH GH OD IRUPDFLyQ GH QXHYDV HVSHFLHV R HVSHFLDFLyQ 'HILQH OD SREODFLyQ FRPR FRQMXQWR GH LQGLYLGXRV VHPHMDQWHV HQWUH Vt FRQ JHQHV FRPXQHV FDSDFHV GH UHSURGXFLUVH HQWUH HOORV GDU XQD GHVFHQGHQFLD IpUWLO 7HRUtD GHO HTXLOLEULR SXQWXDGR GH (OGUHGJH R VDOWDFLRQLVWD 6XSRQH TXH D YHFHV OD HYROXFLyQ VH SURGXFH D VDOWRV SRU DFXPXOR GH PXWDFLRQHV SXQWXDOHV TXH VH PDQLILHVWDQ GH JROSH DO HQFRQWUDUVH FRQ XQ PHGLR DPELHQWH IDYRUDEOH D HOODV 7HRUtD QHXWUDOLVWD GH .LPXUD 6XSRQH TXH OD PXWDFLyQ SXHGH SURGXFLU JHQHV QHXWURV SDUD XQD GHWHUPLQDGD SREODFLyQ TXH QR LQIOXHQ HQ OD VXSHUYLYHQFLD GH OD HVSHFLH SHUR TXH DO WUDQVPLWLUVH SXHGHQ PDQLIHVWDUVH KDFLHQGR TXH DSDUH]FDQ QXHYDV HVSHFLHV 0($1,6026 '( (92/8,Ð1 /DV FDUDFWHUtVWLFDV PDQLIHVWDGDV SRU XQ LQGLYLGXR H LQFOXVR VX FRPSRUWDPLHQWR GHSHQGHQ GH OD VHFXHQFLD GH DPLQRiFLGRV GH VXV SURWHtQDV HQ ~OWLPR WpUPLQR GH OD VHFXHQFLD GH QXFOHyWLGRV HQ VXV iFLGRV QXFOHLFRV HV GHFLU GH OD VHFXHQFLD GH EDVHV GH ORV JHQHV SRU HOOR OD HYROXFLyQ VLHPSUH FRQOOHYD XQ FDPELR HQ HVWD LQIRUPDFLyQ DOPDFHQDGD HQ ORV iFLGRV QXFOHLFRV JHQ JHQ $'1 Ļ Ļ SURWHtQD SURWHtQD Ļ HYROXFLyQ JHQ
- 54. · JHQ
- 56. · SURWHtQD
- 57. · /D HYROXFLyQ VH SRGUi SURGXFLU SRU D $FXPXOR GH PXWDFLRQHV HQ ORV JHQHV HVWUXFWXUDOHV SURGXFWRUHV GH SURWHtQDV 3XHGHQ VHU R ELHQ PXWDFLRQHV SXQWXDOHV JpQLFDV
- 58. TXH VXHOHQ VHU QHXWUDV SDVDQ GHVDSHUFLELGRV HQ OD SREODFLyQ R ELHQ VXVWLWXFLRQHV TXH VH DFXPXODQ UHJXODUPHQWH HQ HO $'1 UHORM PROHFXODU
- 59. SRU OR TXH FRPSDUDQGR ODV SURWHtQDV GH HVSHFLHV GLVWLQWDV SRGUHPRV VDEHU HQ Q~PHUR GH GLIHUHQFLDV HQWUH HOODV SRU WDQWR HO
- 60. ,(6 %$55,2 /25$1$ 7(0$ (92/8,Ð1 )8(1/$%5$'$ 3iJLQD 3HGUR RERV Q~PHUR GH GLIHUHQFLDV HQWUH VXV $'1 GH PRGR TXH FXDQWD PiV GLIHUHQFLD KDD PDRU YD D VHU VX VHSDUDFLyQ HQ OD HYROXFLyQ E 0XWDFLRQHV UHJXODGRUDV TXH DIHFWDQ D ODV SURWHtQDV TXH UHJXODQ OD H[SUHVLyQ GH ORV JHQHV HVWUXFWXUDOHV (VWH HV HO PHFDQLVPR TXH UHJXOD OD IRWRPRUIRJpQHVLV HV GHFLU OD OX] DFWLYD D JHQHV YHJHWDOHV FRQWURODQGR HO FUHFLPLHQWR GH OD SODQWD OD IORUDFLyQ HO Q~PHUR GH KRMDV« F 9DULDELOLGDG JHQpWLFD 3RU YDULDELOLGDG HQWHQGHPRV HO Q~PHUR GH DOHORV GLIHUHQWHV TXH SUHVHQWD XQD SREODFLyQ SDUD XQ GHWHUPLQDGR FDUiFWHU /D YDULDELOLGDG DOWD HQ XQD SREODFLyQ GHWHUPLQD VX HYROXFLyQ D TXH HQ ORV GLVWLQWRV DPELHQWHV VH SRWHQFLDUi XQR GH HOORV HQ GHWULPHQWR GH ORV RWURV KDFLHQGR TXH DSDUH]FDQ GLYHUVDV UD]DV R HVSHFLHV FRQ HO SDVR GH ORV DxRV 3RU HOORV OD UHSURGXFFLyQ VH[XDO IXHQWH GH JUDQ YDULDELOLGDG
- 61. HV PX LPSRUWDQWH FRPR PHFDQLVPR GH HYROXFLyQ DO SURGXFLUVH HQ HOOD OD UHFRPELQDFLyQ JHQpWLFD G $GDSWDFLyQ (V RWUR PHFDQLVPR TXH IDYRUHFH OD HYROXFLyQ SRUTXH XQ RUJDQLVPR VH DGDSWDUi PHMRU D XQ DPELHQWH FXDQWD PiV YDULDELOLGDG KDD HQ HVH DPELHQWH +D FDUDFWHUHV QR DGDSWDWLYRV TXH HYROXFLRQDQ DO PLVPR WLHPSR TXH XQ FDUiFWHU DGDSWDWLYR SURGXFLpQGRVH OD FRHYROXFLyQ R DGDSWDFLyQ GH GRV RUJDQLVPRV TXH FRPSOHPHQWDQ VX VXSHUYLYHQFLD ODV IORUHV HYROXFLRQDQ HQ VX PRUIRORJtD GHSHQGLHQGR GHO DJHQWH SROLQL]DGRU
- 62. H (YROXFLyQ ILOpWLFD $QWH XQ PHGLR DPELHQWH FDPELDQWH HO VHU YLYR SURGXFH FDPELRV HQ VXV GHVFHQGLHQWHV SDUD TXH VH DGDSWHQ SDXODWLQDPHQWH DO PLVPR RULJLQiQGRVH DVt QXHYDV HVSHFLHV VLQ DXPHQWDU HO Q~PHUR GH HOODV 7DO KHFKR RFXUULy FRQ ORV PDVWRGRQWHV TXH HYROXFLRQDURQ D HOHIDQWHV I (VSHFLDFLyQ 5XSWXUD HQ OD HYROXFLyQ ILOpWLFD TXH VXSRQH OD DSDULFLyQ GH QXHYDV HVSHFLHV WDQWR HQ PRUIRORJtD FRPR HQ Q~PHUR /D HVSHFLDFLyQ VH UHDOL]D HQ GRV IDVHV
- 63. ,(6 %$55,2 /25$1$ 7(0$ (92/8,Ð1 )8(1/$%5$'$ 3iJLQD 3HGUR RERV
- 64. ,QWHUUXSFLyQ GHO LQWHUFDPELR GH PDWHULDO JHQpWLFR FRQ RWURV PLHPEURV GH OD SREODFLyQ (O SURFHVR HV JUDGXDO UHYHUVLEOH KDVWD XQ GHWHUPLQDGR SXQWR /D LQWHUUXSFLyQ VH SXHGH FRQVHJXLU SRU x (VSHFLDFLyQ DORSiWULGD 6L ODV SREODFLRQHV TXHGDQ DLVODGDV JHRJUiILFDPHQWH ORV JUXSRV GLYHUJHQ JHQpWLFDPHQWH GLVPLQXH OD YDULDELOLGDG GH KtEULGRV (M ODV HVSHFLHV GH SLQ]RQHV GHO DUFKLSLpODJR GH ODV *DOiSDJRV x (VSHFLDFLyQ VLPSiWULGD 6RQ PHFDQLVPR GH DVLODPLHQWR HFROyJLFR HWROyJLFR«
- 65. 0HFDQLVPRV GH DLVODPLHQWR UHSURGXFWLYRV 6L OD LQWHUUXSFLyQ JpQLFD SHUVLVWH VH GHVDUUROODQ PHFDQLVPRV GH DLVODPLHQWR PiV IXHUWHV GH tQGROH VH[XDO FRPR DLVODPLHQWR PHFiQLFR DLVODPLHQWR JDPpWLFR QR KD DWUDFFLyQ HQ ORV JDPHWRV SRU OR TXH QR KD IHFXQGDFLyQ
- 66. 0,52(92/8,Ð1 0$52(92/8,Ð1 /D PLFURHYROXFLyQ HV OD DSDULFLyQ GH FDPELRV SXQWXDOHV GLIHUHQWHV HQ XQ DQWHSDVDGR FRP~Q XQD HVSHFLH
- 67. GHELGR D OD DGDSWDFLyQ D GLIHUHQWHV PHGLRV DPELHQWHV OR TXH FRQGLFLRQD OD FUHDFLyQ GH QXHYDV HVSHFLHV PX VHPHMDQWHV HQWUH Vt SHUR GLIHUHQWHV HQ DOJXQRV FDUDFWHUHV (O SURFHVR VH GHQRPLQD UDGLDFLyQ HYROXWLYD R HYROXFLyQ GLYHUJHQWH FRPR RFXUULy FRQ ORV SLQ]RQHV GH ODV *DOiSDJRV TXH VRQ PX VHPHMDQWHV HQWUH Vt SHUR TXH VH GLIHUHQFLDQ HQ HO WLSR GH SLFRV TXH SRVHHQ DGDSWDGRV D ORV WLSRV GH DOLPHQWDFLyQ TXH KD HQ ODV GLVWLQWDV LVODV 7DPELpQ VH VXHOHQ FDPELRV VHPHMDQWHV HQ GLVWLQWDV HVSHFLHV GHELGR D OD SUHVLyQ GHO PHGLR TXH RULJLQD VHUHV YLYRV VHPHMDQWHV HQ DOJXQR GH VXV FDUDFWHUHV SHUR GH GLVWLQWDV HVSHFLHV HVWH SURFHVR VH GHQRPLQD HYROXFLyQ FRQYHUJHQWH
- 68. ,(6 %$55,2 /25$1$ 7(0$ (92/8,Ð1 )8(1/$%5$'$ 3iJLQD 3HGUR RERV /D PDFURHYROXFLyQ HV HO GHVDUUROOR GH JUDQGHV FDPELRV GLIHUHQFLDOHV HQ ODV SREODFLRQHV GHELGR D XQ DFXPXOR GH PXWDFLRQHV HQ OD SREODFLyQ SUHH[LVWHQWH TXH KDFH TXH VH IRUPHQ SREODFLRQHV PX GLIHUHQWHV HQWUH Vt FRPR RFXUULy HQ OD HYROXFLyQ GH UHSWLOHV KDFLD DYHV PDPtIHURV 358(%$6 '( /$ (92/8,Ð1 /DV SUXHEDV GH OD HYROXFLyQ VH FODVLILFDQ HQ GRV JUDQGHV JUXSRV 3UXHEDV FOiVLFDV 6RQ ODV XWLOL]DGDV SRU 'DUZLQ SRVWHULRUHV SDUD H[SOLFDUOD HYROXFLyQ GH ODV HVSHFLHV SXHGHQ VHU 3UXHEDV GH PRUIRORJtD DQDWRPtD FRPSDUDGD 6H REVHUYD TXH HVSHFLHV GH KiELWDWV DLVODGRV PRQWDxDV LVODV RFHiQLFDV
- 69. WLHQHQ LQGLFLRV PRUIROyJLFRV GH WHQHU XQD HVSHFLH DQFHVWUDO FRP~Q SRUTXH VRQ PX VLPLODUHV HQ PRUIRORJtD VH GLIHUHQFLDQ VyOR HQ DOJXQRV FDUDFWHUHV TXH VH H[SOLFDQ FRPR FRQVHFXHQFLD GH OD DGDSWDFLyQ DO PHGLR DPELHQWH GRQGH YLYHQ 7DO HV HO FDVR GH ORV 3LQ]RQHV GH ODV *DOiSDJRV PX VLPLODUHV HQWUH Vt VLPLODUHV D ORV SLQ]RQHV JUDQtYRURV WHUUHVWUHV GHO (FXDGRU KHFKR TXH VH H[SOLFD DGPLWLHQGR TXH HQ HO SDVDGR HO SLQ]yQ GHO (FXDGRU HPLJUy D ODV LVODV DTXt VH DGDSWy D ODV GLVWLQWDV FRQGLFLRQHV GH ODV GLVWLQWDV LVODV
- 70. ,(6 %$55,2 /25$1$ 7(0$ (92/8,Ð1 )8(1/$%5$'$ 3iJLQD 3HGUR RERV RPSDUDQGR OD DQDWRPtD GH GLVWLQWRV VHUHV YLYRV VH GHWHUPLQDQ D +RPRORJtDV RUJiQLFDV 'RV yUJDQRV VRQ KRPyORJRV FXDQGR VLHQGR GLIHUHQWHV PRUIROyJLFDPHQWH SRU DGDSWDFLyQ D PHGLRV GLIHUHQWHV VLQ HPEDUJR WLHQHQ XQD HVWUXFWXUD DQDWyPLFD VLPLODU GHELGR D TXH SURFHGHQ GH XQ DQWHFHVRU FRP~Q $Vt RFXUUH FRQ ODV H[WUHPLGDGHV GH YHUWHEUDGRV WUDQVIRUPDGDV HQ DOHWDV SDWD FRUUHGRUD DOD R EUD]R E $QDORJtDV RUJiQLFDV 'RV yUJDQRV VRQ DQiORJRV FXDQGR WHQLHQGR XQ RULJHQ HVWUXFWXUD DQDWyPLFD GLIHUHQWH VLQ HPEDUJR WLHQHQ XQD PRUIRORJtD VLPLODU SRU DGDSWDFLyQ D XQ PLVPR PHGLR 7DO HV HO FDVR GH ODV DOHWDV GH ORV SHFHV ODV EDOOHQDV R ODV DODV GH PDULSRVDV DYHV PXUFLpODJRV 7DPELpQ VRQ PX LPSRUWDQWHV HYROXWLYDPHQWH ORV yUJDQRV YHVWLJLDOHV X yUJDQRV TXH VH UHGXFHQ HQ XQD HVSHFLH DO QR UHDOL]DU QLQJXQD IXQFLyQ FRQFUHWD HQ HOOD SHUR TXH HUDQ LPSRUWDQWHV UHDOL]DEDQ XQD GHWHUPLQDGD IXQFLyQ HQ OD HVSHFLH GH OD TXH SURFHGH (Q HO KRPEUH VRQ yUJDQRV YHVWLJLDOHV HO FR[LV OD PXHOD GHO MXLFLR HO DSpQGLFH YHUPLIRUPH
- 71. ,(6 %$55,2 /25$1$ 7(0$ (92/8,Ð1 )8(1/$%5$'$ 3iJLQD 3HGUR RERV 3UXHEDV SDOHRQWROyJLFDV /D 3DOHRQWRORJtD HV OD FLHQFLD TXH VH RFXSD GHO HVWXGLR GH ORV IyVLOHV QRV KD DSRUWDGR PXFKDV SUXHEDV TXH UHODFLRQDQ ORV VHUHV YLYRV GHO SDVDGR FRQ ORV DFWXDOHV SHUPLWLpQGRQRV HVWDEOHFHU OtQHDV GH HYROXFLyQ DO FRPSUREDU TXH DOJXQRV yUJDQRV WLHQHQ XQD HYROXFLyQ SURJUHVLYD $Vt RFXUUH FRQ OD HYROXFLyQ GH ORV FDEDOORV GHVGH (RKLSSXV FRQ FXDWUR GHGRV HQ OD SDWD D (TXXV FRQ XQ GHGR SRU XQD DGDSWDFLyQ D OD FDUUHUD 3UXHEDV ELRJHRJUiILFDV 6H UHILHUHQ DO KHFKR GH TXH KD VHUHV YLYRV TXH VRQ H[FOXVLYRV GH XQD GHWHUPLQDGD ]RQD SRUTXH KD KDELGR XQD EDUUHUD ELRJUHRJUiILFD TXH KD LPSHGLGR VX H[SDQVLyQ FRPR RFXUUH FRQ HO FDQJXUR R HO NRDOD GRV PDUVXSLDOHV GH $XVWUDOLD ~QLFRV HQ HO PXQGR SRU HVWDU HVWD WLHUUD DLVODGD GHO UHVWR GH FRQWLQHQWHV 7DPELpQ ODV SUXHEDV ELRJHRJUiILFDV QRV LQIRUPDQ GH OD SUR[LPLGDG GH FRQWLQHQWHV VHSDUDGRV HQ OD DFWXDOLGDG FRPR RFXUUH FRQ ORV FDPpOLGRV DIULFDQRV GURPHGDULR FDPHOOR
- 73. SRU OR TXH VHUtD OD VHSDUDFLyQ GH ORV FRQWLQHQWHV OD FDXVD GH OD HVSHFLDFLyQ VH TXH SURGXFH HQ HOORV 3UXHEDV HPEULROyJLFDV 6H EDVD HQ HO HVWXGLR GH ORV HPEULRQHV SDUD H[WUDHU VHPHMDQ]DV R GLIHUHQFLDV HYROXWLYDV $Vt VH REVHUYD TXH ORV HPEULRQHV GH ORV YHUWHEUDGRV VRQ PX VHPHMDQWHV HQWUH Vt KDVWD XQ GHWHUPLQDGR PRPHQWR LQGLFDQGR FRQ HOOR HO RULJHQ FRP~Q GH ORV PLVPRV 3RU HOOR VH GLFH TXH HO GHVDUUROOR HPEULRQDULR X RQWRJHQLD HV UHIOHMR GHO GHVDUUROOR HYROXWLYR R ILORJHQLD
- 74. ,(6 %$55,2 /25$1$ 7(0$ (92/8,Ð1 )8(1/$%5$'$ 3iJLQD 3HGUR RERV 3UXHEDV DFWXDOHV (VWiQ EDVDGDV HQ ELRORJtD PROHFXODU VRQ ,QPXQROyJLFDV XDQGR XQD SDUWtFXOD H[WUDxD R DQWtJHQR SHQHWUD HQ XQ VHU YLYR pVWH SURGXFH XQD UHDFFLyQ GHIHQVLYD IUHQWH D pO SURGXFLHQGR XQDV SURWHtQDV HVSHFtILFDV R DQWLFXHUSR TXH VH XQHQ DO DQWtJHQR SDUD QHXWUDOL]DUOR $ OD UHDFFLyQ VH OD GHQRPLQD ´UHDFFLyQ DQWtJHQR DQWLFXHUSRµ 6H FRPSUXHED TXH ODV UHDFFLRQHV DQWtJHQRDQWLFXHUSR VRQ WDQWR PiV YLUXOHQWDV FXDQWR PiV DOHMDGDV ILORJHQpWLFDPHQWH HVWiQ ODV HVSHFLHV 6HFXHQFLDFLyQ GH SURWHtQDV $O FRPSDUDU OD PLVPD SURWHtQD GH GRV HVSHFLHV GLVWLQWDV SRGHPRV VDEHU VL HVWiQ PiV R PHQRV HPSDUHQWDGDV GHSHQGLHQGR GH ODV GLIHUHQFLDV TXH KDD HQWUH HOODV (V PX XWLOL]DGD OD FRPSDUDFLyQ GH KHPRJORELQD PLRJORELQD HQ DQLPDOHV OD FRPSDUDFLyQ GH SLJPHQWRV IRWRVLQWHWL]DGRUHV HQ SODQWDV +LEULGDFLyQ /DV GRV KHEUDV GH ODV PROpFXODV GH $'1 SXHGHQ VHSDUDUVH EDMR GHWHUPLQDGDV FRQGLFLRQHV IHQyPHQR GHQRPLQDGR GHVQDWXUDOL]DFLyQ (VWD SURSLHGDG VH XWLOL]DGD SDUD FRPSDUDU HO JUDGR GH DSDUHDPLHQWR KLEULGDFLyQ
- 75. GH $'1V GH HVSHFLHV GLVWLQWDV DO PH]FODU $'1 GHVQDWXUDOL]DGR GH GLFKDV HVSHFLHV SXGLHQGR H[WUDHU FRQFOXVLRQHV VREUH VX SUR[LPLGDG HYROXWLYD GHSHQGLHQGR GHO JUDGR GH DSDUHDPLHQWR GH VXV $'1V UHVSHFWLYRV D TXH D PDRU DSDUHDPLHQWR PDRU SUR[LPLGDG HQ OD HYROXFLyQ
- 80. !! # $ # %
- 81. !
- 82. $ ' ( ) * + , -.!/
- 83. #$! % (0 10 $!0 23!0 $ 4 5 6 %
- 84. %!% * , / 5 3 $! ! ! 3 3 758 5 896 626(7* 9:6 626(7* ) * 9 ; $ ' ( ) * (0 10 23!0 $!0 $ 4 2 $ $ = 8 5 ; 2 9 *
- 86. '
- 87. ' '(
- 88. )
- 91. ' ' 6 @ @
- 92. @ # 5
- 93. % 5 ? # ? 7 A # @ # B 758 5
- 94. ? A / B 6 $ A/B 6 * A/B
- 95. 3 * 5 ' C !D D E
- 96. 3 $ ' 3 ( 3 .F ! -E F G * #? 3 # G 6 $ ( #
- 97. 3 @ 3 # 6 3 4 @
- 98. 3
- 99. #
- 102. G 6 $ ' ( N #
- 103. # 3 3 3 N ? 6 ?
- 104. 3?
- 105. * +
- 106. # ,#!
- 107. !
- 108. ,#!
- 109. -#
- 110. #.
- 111. 6 @ # #
- 112. $!
- 113. # #
- 114. % # # 3 % %/ %/ 453 4$! 4* 4: P 4
- 115. 4)
- 116. 4Q
- 117. '01
- 118. )
- 120. '
- 121. 2 2 3 * 3? 6 ? # ? ? ?
- 122. 3? * # 3 3? #
- 123. 3 *3 # % 4: P @ 4
- 124. 4) A
- 125. B 4Q #
- 127. % 4: P
- 128. # 3 4
- 129. % ? 4 ? # 3 5 3 3 N # 3 ) !!4!$ * !! 4! 5 ! ' ' +
- 130. )
- 132. ' )
- 133. A / B ) ' ' ' : P
- 134. ) Q ( 5+( 5( ) 53 * F ! E . ! F CE D !E !E !
- 135. 2 ? # 3? ? * ? 6 # ? ? * ! ? ? R C ? Unión mediante enlaces covalentes de los diferentes átomos que constituyen una biomolécula. $ * ' $$ ' ' ' ' '
- 137. ? 5
- 138. , % 4$4$4 4 4$S$4 6 3 6 ? 3 % $4$ $4 $4( $4' * # 3
- 139. 3 3 @ 3 ? 3 A
- 140. 3 3 B @
- 141. ? ! $!$ 6 ? 3 3 3 ' '(
- 142. )
- 143. 1
- 144. )
- 145. ' 6 P . A=S. 5S!B * ! ! ! !! $ @ @ ? ? 6 # # $! 3 # A$F$B
- 146. 2
- 147. )
- 148. '
- 150. )
- 151. '
- 152. 6 ? C P 6 @ ? # 6 % 4 @ 6 ? ? ? 6 @ Polaridad del enlace-O-H y del enlace N- H. T 4 T 0 ) U4' T 4 T 0 ) U(4' Enlaces covalentes que pueden tener el resto de los bioelementos primarios. '
- 153. (
- 154. ( (
- 155. * * !
- 156. Enlaces covalentes que puede tener el átomo de carbono al unirse a otros bioelementos. $ # $ $
- 157. % $ $
- 158. %
- 159. $
- 161. ? 3 @ 4 @ 3 6 ? ? 6 ? # ? 3 ? 3 ? ? 3 ? ? 4 @ 3 $ ? ? ? ? #
- 162. 6
- 163. )
- 164. '01 #
- 165. ? ?
- 166. 4 %
- 167. 3 3 # # ? 3? *
- 168. '01 3? 3
- 169. ? 7#
- 170. % #
- 171. 7#! # % 45 @ @ 45 @
- 172. 4$ 4Q 3? Hibridaciones del átomo de carbono. ' ( $ $ $ $ '
- 173. '
- 174. '
- 175. Ejemplos de esqueletos carbonados de las biomoléculas. ) * ( +
- 176. 4$4 $4 $4 $4 $4 $4 $4 $4 4$4 $4 $S$4 $4 $S$4 $4 4$4 $4 $4 $4 $4 4$4 $4 $4 4$4 $4 $4 B $ !B $ FB $ # CB EB $
- 177. Los principales frupos funcionales. J($9(6* +:Q(9$5* $ % 53
- 178. ? 5 @ % 44' $ % V$S 5 @
- 179. % 4$' Q % 4$' 5 % 4('! 5 % 4$('! 7 % 4*4'
- 181. 45 45 47 # ? # $ ' A# 3 BR 3 3 # 3 @
- 182. # 4 R # @
- 183. @ 3 6 # # ? # A4*'B 6 # 3 ? 6 # # ? # ? # # A'F)CB A # # B # # # #3 0
- 184. ' ))
- 185. 6(
- 186. )
- 187. *
- 188. '01 @ @ 3 A B # @
- 189. ? ) ? @
- 190. @ 6 3 3
- 191. * ' +
- 192. )
- 193. 3? # # 6 % B *8 #!
- 194. $! !$!
- 195. ## !% 6 ? Los principales grupos funcionales. Representación en un modelo de esferas de una biomolécula: un aminoácido. $ @ ' $ @
- 196. ' $ $ * ' $ ? ' $ ( ' ' $ ( ' ' G 6 @ @ 3 $$ órmulas desarrollada, semidesarrollada y empírica del etano. $ ' ' ' $ ' ' ' $'F4$'F
- 197. $!'.
- 199. # 6 # ? # , B *8 #!
- 200. $! !$!% P 6 ? ? 3 3P A , % $'F4 4$'!4 $'!'4 4$''4 $'4 4$4 4$' 4$'('!4B B *8 #!
- 201. 9 !% 6 P P ? @ R
- 202. #
- 203. 3 % $.'!. 6 #
- 204. @ @ # 3 #
- 205. # # 6 , , # 5
- 206. 3 ? 3
- 207. @ 3
- 208. # 7 #
- 209. @ 3
- 210. )
- 211. ( '
- 213. + ' ? # ? ) , ? # 3
- 214. ? # ? $ # 3 8 9
- 215. ! ,#! ) N : A! ,#!; C ? . Ejemplo de representación entre desarrollada y semidesarrollada de la glucosa, en la que algunas funciones se han agrupado. ' ' ' ' ' ' ' ' $'!' ' $ $$ $ $ Representación semidesarrollada de los principales grupos funcionales. Representación simplificada de una biomolécula. @ $' @
- 216. $ $'*' $' ? $'!('! $('! $'!' $$
- 218. J % AB AB S S ..G 4!C 3
- 220. '
- 222. ' ' 3 ,
- 223. 3? 3? J N N % '0 AB ? D ? 7
- 224. #
- 225. # 6 # 3 3 N 6 % 46 * # 3 4$' 4('! 6 3 3 % 4$' 4$4 0 '0 4('! 0 '0 4('F 0 6 # ? Fragmento de la molécula de almidón. El almidón es un polímero formado por el monómero glucosa.
- 227. 3 3 3 4$4 3 4('0 F 6 !4 # *
- 228. #
- 229. 3 4*4' 4*4*4 6 4 4
- 230. 3 4 F46 @ 3 * 3 P 3 3 @ 3 3 5
- 231. , 3 4$44'
- 232. 3 ? 3 @ 3 @
- 233. # 6
- 234. 3 @? 3 3 @ 3 ? 3 4 3 4$4(4' # 3 $ 3 ? # ? 3 A'B 3 3 A , B 6 3
- 235. ? C4 ; L * # ? N # 3 ? 5 P E4 J @ # $ 3 ?
- 236. 6 3
- 237. #3 @
- 238. 6 ? @ 3 3 #3 3 P Puentes disulfuro (4) entre las subunidades de una proteína.
- 239. Puentes o enlaces de hidrógeno entre las bases nitrogenadas del ADN. Enlaces iónicos entre grupos -COOH y H2N- : 4$' : '!(4$4
- 240. %,2(/(0(1726 %,202/e8/$6 BIOQUÍMICA I. BIOELEMENTOS A. Concepto - Se denominan elementos biogénicos o bioelementos a aquellos elementos químicos que forman parte de los seres vivos. B. Clasificación 1. Elementos mayoritarios - Están presentes en porcentajes superiores al 0,1 % y aparecen en todos los seres vivos. a. Bioelementos primarios (C, H, O, N /// P, S) - Principales constituyentes de las biomoléculas. En conjunto 95% de la materia viva (C 20 %, H 9.5 %, O 62 % y N 2,5 %). b. Bioelementos secundarios (Na, K, Ca, Mg, Cl) - En conjunto 4,5% de la materia viva. 2. Oligoelementos (Fe, Mn, I, F, Co, Si, Cr, Zn, Li, Mo) - Presentes en porcentajes inferiores al 0,1%, no son los mismos en todos los seres vivos. Son indispen- sables para el desarrollo armónico del organismo. - Se han aislado unos 60 oligoelementos en los seres vivos, pero solamente 14 de ellos pueden conside- rarse comunes para casi todos II. BIOMOLÉCULAS - Las biomoléculas o principios inmediatos, son las moléculas que forman parte de los seres vivos. Agua Inorgánicas Sales minerales Glúcidos Lípidos Proteínas Biomoléculas Orgánica Ácidos nucleicos III. BIOMOLÉCULAS INORGÁNICAS A. El agua - El agua - 60-90% de la materia viva. Su abundancia depende de la especie, la edad (menor proporción en individuos más viejos) y la actividad fisiológica del tejido (mayor porcentaje los que tiene mayor actividad como tejido nervioso o muscular). Aparece en el interior de las células, en el líquido tisular y en los líquidos circulantes. 1. Estructura - El agua es una molécula dipolar: los electrones que comparten el O y el H están desplazados hacia el O por su mayor electronegatividad por lo que esa zona de la molécula tiene una ligera carga negativa y la de los H es ligeramente positiva. Cuando dos moléculas de agua se aproximan, la zona positiva de una molécula y la negativa de otra se atraen. Estas interacciones intermoleculares se conocen como puentes de hidrógeno. 2. Propiedades y funciones biológicas - A diferencia de otras sustancias de peso molecular semejante, el agua es líquida a temperatura am- biente. Debido a su polaridad el agua es buen disolvente de los compuesto iónicos y polares. Los líqui- dos orgánicos (citoplasma, líquido tisular, plasma, linfa, savia, ...) son disoluciones acuosas que sirven para el transporte de sustancias y como medio en el que se producen las reacciones metabólicas. - El agua no sólo es el medio en el que transcurren las reacciones del metabolismo sino que interviene en muchas de ellas como en la fotosíntesis, en las hidrólisis y en las condensaciones. - El calor específico (calor necesario para elevar 1ºC la temperatura de 1 g) es relativamente elevado, así como el calor de vaporización. Gracias a estas dos propiedades el agua interviene en la termorregula- ción. - Máxima densidad a 4°C. Como consecuencia el hielo flota sobre el agua líquida, lo que impide los océanos y otras masas menores de agua se congelen de abajo a arriba. - En el agua son elevadas las fuerzas de cohesión (atracción entre las moléculas de agua) y de adhesión (atracción entre el agua y una superficie) lo cual origina los fenómenos de capilaridad por los que el agua asciende en contra de la gravedad por conductos de diámetro muy fino (capilares). Estos fenó- menos contribuyen al transporte de sustancias en los vegetales. - Igual que otros líquidos el agua es incompresible y actúa como amortiguador mecánico (líquido amnió- tico, líquido sinovial) o como esqueleto hidrostático (líquido celómico en anélidos).
- 241. %,2(/(0(1726 %,202/e8/$6 B. Las sales minerales 1. Sales con función estructural - Aparecen precipitadas formando estructuras esqueléticas, como el carbonato de calcio (caparazones calcáreos) o el fosfato de calcio (esqueleto de vertebrados). 2. Sales con función reguladora - Se encuentran ionizadas, disueltas en un medio acuoso. a. Fenómenos osmóticos - Osmosis: difusión a través de una membrana semipermeable (solo permite el paso del disolvente). - Medios hipertónico (el de mayor concentración), hipotónico (el de menor) o isotónico (cuando los dos medios separados por la membrana semipermeable tienen la misma concentración de solutos). - A través de una membrana semipermeable el agua pasa siempre del medio hipotónico al hipertónico. - Plasmólisis (pérdida de agua de una célula en un medio hipertónico) y turgencia (la célula se hincha en un medio hipotónico, pudiendo llegar a estallar (lisis) si carece de pared celular y la diferencia de concentraciones es grande). b. Regulación del pH - Soluciones amortiguadoras formados por un ácido débil y su base conjugada (o viceversa). - El equilibrio H2CO3 ' HCO3 - + H + es responsable del mantenimiento del pH en la sangre. Si el pH tiende a acidificarse el exceso de H+ se une al HCO3- (que actúa como base) formándose H2CO3 recuperándose el pH inicial. Ante una basificación del medio el equilibrio se desplaza hacia la dere- cha liberándose H + por disociación del H2CO3 (un ácido débil) recuperándose también el pH inicial. La regulación es más precisa porque el H2CO3 se encuentra en equilibrio con el CO2 disuelto en el plasma (CO2 + H2O ' H2CO3' HCO3 - + H + ). c. Cationes que realizan acciones específicas - Na + - Impulso nervioso y equilibrio hídrico. Abundante en los medios extracelulares. - K + - Transmisión del impulso nervioso. Contracción muscular. - Ca 2+ - Contracción muscular. Coagulación sanguínea. Sinapsis. Cofactor. Estructural. - Mg 2+ - Cofactor. Contracción muscular. IV. BIOMOLÉCULAS ORGÁNICAS *UXSRV )XQFLRQDOHV +LGUyILORV *UXSRV )XQFLRQDOHV +LGUyIRERV DUER[LOR 22+ 5DGLFDO $OTXtOLFR + 5 +LGUR[LOR R $OFRKRO 2+ 5DGLFDO HWLOpQLFR + 5 DUERQLOR ! 2 5DGLFDO IHQLOR + $PLQR 1+ /RV JUXSRV IXQFLRQDOHV SRODUHV VRQ VROXEOHV HQ DJXD R KLGUyILORV /RV QR SRODUHV VRQ LQVROXEOHV R KLGUyIRERV A. Glúcidos 1. Concepto - Biomoléculas orgánicas formadas por C, H y O - Químicamente se pueden definir como polihidroxialdehídos o polihidroxicetonas - Funciones biológicas: energética y estructural - Se pueden clasificar en glúcidos sencillos (monosacáridos), que no se pueden descomponer por hidróli- sis en otros glúcidos, y complejos que sí se pueden descomponer. Los glúcidos complejos comprenden a los disacáridos (dos monosacáridos unidos), a los oligosacáridos (entre tres y diez monosacáridos) y a los polisacáridos (más de diez). 2. Monosacáridos a. Concepto y clasificación - Azúcares sencillos, no hidrolizables, de 3 a 7 átomos de C (triosas, tetrosas, pentosas, hexosas). Si tienen un grupo aldehído se llaman aldosas y si tienen un grupo cetona cetosas b. Propiedades físicas - Sólidos, blancos, cristalizables. Solubles en agua (compuestos polares). Generalmente dulces. c. Principales monosacáridos Triosas - Gliceraldehído y dihidroxiacetona – importantes intermediarios metabólicos. Gliceraldehído Dihidroxiacetona
- 242. %,2(/(0(1726 %,202/e8/$6 Pentosas - Ribosa – componente de ribonucleótidos (ATP, nucleótidos del ARN). - Desoxirribosa (falta un –OH en el carbono 2) – componente de desoxirribonucleótidos (nucleótidos del ADN) - Ribulosa – un derivado, la ribulosa-1,5-difosfato, es responsable de la fijación del CO2 en la foto- síntesis. Ribosa Desoxirribosa Ribulosa Hexosas - Glucosa – función energética: principal combustible metabólico. Componente de polisacáridos es- tructurales y energéticos. - Galactosa – Combustible metabólico. Forma parte de la lactosa (azúcar de la leche). - Fructosa – Combustible metabólico. Forma parte de la sacarosa. Aparece en frutas y líquidos se- minales. Glucosa Galactosa Fructosa 3. Estructura de las pentosas y hexosas en disolución - Estructura lineal (proyección de Fischer). No explica el comportamiento de los monosacáridos en disolu- ción. - Estructura cíclica (proyección de Haworth) Formación de un hemiacetal (aldosas) o hemicetal (cetosas) intramolecular (entre un grupo carbonilo y otro hidroxilo). Ribosa Desoxirribosa Glucosa Galactosa Fructosa 4. Disacáridos a. Concepto - Oligosacáridos formados por la unión de dos monosacáridos mediante un enlace O-glucosídico que se produce al interaccionar un grupo OH de cada uno de los monosacáridos, liberándose una molé- cula de agua y quedando un O como puente de unión entre ambos monosacáridos. b. Propiedades - Cristalizables, dulces, solubles. - Mediante hidrólisis se desdoblan en monosacáridos. c. Principales disacáridos - Maltosa (glucosa - glucosa). Producto de la hidrólisis del almidón y el glucógeno. - Celobiosa (glucosa - glucosa). Producto de la hidrólisis de la celulosa. - Lactosa (glucosa - galactosa). Combustible metabólico. Se encuentra en la leche. - Sacarosa (glucosa - fructosa). Combustible metabólico. Azúcar común que se extrae de la caña de azúcar y de la remolacha azucarera. Maltosa Lactosa Sacarosa
- 243. %,2(/(0(1726 %,202/e8/$6 5. Polisacáridos a. Concepto - Macromoléculas formadas por polimerización* de monosacáridos unidos entre sí mediante enlaces O-glucosídicos. * Un polímero es una macromolécula formada por la repetición de una subunidad básica conocida co- mo monómero. En este caso los monómeros son los monosacáridos. b. Propiedades - Peso molecular elevado (son macromoléculas). - Hidrolizables (por hidrólisis generan monosacáridos) - No dulces. Insolubles c. Principales polisacáridos - El almidón y el glucógeno actúan como reservas energéticas y son hidrolizados en glucosas cuan- do ésta es necesaria. La acumulación de glucosa libre en las células generaría problemas osmóti- cos. - La celulosa y la quitina son polisacáridos estructurales. Los enlaces entre los monosacáridos son más resistentes a la hidrólisis. Almidón - Polímero de la glucosa. Presenta dos formas estructurales: amilasa (forma helicoidal no ramifica- da) y amilopectina (forma helicoidal ramificada). - Reserva energética en vegetales. Aparecen formando gránulos característicos: amiloplastos. Abundante en la patata y en muchas semillas. Amilosa Amilopectina - Glucógeno - Semejante a la amilopectina pero con más ramificaciones. - Reserva energética en animales. Se acumula en el hígado y en los músculos. - Celulosa - Polímero de la glucosa. Estructura lineal no ramificada. Es la molécula más abundante en la natu- raleza. - Función estructural en vegetales: principal componente de la pared celular. Su estructura lineal fa- vorece la disposición en paralelo de varias moléculas que se unen mediante puentes de hidróge- no. - Difícilmente digerible, solo ciertas bacterias (como las que viven en simbiosis en el estómago de los rumiantes) producen enzimas capaces de hidrolizar la celulosa. - Quitina - Polímero de un derivado de la glucosa: la N-acetilglucosamina - Función estructural: principal componente de la pared celular de los hongos y del exoesqueleto de artrópodos. B. Lípidos 1. Concepto - Biomoléculas orgánicas formadas por C, H y O; en algunos casos también P y N. - Químicamente heterogéneos. - Insolubles en agua, pero solubles en disolventes orgánicos apolares. - Presentan un brillo característico y son untuosos al tacto. 2. Ácidos grasos a. Concepto - Ácidos monocarboxílicos de cadena larga (14 - 22C, siempre nº par). Los ácidos grasos son compo- nentes de muchos lípidos y precursores de otros. b. Tipos Saturados - No presentan dobles enlaces en la cadena hidrocarbonada. - Puntos de fusión más altos que los insaturados del mismo número de carbonos. Son más abun- dantes en grasas de animales. - Palmítico (16C), Esteárico (18C). Ácido palmítico
- 244. %,2(/(0(1726 %,202/e8/$6 Insaturados - Presentan uno o más dobles enlaces en la cadena hidrocarbonada. - Puntos de fusión más bajos que los saturados del mismo número de carbonos. Predominan en grasas de origen vegetal. - Oleico (18:1∆9 ), Linoleico (18:2∆9,12 ), Araquidónico (20:4∆5,8,11,14 ) Ácido oleico Ácido linoleico Ácido araquidónico 3. Esterificación y saponificación a. Esterificación - La esterificación es la reacción de formación de ésteres. Como veremos, los lípidos saponificables que vamos a estudiar este año son ésteres de ácidos grasos. - Reacción de un grupo carboxilo con un grupo hidroxilo (ácido + alcohol → éster + agua). Existen también ésteres en los que el ácido que reacciona con el alcohol es inorgánico (ésteres fosfóricos, sulfúricos, …) b. Saponificación - Hidrólisis de un éster en un medio alcalino (éster + álcali → jabón + alcohol). - Jabón: sal del ácido orgánico que resulta de la hidrólisis en medio alcalino de un éster. 4. Clasificación a. Lípidos saponificables (lípidos complejos) - Esteres formados por un alcohol y ácidos grasos. Grasas neutras (acilglicéridos) Estructura - Glicerina + 1-3 ácidos grasos. Los más importantes son los triacilglicéridos (triglicéridos). Pueden ser grasas simples (ácidos grasos iguales) o mixtas (ácidos grasos diferentes). - Sebos (grasas sólidas), mantecas (semisólidas) y aceites (líquidas). Los sebos y mantecas son ca- racterísticos de los animales y tiene predominio de ácidos grasos saturados. Los aceites son ca- racterísticos de los vegetales y contiene principalmente ácidos grasos insaturados. Triacilglicérido Funciones - Reserva energética en animales y vegetales (producen más calorías por gramo que los glúcidos y las proteínas), protección, aislamiento térmico (se depositan bajo la piel de los animales de sangre caliente y evitan las pérdidas de calor).
- 245. %,2(/(0(1726 %,202/e8/$6 Ceras Estructura - Monoalcohol de cadena larga + ácido graso. Moléculas fuertemente hidrófobas. Funciones - Estructural y protectora. Forman la película que impermeabiliza la superficie de las hojas y frutos de las plantas. En los animales forman cubiertas protectoras de la piel, pelo y plumas, así como del exoesqueleto de muchos insectos. Fosfolípidos Estructura - Glicerina + 2 ác. grasos + ácido fosfórico. + aminoalcohol Fosfolípido Función - Moléculas anfipáticas: zona polar (glicerina, ác. fosfórico y aminoalcohol); zona apolar (ác. grasos). - Función estructural: son uno de los principales componentes de todas las membranas de todas las células, en las que se disponen formando bicapas. b. Lípidos no saponificables (lípidos simples) - No contienen ácidos grasos y no son ésteres. Constituyen un grupo de moléculas con gran actividad biológica que desempeña funciones muy variadas. Terpenos Estructura - Polímeros del isopreno. Presentan dobles enlaces alternos por lo que frecuentemente son molécu- las coloreadas. β-Caroteno Vitamina A Funciones - Esencias vegetales (mentol, geraniol, limoneno, alcanfor...) - Vitaminas A, K y E. - Carotenoides (licopeno -rojo-, β-caroteno -anaranjado-, xantofila -amarillo-, ...). Son pigmentos fo- tosintéticos que complementan a la clorofila. El β-caroteno es el precursor de la vitamina A. Esteroides Estructura - Derivados del esterano (hidrocarburo policíclico). Se diferencian unos de otros en el número y po- sición de dobles enlaces y en el tipo, número y posición de los grupos funcionales sustituyentes. Esterano Colesterol Funciones - Estructural: el colesterol se encuentra en las membranas celulares de muchos animales y en las li- poproteínas del plasma sanguíneo. Es además precursor de otros esteroides. Su acumulación en las paredes de los vasos sanguíneos es responsable de la arteriosclerosis. - Los ácidos biliares son derivados del colesterol que facilitan la emulsión de las grasas. - Vitamínica: el ergosterol es precursor de la vitamina D; se transforma en ella en la piel por acción de la luz ultravioleta. - Hormonal: progesterona y estradiol (hormonas sexuales femeninas); testosterona (hormona sexual masculina); Aldosterona (corticoide).
- 246. %,2(/(0(1726 %,202/e8/$6 C. Proteínas 1. Concepto - Biomoléculas orgánicas formadas por C, H, O, N y S. También pueden aparecer otros elementos en menores proporciones. Son macromoléculas de elevado peso molecular (5.000 - 1.000.000) formadas por la polimerización de aminoácidos. - Constituyen un 50% del peso seco de un organismo. - Son específicas de cada especie e incluso de cada organismo. - Biológicamente muy activas. Desempeñan una gran diversidad de funciones. 2. Aminoácidos a. Concepto (αααα-aminoácidos) - Parte común: carbono α, grupo α-amino, grupo α-carboxilo y H–. Parte variable: radical. Existen veinte radicales distintos en los aminoácidos que constituyen las proteínas de los seres vivos. radical grupo α-amino grupo α-amino hidrógeno b. El enlace peptídico - Enlace entre el grupo α-carboxilo de un aminoácido y el α-amino de otro, liberándose una molécula de agua. - La unión de dos aminoácidos mediante un enlace peptídico se denomina dipéptido. Si el nº de ami- noácidos es menor de cien se denomina polipéptido y con más de cien es una proteína. 3. Estructura - La función de las proteínas está relacionada con su estructura tridimensional. Se pueden distinguir cua- tro niveles de complejidad estructural creciente: a. Estructura primaria - Cada proteína se caracteriza por el número, tipo y orden de los aa que la componen. - Esta secuencia de aa condiciona los niveles estructurales siguientes. b. Estructura secundaria - Todos los enlaces de la cadena polipeptídica, excepto los enlaces peptídicos, permiten la rotación de la molécula. De todas las conformaciones posibles solo algunas son estables. La mayoría de las pro- teínas presentan una estructura conjunta. - Hélice alfa: la cadena de aminoácidos adopta una estructura helicoidal mantenida por puentes de H entre el grupo -NH de un aa y el -C=O del cuarto aa que sigue en la secuencia. Los R quedan hacia afuera. - Lámina plegada β: cadena plegada sobre sí misma y en zig-zag. Se estabiliza también mediante puentes de H entre distintas zonas de la cadena polipeptídica. Los grupos R se alternan hacia arriba y abajo. - Algunas proteínas no adquieren una mayor complejidad estructural. En este caso reciben el nombre de proteínas fibrosas c. Estructura terciaria (Globular) - Replegamiento tridimensional de una proteína con estructura secundaria. Determina la actividad de la proteína. Las proteínas con estructura terciaria son más activas, las fibrosas suelen ser estructura- les. Se producen interacciones entre radicales de aa que se encuentran separados en la cadena po- lipeptídica. d. Estructura cuaternaria (Proteínas oligoméricas) - Proteínas oligoméricas, formadas por la asociación de varias subunidades proteicas iguales o dife- rentes mediante enlaces débiles. Un ejemplo de proteína oligomérica es la hemoglobina, formada por cuatro subunidades iguales dos a dos. e. Desnaturalización y renaturalización - Pérdida de la actividad de una proteína al perder su estructura terciaria por algún cambio en el medio (temperatura, pH, salinidad, composición, radiaciones, ...). Si el cambio no ha sido muy drástico se puede producir la renaturalización de la proteína, recuperando su estructura y su actividad.
- 247. %,2(/(0(1726 %,202/e8/$6 4. Clasificación - Ver cuadro. 5. Enzimas a. Concepto - Biocatalizadores. Proteínas globulares que aceleran las reacciones bioquímicas (unas 10 7 veces). Cada reacción que se produce en el organismo es catalizada por un enzima. - Pueden ser holo- o heteroproteínas. En este último caso, la parte constituida por aminoácidos se denomina Apoenzima (no activo), el grupo prostético se denomina cofactor y la unión de ambos es el Holoenzima (activo). - Los reactivos sobre los cuales actúan los enzimas se conocen como sustratos. b. Propiedades - Gran poder catalítico: son muy activas. Una pequeña cantidad de enzima es capaz de catalizar la transformación de una gran cantidad de sustrato. Además aceleran mucho las reacciones (del orden de 10 7 veces). - No se gastan ni alteran durante la catálisis: son reutilizables. - Altamente específicos: presentan especificidad de sustrato y de acción. Como el resto de las proteí- nas son además característicos de cada especie. c. Características de la actividad enzimática - Reducen la energía de activación. Permiten que las reacciones bioquímicas transcurran rápidamente y a bajas temperaturas (compatible con el mantenimiento de estructuras complejas). - Poseen un centro activo. Zona de la molécula donde se une el sustrato. Al unirse enzima y sustrato forman el complejo enzima-sustrato que luego se separará en enzima (listo para actuar otra vez) y producto(s). E + S → ES → E + P Dos modelos para explicar la unión entre enzima y sustrato: la llave y la cerradura (formas com- plementarias de centro activo y sustrato) y encaje inducido (la forma del centro activo se adapta a la del sustrato cuando se produce la unión). No son incompatibles; pueden darse los dos modelos, dependiendo del grado de especificidad del enzima. - Presentan saturación con el sustrato. Alcanzan una vmáx, para una determinada concentración de sustrato, cuando el enzima está trabajando a su máximo rendimiento (todos los centros activos están ocupados en un instante determinado). - Muchos enzimas requieren de cofactores: moléculas no proteicas que se unen al centro activo del enzima y realizan o colaboran en la realización de la reacción. Los cofactores pueden ser: Activadores inorgánicos: iones metálicos. Coenzimas: moléculas orgánicas complejas. d. Factores que influyen en la actividad enzimática Temperatura - La velocidad de las reacciones catalizadas enzimáticamente aumenta al aumentar la temperatura hasta alcanzar su máxima actividad para una temperatura conocida como temperatura óptima. Por encima de esa temperatura el enzima se hace inestable y se desnaturaliza, perdiendo su activi- dad. pH - Cada enzima tiene un pH óptimo para el cual la actividad es máxima. Inhibidores - Los inhibidores son sustancias que impiden o reducen la actividad de un enzima. Pueden ser: Irreversibles. Unión covalente. Algunos venenos inhiben así a ciertos enzimas. Reversibles. No se altera el enzima, sólo se impide su acción. Tienen interés en la regulación de la actividad enzimática. Inhibición competitiva. El inhibidor se une al centro activo. La inhibición dependerá de las con- centraciones relativas de enzima e inhibidor: si [S][I] el enzima estará activo; si [I][S] estará in- activo) Inhibición no competitiva. El inhibidor se une a un lugar distinto del centro activo (enzimas alosté- ricos). El que el enzima esté activo o no depende de la concentración del inhibidor y es indepen- diente de la concentración del sustrato. e. Regulación de la actividad enzimática - Dada su gran poder catalítico es importante regular la actividad de los enzimas para evitar su acción cuando no son necesarios los productos que generan. Además, como las reacciones no catalizadas son muy lentas, la regulación de la actividad enzimática es la mejor manera de regular el metabolis- mo. - El principal mecanismo de regulación de la actividad enzimática es la retroinhibición. Consiste en que el producto final de una ruta metabólica actúa inhibiendo al primer enzima que interviene en la mis- ma, bloqueando el proceso completo cuando la concentración del producto es elevada. En las rutas ramificadas el producto final de cada ramificación actúa inhibiendo el primer enzima que interviene en dicha ramificación.
- 248. %,2(/(0(1726 %,202/e8/$6 D. Ácidos nucleicos 1. Concepto - Biomoléculas constituidas por C, H, O, N y P. Son macromoléculas formadas por la polimerización de nucleótidos. Son responsables del almacenamiento, interpretación y transmisión de la información gené- tica. Se encuentran normalmente asociados a proteínas, formando nucleoproteínas. 2. Componentes de los nucleótidos a. Pentosas - Ribosa (ARN) y desoxirribosa (ADN) b. Bases nitrogenadas - Compuestos heterocíclicos de C y N de carácter básico Bases pirimidínicas - Citosina (ARN y ADN), Uracilo (ARN) y Timina (ADN) Bases púricas - Adenina (ARN y ADN) y Guanina (ARN y ADN) c. Ácido fosfórico - (H3PO4) 3. Nucleósidos a. Concepto - Pentosa + Base nitrogenada unidos mediante un enlace N-glucosídico. b. Nomenclatura - Ribonucleósidos: adenosina, guanosina, citidina y uridina. - Desoxirribonucleósidos: desoxiadenosina, desoxiguanosina, desoxicitidina y timidina. 4. Nucleótidos a. Concepto - Nucleósido + A.ortofosfórico. Ésteres fosfóricos de los nucleósidos. Grupo fosfato Enlace de tipo éster Base nitrogenada Enlace N-glucosídico Pentosa b. Nomenclatura - Ribonucleótidos: AMP (adenosina monofosfato), GMP, CMP Y UMP. - Desoxirribonucleótidos: dAMP (desoxiadenosina monofosfato), dGMP, dCMP Y dTMP. c. Enlace fosfodiéster - Es el enlace que sirve de unión entre los nucleótidos de un ácido nucleico. El mismo grupo fosfato esterifica al –OH en posición 3’ de un nucleótido y al –OH en posición 5’ de otro nucleótido. En una cadena polinucleotídica habrá siempre un extremo con el grupo 3’ libre y el otro con el grupo 5’ libre. d. Nucleótidos no nucleicos ATP - Moléculas con una elevada energía química potencial debido a los enlaces entre los grupos fosfa- to. Actúan como vectores energéticos en las reacciones metabólicas. NADPH (agente reductor) - Coenzimas de las deshidrogenasas que intervienen en las reacciones metabólicas en las que hay transferencia de protones y electrones (reacciones de óxido-reducción). Todos ellos pueden apa- recer en dos formas, una oxidada y otra reducida. - NADP (Nicotinadenindinucleótido-fosfato) – derivado de la niacina (factor PP)
- 249. %,2(/(0(1726 %,202/e8/$6 5. Ácido DesoxirriboNucleico (ADN) a. Concepto - Macromoléculas formadas por la polimerización de desoxirribonucleótidos, con desoxirribosa como pentosa y A, T, G y C como bases nitrogenadas. En el hombre pueden alcanzar 50 cm x 2 nm. b. Estructura Estructura primaria - Secuencia ordenada de desoxirribonucleótidos. - La información contenida en el ADN depende de esta secuencia. Estructura secundaria (la doble hélice) - J.D.Watson y F.Crick (1953) – Elaboraron el modelo de la doble hélice del ADN: ƒ Dos cadenas de nucleótidos antiparalelas (una orientada en dirección 5'-3' y la otra 3'-5'). ƒ Complementarias (la A de una cadena se une a una T de la otra y cada G se une a una C). ƒ Las cadenas están enrolladas alrededor de un eje imaginario. Niveles estructurales superiores - El ADN se asocia a proteínas (sólo en células eucarióticas) y experimenta sucesivos grados de en- rollamiento sobre sí mismo. c. Tipos de ADN - ADN lineal bicatenario – Aparece asociado a proteínas (histonas) constituyendo la cromatina del nú- cleo de las células eucarióticas. - ADN circular bicatenario – forma el nucleoide bacteriano, en el que aparece desnudo (no asociado a proteínas) y en cloroplastos y mitocondrias. - ADN monocatenarios – aparecen en algunos virus. d. Función del ADN e importancia biológica - El ADN es el portador de la información hereditaria. Concepto de gen - Tradicionalmente se ha denominado gen a cada fragmento de ADN responsable de la determina- ción de una característica hereditaria concreta. Actualmente se considera que un gen es un frag- mento de ADN que lleva la información necesaria para sintetizar una determinada cadena polipep- tídica. e. Duplicación del ADN - El modelo de Watson y Crick apuntaba la posibilidad (por la complementariedad de las bases) de que las moléculas de ADN pudieran duplicarse para formar dos moléculas hijas idénticas. - La replicación es el proceso que garantiza que cuando una célula se divide cada una de las células hijas reciba una copia exacta e íntegra de la información hereditaria de la célula madre. Replicación semiconservativa - La replicación del ADN es un proceso semiconservativo en el que cada una de las moléculas hija contiene una hebra de la molécula original y otra neoformada.
- 250. %,2(/(0(1726 %,202/e8/$6 Proceso ƒ La replicación del ADN se basa en la complementariedad de las bases. ƒ 1ª etapa: iniciación Se rompen los puentes de H entre las dos cadenas lo que provoca su separación. Se une el en- zima (ADN-polimerasa) que va a catalizar el proceso y se une por complementariedad un primer nucleótido. ƒ 2ª etapa: elongación La ADN-polimerasa avanza un nucleótido en la dirección de síntesis, reconoce el siguiente nu- cleótido de la cadena molde y coloca el nucleótido complementario; ahora cataliza la formación del enlace fosfodiéster con el nuevo nucleótido. Este proceso se repite hasta alcanzar los extremos de las cadenas ƒ 3ª etapa: terminación Al alcanzar el extremo de la cadena y se separan las dos moléculas de ADN recién sintetizadas. 6. Ácido RiboNucleico (ARN) a. Concepto - Macromoléculas formadas por la polimerización de nucleótidos, con ribosa como pentosa y A, U, G y C como bases nitrogenadas. - Sus funciones están relacionadas con la interpretación del mensaje genético. b. ARN de Transferencia (ARNt) - Se encarga de aportar aminoácidos durante la síntesis de las proteínas. Estructura secundaria - Cada molécula posee zonas de complementariedad (brazos) y otras no apareadas (bucles). - Cada bucle tiene una función: unión al ribosoma; reconocimiento de las aminoacil ARNt sintetasas; anticodon. Especificidad de los ARNt (anticodon) - El anticodon es una secuencia de tres nucleótidos que determina qué aminoácido se une la ARNt. El aminoácido correspondiente se une al único brazo que no tiene bucle y que se conoce como brazo aceptor del aminoácido. c. ARN Mensajero (ARNm) - Son moléculas lineales que se forman en el núcleo por complementariedad a partir de un gen (trans- cripción). Llevan una copia del mensaje genético contenido en el ADN al citoplasma, donde se en- cuentran los ribosomas que lo emplearán como molde en el proceso de síntesis de proteínas (tra- ducción). d. ARN Ribosómico (ARNr) - Se asocia a proteínas para constituir los ribosomas. e. ARN Nucleolar (ARNn) - Son moléculas precursoras de los ARN que forman los ribosomas.
- 251. Elementos Biogenésicos Bio = Vida Genesicos = Origen de la vida *Biogenésicos Los elementos biogenésicos son todos aquellos elementos químicos que se designa para formar parte de la materia viviente. *Se clasifican: Según su frecuencia y sus micros componentes. Los elementos biogenésicos también son conocidos como bioelementos, y a su vez forman las biomoléculas que son las que forman a los seres vivos; éstas pueden conformarse de un mismo elemento repetido, en combinaciones y algunas, como las proteínas llegan a constituirse de miles de átomos de elementos diferentes. Los elementos principales, son el carbono (C), el oxígeno (O), el hidrógeno (H), y el nitrógeno (N), todos ellos capaces de formar enlaces covalentes muy estables al tener facilidad para compartir electrones de sus capas externas; además se trata de enlaces covalentes polares. La polaridad
- 252. de los compuestos los hace solubles en agua o capaces de formar emulsiones o dispersiones coloidales y es de gran importancia para comprender la estructura de las membranas biológicas y sus propiedades. Dichos elementos constituyen aproximadamente el 95% de la materia viva. El segundo grupo de elementos biogénicos esta formado por el fósforo (P), calcio (Ca), el magnesio (Mg), el sodio (Na), el potasio (K), el azufre (S) y el cloro (Cl) que se hallan en menores proporciones que los anteriores pero no por ello son menos importantes. Y lo mismo ocurre con los oligoelementos, indispensables para la vida por el papel biológico que desempeñan. Entre los principales componentes de este tercer grupo se hallan el hierro (Fe), que forma parte de la hemoglobina de la sangre de los vertebrados, yodo (I), integrante de la hormona tiroxina producida por la tiroides, el manganeso (Mn), el cobre (Cu), el cobalto (Co) y el zinc (Zn).
- 253. Macromoléculas Las macromoléculas son moléculas que tienen una masa molecular elevada, formadas por un gran número de átomos. Generalmente se pueden describir como la repetición de una o unas pocas unidades mínimas o monómeros, formando los polímeros. Pueden ser tanto orgánicas como inorgánicas. Tipos de macromoléculas *Naturales Caucho Polisacáridos (almidón - celulosa) Proteínas Ácidos nucleicos Carbohidratos Lípidos *Artificiales Plásticos Fibras textiles sintéticas Poliuretano Polietileno Cloruro de Polivilino (PVC)
- 254. *Según su estructura molecular Lineales Ramificados *Según su composición Homopolímeros: un monómero. Copolímeros: dos o más monómeros. *Por su comportamiento ante el calor Termoplásticos: se reblandecen al calentar y recuperan sus propiedades al enfriar. Termoestables: se endurecen al ser enfriados de nuevo por formar nuevos enlaces. Hidratos de Carbono Los glúcidos, carbohidratos, hidratos de carbono o sacáridos (del griego σάκχαρον que significa azúcar) son moléculas orgánicas compuestas por carbono, hidrógeno y oxígeno. Son solubles en agua y se clasifican de acuerdo a la cantidad de carbonos o por el grupo funcional que tienen adherido. Son la forma biológica primaria de almacenamiento y consumo de energía. Otras biomoléculas son las grasas y, en menor medida, las proteínas.
- 255. Los carbohidratos, también llamados glúcidos, se pueden encontrar casi de manera exclusiva en alimentos de origen vegetal. Constituyen uno de los tres principales grupos químicos que forman la materia orgánica junto con las grasas y las proteínas. Los carbohidratos son los compuestos orgánicos más abundantes de la biosfera y a su vez los más diversos. Normalmente se los encuentra en las partes estructurales de los vegetales y también en los tejidos animales, como glucosa o glucógeno. Estos sirven como fuente de energía para todas las actividades celulares vitales. Aportan 4 kcal/gramo al igual que las proteínas y son considerados macro nutrientes energéticos al igual que las grasas. Los podemos encontrar en una innumerable cantidad y variedad de alimentos y cumplen un rol muy importante en el metabolismo. Por eso deben tener una muy importante presencia de nuestra alimentación diaria. Lipidos Los lípidos, son un grupo de compuestos químicamente diversos, solubles en solventes orgánicos (como cloroformo, metanol o benceno), y casi insolubles en agua. La mayoría de los organismos, los utilizan como reservorios de moléculas fácilmente utilizables para producir energía (aceites y grasas). Los mamíferos, los acumulamos como grasas, y los peces como ceras; en las plantas se almacenan en forma de aceites
- 256. protectores con aromas y sabores característicos. Los fosfolípidos y esteroles constituyen alrededor de la mitad de la masa de las membranas biológicas. Entre los lípidos también se encuentran cofactores de enzimas, acarreadores de electrones, pigmentos que absorben luz, agentes emulsificantes, algunas vitaminas y hormonas, mensajeros intracelulares y todos los componentes no proteicos de las membranas celulares. Los lípidos, pueden ser separados fácilmente de otras biomoléculas por extracción con solventes orgánicos y pueden ser separados por técnicas experimentales como la cromatografía de adsorción, cromatografía de placa fina, etc. Proteinas Son grandes moléculas que contienen nitrógeno. Son el componente clave de cualquier organismo vivo y forman parte de cada una de sus células y son para nuestro organismo lo que la madera es para el barco. Cada especie, e incluso entre individuos de la misma especie, tiene diferentes proteínas, lo que les confiere un carácter específico tanto genético como inmunológico. La mayor similitud con los humanos, la encontramos entre los animales mamíferos como los bovinos o porcinos y la menor con las proteínas de los moluscos y las de las plantas.
- 257. Las proteínas están formadas por: carbono, oxígeno, hidrógeno y nitrógeno fundamentalmente, aunque también podemos encontrar, en alguna de ellas, azufre, fósforo, hierro y cobre. Las proteínas se distinguen de los carbohidratos y de las grasas por contener además nitrógeno en su composición, aproximadamente un 16%. Acidos nucleicos Los ácidos nucleicos son macromoléculas, polímeros formados por la repetición de monómeros llamados nucleótidos, unidos mediante enlaces fosfodiéster. Se forman, así, largas cadenas o polinucleótidos, lo que hace que algunas de estas moléculas lleguen a alcanzar tamaños gigantes (de millones de nucleótidos de largo). El descubrimiento de los ácidos nucleicos se debe a Friedrich Miescher, quien en el año 1869 aisló de los núcleos de las células una sustancia ácida a la que llamó nucleína, nombre que posteriormente se cambió a ácido nucleico. Tipos de ácidos nucleicos *Existen dos tipos de ácidos nucleicos: ADN (ácido desoxirribonucleico) y ARN (ácido ribonucleico), que se diferencian en:
- 258. El glúcido (pentosa) que contienen: la desoxirribosa en el ADN y la ribosa en el ARN. Las bases nitrogenadas que contienen: adenina, guanina, citosina y timina en el ADN; adenina, guanina, citosina y uracilo en el ARN. En los eucariontas la estructura del ADN es de doble cadena, mientras que la estructura del ARN es monocatenaria, aunque puede presentarse en forma extendida, como el ARNm, o en forma plegada, como el ARNt y el ARNr. La masa molecular del ADN es generalmente mayor que la del ARN
- 259. 1/5 Biología BIOELEMENTOS Y PRINCIPIOS INMEDIATOS INORGÁNICOS BIOELEMENTOS El análisis químico de la materia viva pone de manifiesto que en su composición se encuentran una serie de elementos llamados bioelementos o elementos biogénicos. Ninguno de ellos es propio y exclusivo de la materia viva ya que forman parte también, de la materia mineral, de tal manera que sólo un número relativamente reducido de los elementos que se encuentran en la naturaleza entra a formar parte de la materia viva. Los principales elementos biogénicos son cuatro: C, H, O y N. Estos 4 elementos forman parte de la materia viva en un porcentaje muy superior a los restantes gracias a poseer dos propiedades fundamentales: 1.- Tener un peso atómico bajo: C=12, H=1, O=16 y N=14. Esto les permite formar combinaciones por un lado muy complejas y por otro inestables, lo cual resulta muy útil para el continuo construir y destruir de materia a que se ven sometidos los seres vivos por su metabolismo. Estos 4 elementos son además muy solubles en agua, circunstancia favorable para ser incorporados al ser vivo o eliminados de él. 2.- Abundan en las capas más externas de la Tierra, es decir, atmósfera, hidrosfera y litosfera, que son las que se hallan más en contacto con los seres vivos. Esta propiedad es importante ya que los seres vivos necesitan formarse con elementos que puedan conseguir con facilidad, es decir, que abunden en la naturaleza para poder disponer de ellos en cualquier momento. Un detalle importante respecto al C y al N es que, debido a su posición central en el Sistema Periódico presentan la misma afinidad para unirse con el O que con el H, es decir, pueden pasar con facilidad del estado oxidado (CO2, NO3H) al reducido (CH4, NH3). Además de estos 4 bioelementos, en la materia viva se encuentran otros en menor cantidad; son los llamados bioelementos secundarios: S, P, K, Na, Ca, Mg y Cl. La proporción en que se encuentra un elemento biogénico no está en relación con su importancia biológica pues algunos de ellos entran a formar parte de la materia viva en cantidades insignificantes y sin embargo desempeñan papeles de gran trascendencia, de tal manera que su carencia provoca serios trastornos porque son indispensables para que los fenómenos vitales se desarrollen con normalidad. A estos elementos se les denomina oligoelementos y entre ellos pueden citarse: 1.- Hierro (Fe): Forma parte de la hemoglobina, pigmento rojo de la sangre de los Vertebrados. También forma parte de los citocromos. El Fe apenas se elimina del organismo y es utilizado varias veces cuando se destruyen los compuestos de que forma parte y por ello sus necesidades alimenticias son mínimas. No obstante, su escasez o carencia produce anemia. 2.- Cobre (Cu): Forma parte de la hemocianina, pigmento rojo de la sangre de los Invertebrados, de papel semejante a la hemoglobina. 3.- Manganeso (Mn): Es básico para que las plantas verdes puedan sintetizar la clorofila. Actúa además como catalizador de muchas reacciones metabólicas. 4.- Cinc (Zn): También importante como catalizador. 5.- Yodo (I): Elemento básico para la formación de la tiroxina, hormona producida por la glándula tiroides cuya deficiencia origina la enfermedad llamada bocio. 6.- Cobalto (Co): necesario para sintetizar la vitamina B12. Los elementos biogénicos rara vez se encuentran en estado libre. En general, se combinan entre sí para formar sustancias compuestas definidas. Estos compuestos que se pueden aislar por medios puramente físicos como la disolución, la filtración, la destilación, la centrifugación, etc. constituyen los llamados principios inmediatos. Pueden ser inorgánicos (agua y sales minerales) u orgánicos (glúcidos, lípidos, prótidos y ácidos nucleicos).
- 260. 2/5 2.2. AGUA: PROPIEDADES E IMPORTANCIA BIOLOGICA La vida, tal como se conoce en la Tierra, se desarrolla siempre en medio acuoso. Incluso en los seres no acuáticos el medio interno es básicamente hídrico. La inmensa mayoría de las reacciones bioquímicas se desarrollan en el seno del agua y obedecen las leyes fisicoquímicas de las disoluciones acuosas. Por todo ello no es de extrañar que el agua sea el principal componente de los seres vivos en cuanto a su cantidad. El cuerpo humano, por ej., está formado por término medio por un 75% de agua, aunque los tejidos que necesitan mucha actividad como el nervioso son agua en un 90%. Sólo los tejidos esqueléticos y las semillas de las plantas presentan una baja proporción de agua. El agua reúne una serie de características que la convierten en un disolvente único e insustituible en la Biosfera. En cuanto a sus propiedades fisicoquímicas cabe destacar: 1.- La molécula de agua tiene un marcado carácter dipolar. Aunque tiene una carga total neutra (posee el mismo número de protones y de electrones), presenta una distribución asimétrica de sus electrones: alrededor del O se concentra una densidad de carga negativa ( - ) debido a que es un elemento mucho más electronegativo que el H, por ello los núcleos de H quedan desnudos, desprovistos parcialmente de sus electrones y manifiestan, por tanto, una densidad de carga + ). Este carácter dipolar de la molécula de agua es de trascendental importancia y tiene múltiples consecuencias: La más relevante es que se pueden establecer interacciones dipolo-dipolo entre las propias moléculas de agua formando uniones electrostáticas llamadas puentes o enlaces de H: la carga parcial negativa del O de una molécula ejerce atracción electrostática sobre las cargas parciales positivas de los átomos de H de otras moléculas adyacentes. Aunque son uniones débiles, el hecho de que alrededor de cada molécula de agua se dispongan otras 3 moléculas unidas por puentes de H permite que se forme en el agua (líquida o sólida) una estructura reticular, responsable de su comportamiento anómalo y de la peculiaridad de sus propiedades fisicoquímicas. Todas las restantes propiedades del agua son, pues, consecuencia de ésta. 2.- El amplio margen de temperaturas en que permanece en fase líquida (0º- 100º) proporciona variadas posibilidades de vida, desde los organismos psicrófilos que pueden desarrollarse a temperaturas próximas a 0º, hasta los termófilos que viven a 70º-80º. 3.- La anómala variación de la densidad con la temperatura, con una densidad máxima a 4ºC, determina que el hielo flote en el agua líquida actuando como aislante térmico y, en consecuencia, posibilitando el mantenimiento de la gran masa de agua de los océanos en fase líquida albergando a la mayor parte de la Biosfera.
- 261. 3/5 4.- El agua es el líquido que más sustancias disuelve (disolvente universal). Esta propiedad, tal vez la más importante para la vida, se debe a su capacidad para formar puentes de H, además de con otras moléculas de agua como se dijo anteriormente, con otras sustancias polares (grupos -OH de alcoholes y azúcares, grupos -NH2 de aminoácidos, proteínas, ácidos nucleicos, etc.), pues se disuelven cuando interaccionan con las moléculas del agua. 5.- El agua posee un elevado calor específico. Se denomina calor específico a la capacidad de almacenar energía para un aumento determinado de la temperatura: el agua puede absorber grandes cantidades de calor, mientras que, proporcionalmente, su temperatura sólo se eleva ligeramente. Del mismo modo, su temperatura desciende con más lentitud que la de otros líquidos a medida que va liberando energía al enfriarse. Esta propiedad permite que el contenido acuoso de las células sirva de protección a las sensibles moléculas orgánicas ante los cambios bruscos de temperatura. Además, el calor que se desprende en los procesos metabólicos no se acumula en los lugares donde se produce, sino que se difunde en el medio acuoso y se disipa finalmente hacia el medio externo. 6.- El agua posee una elevada fuerza de cohesión entre sus moléculas. Los puentes de H mantienen a las moléculas de agua fuertemente unidas, formando una estructura compacta que la convierte en un líquido casi incompresible. Gracias a esta propiedad algunos seres vivos utilizan el agua como esqueleto hidrostático. 7.- El agua posee una elevada fuerza de adhesión. Esta fuerza está también en relación con los puentes de H que se establecen entre las moléculas de agua y otras moléculas polares y es responsable, junto con la cohesión, del llamado fenómeno de la capilaridad, es decir, el ascenso de agua a través de las paredes de un capilar (delgado tubo de vidrio). Los seres vivos van renovando continuamente su contenido en agua, ingiriéndola con la alimentación y perdiéndola con la respiración como vapor y con la excreción (orina, sudor, etc.) 2.3. SALES MINERALES: PROPIEDADES E IMPORTANCIA BIOLÓGICA En todos los seres vivos, animales y vegetales, se encuentran siempre determinadas cantidades de sales minerales. Se clasifican en función de su solubilidad en agua. Las sustancias salinas insolubles en agua forman estructuras sólidas que suelen cumplir funciones de protección y sostén y que están muy extendidas en todos los seres vivos. Los Crustáceos y los Moluscos presentan caparazones de carbonato cálcico (CO3Ca) mientras que en la Diatomeas son de sílice (SiO2). El esqueleto interno de los Vertebrados presenta una parte mineral formada por la asociación de varios componentes minerales, sobre todo carbonato y fosfato cálcico [(PO4)2Ca3]. Además, el esmalte de los dientes presenta fluoruro cálcico (F2Ca). En cuanto a las sales minerales solubles en agua, éstas se encuentran disociadas en sus iones correspondientes, que son los responsables de su actividad biológica. Los principales iones son:
- 262. 4/5 Ÿ Cationes: Na+ , K+ , Mg2+ , Ca2+ y amonio (NH4 + ). Ÿ Aniones: Cl- , fosfatos (PO4 3- , PO4H2 - , PO4H2 - ), sulfato (SO4 2- ), nitrato (NO3 - ) y carbonatos (CO3 2- , CO3H- ). Los iones minerales realizan múltiples funciones en el organismo, destacando las siguientes: 1.3.1.- Regulación de los fenómenos osmóticos: cuando dos disoluciones salinas de distinta concentración se ponen en contacto a través de una membrana semipermeable (llamada así porque permite el paso de agua pero no de los iones disueltos en ella) las dos disoluciones tienden a equilibrar sus concentraciones y, como los iones no pueden atravesar la membrana, es el agua de la disolución más diluida la que va pasando a la más concentrada. Este trasiego de agua cesa cuando ambas disoluciones adquieren la misma concentración. La disolución más concentrada recibe el nombre de hipertónica respecto a la menos concentrada que es la hipotónica; en el momento del equilibrio se dice que las dos disoluciones son isotónicas. Este fenómeno se conoce con el nombre de ósmosis y el paso del agua a través de la membrana semipermeable genera una presión llamada presión osmótica. Esta será mayor cuanto mayor sea la diferencia en la concentración de las dos disoluciones. Los seres vivos mantienen en sus células una presión osmótica constante gracias a las sales minerales, fenómeno llamado homoósmia, y son muy sensibles a las variaciones de la misma, lo cual acarrea serios trastornos. Por esta razón toda disolución que se ponga en contacto directo con las células de un organismo debe ser isotónica con respecto a la disolución salina de su interior, ya que las membranas celulares se comportan como semipermeables. Existen dos ejemplos típicos que demuestran la importancia de los fenómenos osmóticos en el mantenimiento de la integridad celular: 1.- Las células vegetales poseen una gran vacuola que comprime el citoplasma contra la pared celular. Al ponerlas en contacto con una solución salina hipertónica respecto del líquido de la vacuola, el agua de ésta fluye hacia el exterior de la célula y, como consecuencia, la vacuola se reduce de tamaño arrastrando al citoplasma, que puede llegar a separarse de la pared celular. Este fenómeno se denomina plasmólisis. Por el contrario, si la solución que se pone en contacto con la célula es hipotónica, la corriente de agua se establece hacia el interior, comprimiendo el citoplasma contra la pared celular. Este caso se llama turgencia. 2.- Repitiendo la misma experiencia con glóbulos rojos, como éstos carecen de pared celular vegetal, al ponerlos en contacto con una solución hipertónica, disminuyen de volumen y se arrugan al salir agua al exterior. Si los ponemos en contacto con una solución hipotónica, el agua pasa al interior y el glóbulo rojo se dilata, pudiendo llegar a estallar rompiéndose su membrana. Este caso extremo se llama hemolisis. 1.3.2.- Regulación del equilibrio ácido-base: En los seres vivos existe siempre una cierta cantidad de hidrogeniones (H+ ) y de iones hidroxilo (OH- ) que proceden de: a) La disociación del agua que proporciona los dos iones: H2O H+ + OH- b) La disociación de cuerpos con función ácida que proporcionan H+ : ClH Cl- + H+ c) La disociación de cuerpos con función básica que proporcionan OH- :NaOH Na+ + OH- Los hidrogeniones tienen carácter ácido, mientras que los hidroxiliones lo tienen alcalino. Por lo tanto la acidez o alcalinidad del medio interno de un organismo dependerá de la proporción en que se encuentren los dos iones. Así será neutro cuando [H+ ]=[OH- ], ácido cuando [H+ ][OH- ] y alcalino cuando [H+ ][OH- ]. Para que los fenómenos vitales puedan desarrollarse con normalidad es necesario que la concentración de H+, que se expresa en valores de pH sea más o menos constante y próxima a la neutralidad, es decir, pH=7. Sin embargo, en las reacciones que tienen lugar durante el metabolismo se están liberando productos tanto ácidos como básicos que tenderán a variar dicha neutralidad si no fuera porque los organismos disponen de unos mecanismos químicos que se oponen automáticamente a las variaciones de pH. Estos mecanismos se denominan sistemas amortiguadores o sistemas tampón, y en ellos intervienen de forma fundamental las sales minerales. Lo más corriente es que el pH
- 263. 5/5 tienda a desplazarse hacia el lado ácido por lo que los sistemas tampón más importantes actúan evitando este desplazamiento. Un tampón está formado por una mezcla de un ácido débil y una sal del mismo ácido; el más extendido es el formado por el ácido carbónico (CO3H2) y el bicarbonato sódico (CO3HNa). Supongamos que el organismo se ve sometido a un exceso de ácido clorhídrico que, en consecuencia liberará protones que harán disminuir el pH. En este momento entra en funcionamiento el sistema amortiguador y ocurre lo siguiente: 1.- La sal (bicarbonato sódico) reacciona con el ácido clorhídrico: CO3HNa + ClH NaCl + CO3H2 La sal que se forma (NaCl) es neutra y, aunque se disocie, no libera protones y, además, es habitualmente expulsada por la orina. 2.- El ácido carbónico que se ha formado podría incrementar la acidez, pero rápidamente se descompone en CO2, que se libera con la respiración, y agua que es neutra: CO3H2 CO2 + H2O En resumen, todos los hidrogeniones que podrían provocar un estado de acidez desaparecen manteniéndose el estado de neutralidad.
- 264. 0MJHPFMFNFOUP 0MJHPFMFNFOUP -PT PMJHPFMFNFOUPT TPO CJPFMFNFOUPT QSFTFOUFT FO QFRVF`BT DBOUJEBEFT NFOPT EF VO FO MPT TFSFT WJWPT Z UBOUP TV BVTFODJB DPNP VOB DPODFOUSBDJaO QPS FODJNB EF TV OJWFM DBSBDUFSbTUJDP QVFEF TFS QFSKVEJDJBM QBSB FM PSHBOJTNP MMFHBOEP B TFS IFQBUPUaYJDPT QBSUF EF MPT DVBUSP HSBOEFT FMFNFOUPT EF MPT RVF TF DPNQPOF MB WJEB FO MB 5JFSSB PYbHFOP IJESaHFOP DBSCPOP Z OJUSaHFOP QSFTFOUFT FO MPT PSHBOJTNPT NPMFDVMBSFT FYJTUFO VOB HSBO WBSJFEBE EF FMFNFOUPT RVbNJDPT FTFODJBMFT -PT BHSFHBEPT RVbNJDPT SFRVJFSFO EF VOB FSPTJaO QSJNBSJB QBSB EJTHSFHBSTF -BT CBDUFSJBT KVFHBO FTUF QBQFM FTFODJBM BM TFS DBQBDFT EF BCTPSCFS EFTEF MPT NJOFSBMFT QSJNBSJPT MPT OVUSJFOUFT RVF MVFHP WBO BTDFOEJFOEP FO MB DBEFOB USaGJDB -BT QMBOUBT BCTPSCFO MPT NJOFSBMFT EJTVFMUPT FO FM TVFMP RVF TPO FO DPOTFDVFODJB SFDPMFDUBEPT QPS MPT IFSCbWPSPT Z BTb MPT NJOFSBMFT TF WBO USBOTNJUJFOEP FOUSF MPT TFSFT WJWPT 4F TBCF RVF FYJTUFO HSBOEFT PSHBOJTNPT RVF DPOTVNFO TVFMP HFPGBHJB Z WJTJUBO ZBDJNJFOUPT NJOFSBMFT DPNP ZBDJNJFOUPT EF TBM QBSB DPNQMFUBS TV EJFUB -JTUB EF FMFNFOUPT JNQSFTDJOEJCMFT QBSB MB WJEB 5BCMB QFSJ`EJDB EF MPT FMFNFOUPT EF MB EJFUB ) )F -J #F # $ / 0 ' /F /B .H M 4J 1 4 $M S , $B 4D 5J 7 $S .O 'F $P /J $V ;O (B (F T 4F #S ,S 3C 4S : ;S /C .P 5D 3V 3I 1E H $E *O 4O 4C 5F * 9F $T #B -B )G 5B 8 3F 0T *S 1U V )H 5M 1C #J 1P U 3O 'S 3B D 3G %C 4H #I )T .U %T 3H $F 1S /E 1N 4N V (E 5C %Z )P S 5N :C -V 5I 1B 6 /Q 1V N $N #L $G T 'N .E /P -S -PT DVBUSP FMFNFOUPT CcTJDPT EFM PSHBOJTNP MFNFOUPT JNQPSUBOUFT MFNFOUPT USB[B FTFODJBMFT /P TF TBCF TJ GVODJPOBO FO FM PSHBOJTNP MFNFOUPT FTFODJBMFT MFNFOUP EF MB EJFUB %PTJT EJBSJB SFDPNFOEBEB %FTDSJQDJ`O $BUFHPSaB %PMFODJB QPS JOTVGJDJFODJB YDFTP 1PUBTJP dNH TFODJBM T VO FMFDUSPMJUP TJTUFNJDP Z FTFODJBM FO MB SFHVMBDJaO EFM 51 DPO FM TPEJP -BT GVFOUFT JODMVZFO MFHVNCSFT QJFM EF QBUBUB UPNBUFT Z QMcUBOPT )JQPQPUBTFNJB )JQFSQPUBTFNJB $MPSP dNH TFODJBM T OFDFTBSJP QBSB MB QSPEVDDJaO EFM cDJEP DMPSIbESJDP FO FM FTUaNBHP Z UBNCJeO TF SFRVJFSF FO BMHVOBT GVODJPOFT DFMVMBSFT -B TBM FT MB GVFOUF NcT DPNfO BM EJTPDJBSTF FM DMPSVSP TaEJDP FO DMPSP Z TPEJP )JQPDMPSFNJB )JQFSDMPSFNJB 4PEJP dNH TFODJBM T OFDFTBSJP FO MB SFHVMBDJaO EF MB EFOPTJOB USJGPTGBUP DPO FM QPUBTJP M NBSJTDP MB MFDIF Z MBT FTQJOBDBT TPO GVFOUFT EF TPEJP BEFNcT EF MB TBM )JQPOBUSFNJB )JQFSOBUSFNJB
- 265. 0MJHPFMFNFOUP $BMDJP dNH TFODJBM T OFDFTBSJP QBSB FM NfTDVMP FM DPSB[aO FM BQBSBUP EJHFTUJWP MB GPSNBDJaO EF IVFTPT Z MB HFOFSBDJaO EF OVFWBT DeMVMBT EF TBOHSF -BT GVFOUFT NcT JNQPSUBOUFT EF DBMDJP TPO MB MFDIF QFTDBEP OVFDFT Z TFNJMMBT )JQPDBMDFNJB )JQFSDBMDFNJB 'aTGPSP dNH TFODJBM T VO DPNQPOFOUF EF MPT IVFTPT BQBUJUB Z EF MBT DeMVMBT BEFNcT EF GPSNBS QBSUF EF MPT QSPDFTPT EF PCUFODJaO EF FOFSHbB O DPOUFYUPT CJPMaHJDPT BQBSFDF HFOFSBMNFOUF DPNP GPTGBUP )JQPGPTGBUFNJB )JQFSGPTGBUFNJB .BHOFTJP dNH TFODJBM T SFRVFSJEB QBSB FM QSPDFTBNJFOUP EFM 51 Z QBSB MPT IVFTPT M NBHOFTJP TF FODVFOUSB FO MBT OVFDFT FO MB TPKB Z FO MB NBTB EFM DBDBP 7eBTF UBNCJeO 3PM CJPMaHJDP EFM NBHOFTJP )JQPNBHOFTFNJB )JQFSNBHOFTFNJB ;JOD dNH 5SB[B T OFDFTBSJB QBSB QSPEVDJS WBSJBT FO[JNBT DBSCPYZQFQUJEBTB BOIJESBTB DBSCaOJDB %FGJDJFODJB EF [JOD 5PYJDJEBE QPS [JOD )JFSSP dNH 5SB[B 'PSNB QBSUF EF MB NPMeDVMB EF IFNPHMPCJOB Z EF MPT DJUPDSPNPT RVF GPSNBO QBSUF EF MB DBEFOB SFTQJSBUPSJB 4V GBDJMJEBE QBSB PYJEBSTF MF QFSNJUF USBOTQPSUBS PYbHFOP B USBWeT EF MB TBOHSF DPNCJOcOEPTF DPO MB IFNPHMPCJOB QBSB GPSNBS MB PYJIFNPHMPCJOB 4F OFDFTJUB FO DBOUJEBEFT NbOJNBT QPSRVF TF SFVUJMJ[B OP TF FMJNJOB 'VFOUFT EF IJFSSP TPO FM IbHBEP EF NVDIPT BOJNBMFT TFNJMMBT DPNP MBT MFOUFKBT OFNJB )FNPDSPNBUPTJT .BOHBOFTP dNH 0MJHPFMFNFOUP M NBOHBOFTP UJFOF VO QBQFM UBOUP FTUSVDUVSBM DPNP FO[JNcUJDP TUc QSFTFOUF FO EJTUJOUBT FO[JNBT EFTUBDBOEP FM TVQFSaYJEP EJTNVUBTB EF NBOHBOFTP .O40% RVF DBUBMJ[B MB EJTNVUBDJaO EF TVQFSaYJEPT %FGJDJFODJB EF NBOHBOFTP .BOHBOJTNP $PCSF dgH 0MJHPFMFNFOUP TUJNVMB FM TJTUFNB JONVOJUBSJP Z FT VO DPNQPOFOUF EF WBSJBT FODJNBT SFEPY JODMVZFOEP MB DZUPDISPNF D PYJEBTF 1PEFNPT PCUFOFSMP FO MPT WFHFUBMFT WFSEFT FM QFTDBEP MPT HVJTBOUFT MBT MFOUFKBT FM IbHBEP MPT NPMVTDPT Z MPT DSVTUcDFPT %FGJDJFODJB EF DPCSF 5PYJDJEBE QPS DPCSF :PEP dgH 0MJHPFMFNFOUP 4F OFDFTJUB OP TPMP QBSB MB TbOUFTJT EF MBT IPSNPOBT UJSPbEFBT UJSPYJOB Z MB USJJPEPUIJSPOJOB Z QBSB QSFWFOJS MB HPUB BEFNcT FT QSPCBCMFNFOUF BOUJPYJEBOUF Z UJFOF VO QBQFM JNQPSUBOUF FO FM TJTUFNB JONVOF %FGJDJFODJB EF ZPEP ZPEJTNP 4FMFOJP dgH 0MJHPFMFNFOUP M EJaYJEP EF TFMFOJP FT VO DBUBMJ[BEPS BEFDVBEP QBSB MB PYJEBDJaO IJESPHFOBDJaO Z EFTIJESPHFOBDJaO EF DPNQVFTUPT PSHcOJDPT 'BDUPS FTFODJBM FO MB BDUJWJEBE EF FO[JNBT BOUJPYJEBOUFT DPNP FM (MVUBUJaO QFSPYJEBTB %FGJDJFODJB EF TFMFOJP 4FMFOJPTJT .PMJCEFOP dgH 0MJHPFMFNFOUP 4F FODVFOUSB FO VOB DBOUJEBE JNQPSUBOUF FO FM BHVB EF NBS FO GPSNB EF NPMJCEBUPT .P0 Z MPT TFSFT WJWPT QVFEFO BCTPSCFSMP GcDJMNFOUF EF FTUB GPSNB 5JFOF MB GVODJaO EF USBOTGFSJS cUPNPT EF PYbHFOP BM BHVB 5BNCJeO GPSNB MB 9BOUJOB PYJEBTB MB BMEFIbEB PYJEBTB Z FM TVMGJUP PYJEBTB %FGJDJFODJB EF NPMJCEFOP -PT TJHVJFOUFT FMFNFOUPT TPO DPOTJEFSBEPT DPNP PMJHPFMFNFOUPT h #PSP .BOUFOJNJFOUP EF MB FTUSVDUVSB EF MB QBSFE DFMVMBS FO MPT WFHFUBMFT h $SPNP 1PUFODJB MB BDDJaO EF MB JOTVMJOB Z GBWPSFDF MB FOUSBEB EF HMVDPTB B MBT DeMVMBT 4V DPOUFOJEP FO MPT aSHBOPT EFM DVFSQP EFDSFDF DPO MB FEBE -PT CFSSPT MBT BMHBT MBT DBSOFT NBHSBT MBT IPSUBMJ[BT MBT BDFJUVOBT Z MPT DbUSJDPT OBSBOKBT MJNPOFT UPSPOKBT FUD FM IbHBEP Z MPT SJ`POFT TPO FYDFMFOUFT QSPWFFEPSFT EF DSPNP h $PCBMUP $PNQPOFOUF DFOUSBM EF MB WJUBNJOB #
- 266. 0MJHPFMFNFOUP h $PCSF TUJNVMB FM TJTUFNB JONVOJUBSJP 1PEFNPT PCUFOFSMP FO MPT WFHFUBMFT WFSEFT FM QFTDBEP MPT HVJTBOUFT MBT MFOUFKBT FM IbHBEP MPT NPMVTDPT Z MPT DSVTUcDFPT h 'MfPS 4F BDVNVMB FO IVFTPT Z EJFOUFT EcOEPMFT VOB NBZPS SFTJTUFODJB h )JFSSP 'PSNB QBSUF EF MB NPMeDVMB EF IFNPHMPCJOB Z EF MPT DJUPDSPNPT RVF GPSNBO QBSUF EF MB DBEFOB SFTQJSBUPSJB 4V GBDJMJEBE QBSB PYJEBSTF MF QFSNJUF USBOTQPSUBS PYbHFOP B USBWeT EF MB TBOHSF DPNCJOcOEPTF DPO MB IFNPHMPCJOB QBSB GPSNBS MB PYJIFNPHMPCJOB 4F OFDFTJUB FO DBOUJEBEFT NbOJNBT QPSRVF TF SFVUJMJ[B OP TF FMJNJOB 4V GBMUB QSPWPDB BOFNJB h .BOHBOFTP M NBOHBOFTP UJFOF VO QBQFM UBOUP FTUSVDUVSBM DPNP FO[JNcUJDP TUc QSFTFOUF FO EJTUJOUBT FO[JNBT EFTUBDBOEP FM TVQFSaYJEP EJTNVUBTB EF NBOHBOFTP .O40% RVF DBUBMJ[B MB EJTNVUBDJaO EF TVQFSaYJEPT h .PMJCEFOP 4F FODVFOUSB FO VOB DBOUJEBE JNQPSUBOUF FO FM BHVB EF NBS FO GPSNB EF NPMJCEBUPT .P0 Z MPT TFSFT WJWPT QVFEFO BCTPSCFSMP GcDJMNFOUF EF FTUB GPSNB 5JFOF MB GVODJaO EF USBOTGFSJS cUPNPT EF PYbHFOP BM BHVB h /bRVFM h 4FMFOJP M EJaYJEP EF TFMFOJP FT VO DBUBMJ[BEPS BEFDVBEP QBSB MB PYJEBDJaO IJESPHFOBDJaO Z EFTIJESPHFOBDJaO EF DPNQVFTUPT PSHcOJDPT hh 4JMJDJP h 7BOBEJP M WBOBEJP FT VO FMFNFOUP FTFODJBM FO BMHVOPT PSHBOJTNPT O IVNBOPT OP FTUc EFNPTUSBEB TV FTFODJBMJEBE BVORVF FYJTUFO DPNQVFTUPT EF WBOBEJP RVF JNJUBO Z QPUFODJBO MB BDUJWJEBE EF MB JOTVMJOB h :PEP M ZPEP FT VO FMFNFOUP RVbNJDP FTFODJBM -B HMcOEVMB UJSPJEFT GBCSJDB MBT IPSNPOBT UJSPYJOB Z USJZPEPUJSPOJOB RVF DPOUJFOFO ZPEP h ;JOD M [JOD FT VO FMFNFOUP RVbNJDP FTFODJBM QBSB MBT QFSTPOBT JOUFSWJFOF FO FM NFUBCPMJTNP EF QSPUFbOBT Z cDJEPT OVDMFJDPT FTUJNVMB MB BDUJWJEBE EF BQSPYJNBEBNFOUF FO[JNBT DPMBCPSB FO FM CVFO GVODJPOBNJFOUP EFM TJTUFNB JONVOJUBSJP FT OFDFTBSJP QBSB MB DJDBUSJ[BDJaO EF MBT IFSJEBT JOUFSWJFOF FO MBT QFSDFQDJPOFT EFM HVTUP Z FM PMGBUP Z FO MB TbOUFTJT EFM %/ 1BSB PUSPT FMFNFOUPT DPNP FM MJUJP FM FTUB`P P FM DBENJP TV FTFODJBMJEBE OP FTUc UPUBMNFOUF BDFQUBEB JODMVTP EF MB BOUFSJPS MJTUB OP FTUc DMBSB MB FTFODJBMJEBE EFM CSPNP Z FM CPSP )BZ PUSPT FMFNFOUPT RVF FTUcO FO VOB NBZPS DBOUJEBE FO MPT TFSFT IVNBOPT QPS MP RVF OP TF MFT EFOPNJOB FMFNFOUPT USB[B O PSEFO EF BCVOEBODJB FO QFTP FO FM DVFSQP IVNBOP B[VGSF QPUBTJP TPEJP DMPSP Z NBHOFTJP -PT BOUFSJPSFT FMFNFOUPT TPO FTFODJBMFT FO TFSFT IVNBOPT TF MMBNBO NJDSPFMFNFOUPT Z TF FODVFOUSBO FO VO B IBZ FMFNFOUPT RVF TaMP MP TPO FO VOPT EFUFSNJOBEPT TFSFT WJWPT 1PS FKFNQMP FM XPMGSBNJP FT FTFODJBM FO BMHVOPT NJDSPPSHBOJTNPT $BEB FMFNFOUP UJFOF VO SBOHP aQUJNP EF DPODFOUSBDJPOFT EFOUSP EF MPT DVBMFT FM PSHBOJTNP FO FTBT DPOEJDJPOFT GVODJPOB BEFDVBEBNFOUF EFQFOEJFOEP EFM FMFNFOUP FTUF SBOHP QVFEF TFS NcT P NFOPT BNQMJP M PSHBOJTNP EFKB EF GVODJPOBS BEFDVBEBNFOUF UBOUP QPS QSFTFOUBS EFGJDJFODJB DPNP QPS QSFTFOUBS VO FYDFTP FO VOP EF FTUPT FMFNFOUPT 3FGFSFODJBT EBQUBDJaO EF MB EFGJOJDJaO EF MB 3FBM DBEFNJB EF MB -FOHVB TQB`PMB IUUQCVTDPOSBFFTESBF*4SWMU(6*#VT6TVBM 5*10@)5.- 5*10@#64 -.PMJHPFMFNFOUP $PSCSJEHF % $ 1IPTQIPSVT O 0VUMJOF PG *UT $IFNJTUSZ #JPDIFNJTUSZ BOE 5FDIOPMPHZ UI FEJDJaO NTUFSEBN MTFWJFS 4DJFODF 1VC $P QQd *4#/ i -JOVT 1BVMJOH *OTUJUVUF BU 0SFHPO 4UBUF 6OJWFSTJUZ IUUQMQJPSFHPOTUBUFFEVJOGPDFOUFSNJOFSBMTQIPTQIPSVT j $POTVMUBEP FM 4BSEFTBJ 7. %FDFNCFS i.PMZCEFOVN BO FTTFOUJBM USBDF FMFNFOUj /VUS $MJO 1SBDU dQQd` EPJ IUUQEYEPJPSH 1.*% IUUQXXXODCJOMNOJIHPW QVCNFE
- 267. %,2(/(0(1726 %,202/e8/$6 ,125*È1,$6 $*8$ 6$/(6 0,1(5$/(6 /RV ELRHOHPHQWRV VH HQFXHQWUDQ HQ ORV VHUHV YLYRV IRUPDQGR SDUWH GH ODV PROpFXODV TXH SXHGHQ VHU LQRUJiQLFDV X RUJiQLFDV %LRPROpFXODV RUJiQLFDV 6H HQFXHQWUDQ IRUPDQGR SDUWH GH ORV VHUHV YLYRV 6RQ ORV JO~FLGRV OtSLGRV SURWHtQDV iFLGRV QXFOHLFRV %LRPROpFXODV LQRUJiQLFDV 3XHGHQ HQFRQWUDUVH GHQWUR IXHUD GH ORV VHUHV YLYRV VRQ HO DJXD ODV VDOHV PLQHUDOHV %,202/e8/$6 ,125*È1,$6 x (/ $*8$ (O DJXD HV OD PROpFXOD PiV DEXQGDQWH HQ ORV VHUHV YLYRV UHSUHVHQWD HQWUH HO GHO SHVR GH OD PDRU SDUWH GH ORV RUJDQLVPRV (O FRQWHQLGR YDUtD GH XQD HVSHFLH D RWUD GHSHQGLHQGR WDPELpQ GH OD HGDG GHO LQGLYLGXR VX GLVPLQXH DO DXPHQWDU OD HGDG
- 268. HO WLSR GH WHMLGR DUDFWHUtVWLFDV GH OD PROpFXOD GH DJXD (VWi IRUPDGD SRU GRV iWRPRV GH KLGUyJHQR XQR GH R[tJHQR XQLGRV SRU HQODFHV FRYDOHQWHV VLPSOHV
- 269. /D PROpFXOD GHO DJXD HV XQ GLSROR 'HELGR D OD HOHFWURQHJDWLYLGDG GHO R[tJHQR ORV HOHFWURQHV GH ORV KLGUyJHQRV VH GHVSOD]DQ KDFLD pVWH FDUJiQGRVH QHJDWLYDPHQWH HO SROR GH OD PROpFXOD TXH RFXSD HO R[tJHQR DSDUHFLHQGR GRV SRORV SRVLWLYRV HQ ORV KLGUyJHQRV (QWUH ORV GLSRORV VH HVWDEOHFHQ IXHU]DV GH DWUDFFLyQ GHQRPLQDGDV SXHQWHV GH KLGUyJHQR GH IRUPD TXH VH IRUPDQ PDFURPROpFXODV GH KDVWD PROpFXODV FRH[LVWLHQGR pVWDV FRQ PROpFXODV DLVODGDV OR TXH GHWHUPLQD TXH HO DJXD SUHVHQWH PDRU SHVR PROHFXODU VH SUHVHQWH HQ HVWDGR OtTXLGR $Vt VH IRUPD XQD HVWUXFWXUD RUGHQDGD UHVSRQVDEOH GHO FRPSRUWDPLHQWR FDUDFWHUtVWLFR GHO DJXD DVt FRPR GH VXV SURSLHGDGHV ItVLFDV TXtPLFDV 3URSLHGDGHV ItVLFR TXtPLFDV GHO DJXD $FFLyQ GLVROYHQWH 6H OH FRQVLGHUD HO GLVROYHQWH XQLYHUVDO D TXH HV FDSD] HVWDEOHFHU LQWHUDFFLRQHV FRQ LRQHV R PROpFXODV SRODUHV SURYRFDQGR VX GLVSHUVLyQ R GLVROXFLyQ /DV PROpFXODV GH DJXD VH GLVSRQHQ DOUHGHGRU GH ORV LRQHV SRVLWLYRV FRQ OD SDUWH QHJDWLYD GH VX PROpFXOD KDFLD HOORV HQ HO FDVR GH ORV LRQHV QHJDWLYRV HQIUHQWDQGR VX SDUWH SRVLWLYD FRQVLJXLHQGR DVt DWUDHUORV 6H IRUPD DVt XQD FDSD GH VROYDWDFLyQ DOUHGHGRU GH ORV PLVPRV TXH ORV LQGHSHQGL]D GLVSHUVD HQ HO VHQR DFXRVR DSD GH VROYDWDFLyQ HQ WRUQR D XQ LyQ SRVLWLYR
- 270. /D FDSDFLGDG GLVROYHQWH HV OD UHVSRQVDEOH GH GRV IXQFLRQHV +DFH GHO DJXD HO PHGLR LGHDO SDUD TXH VH GHVDUUROOHQ ODV UHDFFLRQHV GHO PHWDEROLVPR HQ HO LQWHULRU FHOXODU 6H FRQVWLWXH FRPR XQ HILFD] PHGLR GH WUDQVSRUWH GH VXVWDQFLDV DSRUWH GH QXWULHQWHV HOLPLQDFLyQ GH GHVHFKRV (OHYDGD IXHU]D GH FRKHVLyQ HQWUH VXV PROpFXODV /RV SXHQWHV GH KLGUyJHQR PDQWLHQHQ ODV PROpFXODV GH DJXD IXHUWHPHQWH XQLGDV IRUPDQGR XQD HVWUXFWXUD FRPSDFWD TXH OD FRQYLHUWH HQ XQ OtTXLGR FDVL LQFRPSUHQVLEOH $O QR SRGHU FRPSULPLUVH SXHGH WHQHU OD IXQFLyQ HQ DOJXQRV DQLPDOHV GH HVTXHOHWR KLGURVWiWLFR FRPR RFXUUH HQ DOJXQRV JXVDQRV SHUPLWH GDU YROXPHQ D ODV FpOXODV 7DPELpQ H[SOLFD OD IXQFLyQ PHFiQLFD DPRUWLJXDGRUD TXH HMHUFH HQ ODV DUWLFXODFLRQHV OtTXLGR VLQRYLDO
- 271. (OHYDGD IXHU]D GH DGKHVLyQ 6H GHEH DO HVWDEOHFLPLHQWR GH SXHQWHV GH KLGUyJHQR HQWUH ODV PROpFXODV GH DJXD RWUDV PROpFXODV SRODUHV HV UHVSRQVDEOH MXQWR FRQ OD FRKHVLyQ GHO OODPDGR IHQyPHQR GH OD FDSLODULGDG XDQGR VH LQWURGXFH XQ FDSLODU WXER GH SHTXHxR GLiPHWUR
- 272. HQ XQ UHFLSLHQWH FRQ DJXD pVWD DVFLHQGH SRU HO FDSLODU FRPR VL WUHSDVH DJDUUiQGRVH SRU ODV SDUHGHV KDVWD DOFDQ]DU XQ QLYHO VXSHULRU DO GHO UHFLSLHQWH $ HVWH IHQyPHQR VH GHEH HQ SDUWH OD DVFHQVLyQ GH OD VDYLD EUXWD GHVGH ODV UDtFHV KDVWD ODV KRMDV D WUDYpV GH ORV YDVRV OHxRVRV *UDQ FDORU HVSHFtILFR (O FDORU HVSHFtILFR VH GHILQH FRPR OD FDQWLGDG GH FDORU QHFHVDULD SDUD HOHYDU ž OD WHPSHUDWXUD GH JU GH DJXD (VWR KDFH TXH HO DJXD DOPDFHQH R OLEHUH XQD JUDQ FDQWLGDG GH FDORU DO FDOHQWDUVH R DO HQIULDUVH OR TXH SHUPLWH TXH HO DJXD DFW~H FRPR DPRUWLJXDGRU WpUPLFR HYLWDQGR EUXVFDV DOWHUDFLRQHV GH OD WHPSHUDWXUD HYLWDQGR GH HVWD IRUPD TXH SRU HMHPSOR DOJXQDV PROpFXODV FRPR ODV SURWHtQDV PX VHQVLEOHV D ORV FDPELRV WpUPLFRV VH DOWHUHQ $Vt VH PDQWLHQH OD WHPSHUDWXUD FRQVWDQWH )XQFLyQ WHUPRUUHJXODGRUD
- 273. (OHYDGR FDORU GH YDSRUDFLyQ (O FDORU GH YDSRUL]DFLyQ HV HO TXH VH QHFHVLWD VXPLQLVWUDU DO DJXD SDUD TXH FDPELH GHO HVWDGR OtTXLGR DO JDVHRVR HYDSRUL]DFLyQ
- 274. 3DUD HOOR HV QHFHVDULR URPSHU ORV SXHQWHV GH KLGUyJHQR SRU OR TXH VH QHFHVLWD VXPLQLVWUDU HO FDORU VXILFLHQWH SDUD HOOR 'H DKt TXH HO DJXD FDPELH GH HVWDGR D ORV ž (O VXGRU TXH VHJUHJDQ ORV VHUHV YLYRV SHUPLWH DFXPXODU HO H[FHVR GH FDORU GHO RUJDQLVPR DO HYDSRUDUVH HOLPLQDUOR FRQ SRFD SpUGLGD GH DJXD DFWXDQGR DVt FRPR UHJXODGRU WpUPLFR (OHYDGD WHQVLyQ VXSHUILFLDO /DV PROpFXODV GH OD VXSHUILFLH GHO DJXD H[SHULPHQWDQ IXHU]DV GH DWUDFFLyQ KDFLD HO LQWHULRU GHO OtTXLGR (VWR IDYRUHFH TXH GLFKD VXSHUILFLH RSRQJD XQD JUDQ UHVLVWHQFLD D VHU WUDVSDVDGD RULJLQD XQD ³SHOtFXOD VXSHUILFLDO´ TXH SHUPLWH SRU HMHPSOR HO GHVSOD]DPLHQWR VREUH HOOD GH DOJXQRV RUJDQLVPRV 'HQVLGDG (O DJXD HQ HVWDGR OtTXLGR HV PDV GHQVD TXH HQ HVWDGR VyOLGR (VWR SHUPLWH OD YLGD DFXiWLFD HQ FOLPDV IUtRV D TXH DO GHVFHQGHU OD WHPSHUDWXUD VH IRUPD XQD FDSD GH KLHOR HQ OD VXSHUILFLH TXH IORWD SURWHJH DO DJXD OtTXLGD TXH TXHGD EDMR HOOD )XQFLRQHV GHO DJXD HQ ORV VHUHV YLYRV
- 275. 'HULYDQ GH ODV SURSLHGDGHV ItVLFRTXtPLFDV DQWHULRUPHQWH H[SOLFDGDV )XQFLyQ GH GLVROYHQWH XQLYHUVDO UHODFLRQDGD FRQ VX HVWUXFWXUD GLSRODU )XQFLyQ HVWUXFWXUDO )XQFLyQ WUDQVSRUWDGRUD HQ UHODFLyQ WDPELpQ FRQ VX HVWUXFWXUD GLSRODU VX HOHYDGD IXHU]D GH DGKHVLyQ )XQFLyQ WHUPRUUHJXODGRUD FRQGLFLRQDGD SRU VX JUDQ FDORU HVSHFtILFR FDORU GH YDSRUL]DFLyQ )XQFLyQ DPRUWLJXDGRUD UHODFLRQDGD FRQ OD HOHYDGD IXHU]D GH FRKHVLyQ HQWUH VXV PROpFXODV )XQFLyQ UHDFWLYD OR TXH HVWi UHODFLRQDGR FRQ VX HVWUXFWXUD GLSRODU /26 )/8Ë'26 (1 /26 6(5(6 9,926 (O HVWXGLR GH ODV GLVROXFLRQHV HV IXQGDPHQWDO SDUD FRPSUHQGHU OD PDRU SDUWH GH ORV SURFHVRV ELROyJLFRV TXH RFXUUHQ HQ HO LQWHULRU GH ORV VHUHV YLYRV /RV IOXLGRV SUHVHQWHV HQ ORV VHUHV YLYRV FRQVWDQ GH XQD IDVH GLVSHUVDQWH TXH HV DFXRVD GH XQD IDVH GLVSHUVD R VROXWR IRUPDGD SRU SDUWtFXODV GH SHTXHxR WDPDxR 6HJ~Q HO WDPDxR GH ODV SDUWtFXODV GH OD IDVH GLVSHUVD VH SXHGHQ FODVLILFDU HQ 'LVROXFLRQHV YHUGDGHUDV 6L HO WDPDxR HV LQIHULRU D QP /DV SDUWtFXODV GLVXHOWDV VRQ LRQHV PROpFXODV DLVODGDV R SHTXHxDV DJUXSDFLRQHV TXH QR VHGLPHQWDQ 'LVSHUVLRQHV FRORLGDOHV 6L HO WDPDxR HVWi HQWUH QP /DV SDUWtFXODV QR VHGLPHQWDQ SHUR UHIOHMDQ UHIUDFWDQ OD OX] TXH LQFLGH VREUH HOODV 8Q GH ORV SURFHVRV ItVLFRTXtPLFRV PiV LPSRUWDQWHV TXH WLHQHQ OXJDU HQ ODV GLVROXFLRQHV YHUGDGHUDV HV OD yVPRVLV Ï6026,6 /D yVPRVLV HV XQ SURFHVR ItVLFRTXtPLFR FRQVLVWHQWH HQ HO SDVR GHO GLVROYHQWH GH XQD GLVROXFLyQ QR GHO VROXWR
- 276. D WUDYpV GH XQD PHPEUDQD VHPLSHUPHDEOH (O SDVR GHO GLVROYHQWH VH UHDOL]D VLHPSUH GHVGH OD VROXFLyQ PiV GLOXLGD KLSRWyQLFD
- 277. D OD PiV FRQFHQWUDGD KLSHUWyQLFD
- 278. PDQWHQLpQGRVH KDVWD TXH ODV GRV VROXFLRQHV VHSDUDGDV SRU OD PHPEUDQD WHQJDQ OD PLVPD FRQFHQWUDFLyQ VHDQ LVRWyQLFDV
- 279. (VWH SURFHVR RFXUUH SRU HMHPSOR HQ ODV PHPEUDQDV FHOXODUHV (O PHGLR LQWHUQR GH ODV FpOXODV HV HPLQHQWHPHQWH DFXRVR VXV PHPEUDQDV SODVPiWLFDV VRQ VHPLSHUPHDEOHV OR TXH IDYRUHFH TXH HO DJXD SDVH D VX WUDYpV H LJXDOH ODV FRQFHQWUDFLRQHV GH VDOHV D DPERV ODGRV 6L OD FRQFHQWUDFLyQ GH ORV IOXLGRV H[WUDFHOXODUHV H LQWUDFHOXODUHV HV OD PLVPD DPEDV GLVROXFLRQHV VRQ LVRWyQLFDV QR VH SURGXFHQ IHQyPHQRV RVPyWLFRV 6L SRU HO FRQWUDULR
- 280. HO PHGLR H[WUDFHOXODU HVWi PiV GLOXLGR VH GLFH TXH HV KLSRWyQLFR UHVSHFWR D OD FpOXOD HO DJXD WLHQGH D HQWUDU HQ OD FpOXOD SRU yVPRVLV KDVWD LJXDODU FRQFHQWUDFLRQHV (Q HVWH FDVR VH SURGXFH WXUJHVFHQFLD HV GHFLU OD FpOXOD VH KLQFKD FRUULHQGR HO ULHJR LQFOXVR GH HVWDOODU 6L HO PHGLR H[WHUQR HVWi PiV FRQFHQWUDGR VH GLFH TXH HV KLSHUWyQLFR UHVSHFWR DO LQWHULRU FHOXODU (Q HVWH FDVR HO DJXD VDOH GH OD FpOXOD SDUD LJXDODU ODV FRQFHQWUDFLRQHV GH IRUPD TXH OD FpOXOD SLHUGH DJXD VH GHVKLGUDWD SXHGH OOHJDU D PRULU SODVPyOLVLV
- 281. x /$6 6$/(6 0,1(5$/(6 /DV VDOHV PLQHUDOHV VH SXHGHQ HQFRQWUDU HQ ORV VHUHV YLYRV HQ WUHV IRUPDV 6XVWDQFLDV PLQHUDOHV SUHFLSLWDGDV FRQVWLWXHQ HVWUXFWXUDV VyOLGDV LQVROXEOHV FRQ QDWXUDOH]D HVTXHOpWLFD IRUPDQGR WDQWR H[RHVTXHOHWRV FRPR HQGRHVTXHOHWRV 3RU HMHPSOR HO FDUERQDWR GH FDOFLR IRVIDWR GH FDOFLR OD VtOLFH HWF 6DOHV PLQHUDOHV GLVXHOWDV /DV VXVWDQFLDV PLQHUDOHV DO GLVROYHUVH HQ HO PHGLR LQWHUQR DFXRVR GDQ OXJDU D DQLRQHV FDWLRQHV (VWRV LRQHV PDQWLHQHQ FRQVWDQWH HO JUDGR GH VDOLQLGDG GHQWUR GHO RUJDQLVPR DXGDQ D PDQWHQHU HO JUDGR GH DFLGH] S+
- 282. OR TXH HV LPSUHVFLQGLEOH SDUD HO FRUUHFWR GHVDUUROOR GH ODV UHDFFLRQHV PHWDEyOLFDV FHOXODUHV (O PHGLR LQWHUQR GH ORV RUJDQLVPRV SUHVHQWD XQDV FRQFHQWUDFLRQHV LyQLFDV FRQVWDQWHV GH KHFKR FXDOTXLHU YDULDFLyQ SURYRFD DOWHUDFLRQHV LPSRUWDQWHV HQ OD GLQiPLFD FHOXODU /D PDRU R PHQRU SUHVHQFLD GH VDOHV HQ HO PHGLR LQWHUQR FHOXODU GHWHUPLQD TXH VH SURGX]FDQ IHQyPHQRV RVPyWLFRV TXH UHJXOHQ ODV FRQFHQWUDFLRQHV D DPERV ODGRV GH OD PHPEUDQD FHOXODU FRQ OR TXH VH UHJXOD OD SUHVLyQ RVPyWLFD HO YROXPHQ FHOXODU 3DUD HYLWDU ODV YDULDFLRQHV GH S+ TXH FDXVDUtDQ WUDVWRUQRV JUDYHV HQ DOJXQRV SURFHVRV PHWDEyOLFRV OD SpUGLGD GH OD FDSDFLGDG IXQFLRQDO GH PXFKDV HQ]LPDV DOJXQDV VDOHV PLQHUDOHV GLVXHOWDV FXPSOHQ HVWD IXQFLyQ IRUPDQGR GLVROXFLRQHV WDPSyQ R DPRUWLJXDGRUDV TXH FRPSHQVDQ HO H[FHVR R HO GpILFLW GH LRQHV HQ HO PHGLR PDQWHQLHQGR FRQVWDQWH HO S+ (VWDV GLVROXFLRQHV HVWiQ IRUPDGDV SRU XQ iFLGR GpELO VX EDVH FRQMXJDGD TXH DFW~DQ FRPR GDGRUHV R UHFHSWRUHV GH + UHJXODQGR DVt HO S+ D TXH HO S+ ORJ +
- 283. 8Q HMHPSOR HV HO VLVWHPD WDPSyQ IRVIDWR +32 +32 + 6DOHV PLQHUDOHV DVRFLDGDV D PROpFXODV RUJiQLFDV QRUPDOPHQWH DSDUHFHQ DVRFLDGDV D SURWHtQDV R OtSLGRV 6H UHFRPLHQGD FRQVXOWDU KWWSZZZRXWXEHFRPZDWFKY 82Z%ZF/$ IHDWXUH UHODWHG KWWSZZZRXWXEHFRPZDWFKY VGL-W'5-4(F IHDWXUH UHODWHG $FLGLILFD 1HXWUDOL]D
- 284. KWWSZZZRXWXEHFRPZDWFKY +5P+;KF %,2(/(0(1726 %,202/e8/$6 ,125*È1,$6 $*8$ 6$/(6 0,1(5$/(6 /RV ELRHOHPHQWRV VH HQFXHQWUDQ HQ ORV VHUHV YLYRV IRUPDQGR SDUWH GH ODV PROpFXODV TXH SXHGHQ VHU LQRUJiQLFDV X RUJiQLFDV %LRPROpFXODV RUJiQLFDV 6H HQFXHQWUDQ IRUPDQGR SDUWH GH ORV VHUHV YLYRV 6RQ ORV JO~FLGRV OtSLGRV SURWHtQDV iFLGRV QXFOHLFRV %LRPROpFXODV LQRUJiQLFDV 3XHGHQ HQFRQWUDUVH GHQWUR IXHUD GH ORV VHUHV YLYRV VRQ HO DJXD ODV VDOHV PLQHUDOHV %,202/e8/$6 ,125*È1,$6 x (/ $*8$ (O DJXD HV OD PROpFXOD PiV DEXQGDQWH HQ ORV VHUHV YLYRV UHSUHVHQWD HQWUH HO GHO SHVR GH OD PDRU SDUWH GH ORV RUJDQLVPRV (O FRQWHQLGR YDUËD GH XQD HVSHFLH D RWUD GHSHQGLHQGR WDPELpQ GH OD HGDG GHO LQGLYLGXR VX GLVPLQXH DO DXPHQWDU OD HGDG
- 285. HO WLSR GH WHMLGR DUDFWHUtVWLFDV GH OD PROpFXOD GH DJXD (VWi IRUPDGD SRU GRV iWRPRV GH KLGUyJHQR XQR GH R[tJHQR XQLGRV SRU HQODFHV FRYDOHQWHV VLPSOHV
- 286. /D PROpFXOD GHO DJXD HV XQ GLSROR 'HELGR D OD HOHFWURQHJDWLYLGDG GHO R[tJHQR ORV HOHFWURQHV GH ORV KLGUyJHQRV VH GHVSOD]DQ KDFLD pVWH FDUJiQGRVH QHJDWLYDPHQWH HO SROR GH OD PROpFXOD TXH RFXSD HO R[tJHQR DSDUHFLHQGR GRV SRORV SRVLWLYRV HQ ORV KLGUyJHQRV (QWUH ORV GLSRORV VH HVWDEOHFHQ IXHU]DV GH DWUDFFLyQ GHQRPLQDGDV SXHQWHV GH KLGUyJHQR GH IRUPD TXH VH IRUPDQ PDFURPROpFXODV GH KDVWD PROpFXODV FRH[LVWLHQGR pVWDV FRQ PROpFXODV DLVODGDV OR TXH GHWHUPLQD TXH HO DJXD SUHVHQWH PDRU SHVR PROHFXODU VH SUHVHQWH HQ HVWDGR OtTXLGR $Vt VH IRUPD XQD HVWUXFWXUD RUGHQDGD UHVSRQVDEOH GHO FRPSRUWDPLHQWR FDUDFWHUtVWLFR GHO DJXD DVt FRPR GH VXV SURSLHGDGHV ItVLFDV TXtPLFDV 3URSLHGDGHV ItVLFR TXtPLFDV GHO DJXD $FFLyQ GLVROYHQWH 6H OH FRQVLGHUD HO GLVROYHQWH XQLYHUVDO D TXH HV FDSD] HVWDEOHFHU LQWHUDFFLRQHV FRQ LRQHV R PROpFXODV SRODUHV SURYRFDQGR VX GLVSHUVLyQ R GLVROXFLyQ /DV PROpFXODV GH DJXD VH GLVSRQHQ DOUHGHGRU GH ORV LRQHV SRVLWLYRV FRQ OD SDUWH QHJDWLYD GH VX PROpFXOD KDFLD HOORV HQ HO FDVR GH ORV LRQHV QHJDWLYRV HQIUHQWDQGR VX SDUWH SRVLWLYD FRQVLJXLHQGR DVt DWUDHUORV 6H IRUPD DVt XQD FDSD GH VROYDWDFLyQ DOUHGHGRU GH ORV PLVPRV TXH ORV LQGHSHQGL]D GLVSHUVD HQ HO VHQR DFXRVR
- 287. DSD GH VROYDWDFLyQ HQ WRUQR D XQ LRQ SRVLWLYR /D FDSDFLGDG GLVROYHQWH HV OD UHVSRQVDEOH GH GRV IXQFLRQHV +DFH GHO DJXD HO PHGLR LGHDO SDUD TXH VH GHVDUUROOHQ ODV UHDFFLRQHV GHO PHWDEROLVPR HQ HO LQWHULRU FHOXODU 6H FRQVWLWXH FRPR XQ HILFD] PHGLR GH WUDQVSRUWH GH VXVWDQFLDV DSRUWH GH QXWULHQWHV HOLPLQDFLyQ GH GHVHFKRV (OHYDGD IXHU]D GH FRKHVLyQ HQWUH VXV PROpFXODV /RV SXHQWHV GH KLGUyJHQR PDQWLHQHQ ODV PROpFXODV GH DJXD IXHUWHPHQWH XQLGDV IRUPDQGR XQD HVWUXFWXUD FRPSDFWD TXH OD FRQYLHUWH HQ XQ OtTXLGR FDVL LQFRPSUHQVLEOH $O QR SRGHU FRPSULPLUVH SXHGH WHQHU OD IXQFLyQ HQ DOJXQRV DQLPDOHV GH HVTXHOHWR KLGURVWiWLFR FRPR RFXUUH HQ DOJXQRV JXVDQRV SHUPLWH GDU YROXPHQ D ODV FpOXODV 7DPELpQ H[SOLFD OD IXQFLyQ PHFiQLFD DPRUWLJXDGRUD TXH HMHUFH HQ ODV DUWLFXODFLRQHV OtTXLGR VLQRYLDO
- 288. (OHYDGD IXHU]D GH DGKHVLyQ 6H GHEH DO HVWDEOHFLPLHQWR GH SXHQWHV GH KLGUyJHQR HQWUH ODV PROpFXODV GH DJXD RWUDV PROpFXODV SRODUHV HV UHVSRQVDEOH MXQWR FRQ OD FRKHVLyQ GHO OODPDGR IHQyPHQR GH OD FDSLODULGDG XDQGR VH LQWURGXFH XQ FDSLODU WXER GH SHTXHxR GLiPHWUR
- 289. HQ XQ UHFLSLHQWH FRQ DJXD pVWD DVFLHQGH SRU HO FDSLODU FRPR VL WUHSDVH DJDUUiQGRVH SRU ODV SDUHGHV KDVWD DOFDQ]DU XQ QLYHO VXSHULRU DO GHO UHFLSLHQWH $ HVWH IHQyPHQR VH GHEH HQ SDUWH OD DVFHQVLyQ GH OD VDYLD EUXWD GHVGH ODV UDtFHV KDVWD ODV KRMDV D WUDYpV GH ORV YDVRV OHxRVRV *UDQ FDORU HVSHFtILFR (O FDORU HVSHFtILFR VH GHILQH FRPR OD FDQWLGDG GH FDORU QHFHVDULD SDUD HOHYDU ž OD WHPSHUDWXUD GH JU GH DJXD (VWR KDFH TXH HO DJXD DOPDFHQH R OLEHUH XQD JUDQ FDQWLGDG GH FDORU DO FDOHQWDUVH R DO HQIULDUVH OR TXH SHUPLWH TXH HO DJXD DFW~H FRPR DPRUWLJXDGRU WpUPLFR HYLWDQGR EUXVFDV DOWHUDFLRQHV GH OD WHPSHUDWXUD HYLWDQGR GH HVWD IRUPD TXH SRU HMHPSOR DOJXQDV PROpFXODV FRPR ODV SURWHtQDV PX VHQVLEOHV D ORV FDPELRV WpUPLFRV VH DOWHUHQ $Vt VH PDQWLHQH OD WHPSHUDWXUD FRQVWDQWH )XQFLyQ WHUPRUUHJXODGRUD
- 290. (OHYDGR FDORU GH YDSRUDFLyQ (O FDORU GH YDSRUL]DFLyQ HV HO TXH VH QHFHVLWD VXPLQLVWUDU DO DJXD SDUD TXH FDPELH GHO HVWDGR OtTXLGR DO JDVHRVR HYDSRUL]DFLyQ
- 291. 3DUD HOOR HV QHFHVDULR URPSHU ORV SXHQWHV GH KLGUyJHQR SRU OR TXH VH QHFHVLWD VXPLQLVWUDU HO FDORU VXILFLHQWH SDUD HOOR 'H DKt TXH HO DJXD FDPELH GH HVWDGR D ORV ž (O VXGRU TXH VHJUHJDQ ORV VHUHV YLYRV SHUPLWH DFXPXODU HO H[FHVR GH FDORU GHO RUJDQLVPR DO HYDSRUDUVH HOLPLQDUOR FRQ SRFD SpUGLGD GH DJXD DFWXDQGR DVt FRPR UHJXODGRU WpUPLFR (OHYDGD WHQVLyQ VXSHUILFLDO /DV PROpFXODV GH OD VXSHUILFLH GHO DJXD H[SHULPHQWDQ IXHU]DV GH DWUDFFLyQ KDFLD HO LQWHULRU GHO OtTXLGR (VWR IDYRUHFH TXH GLFKD VXSHUILFLH RSRQJD XQD JUDQ UHVLVWHQFLD D VHU WUDVSDVDGD RULJLQD XQD ³SHOtFXOD VXSHUILFLDO´ TXH SHUPLWH SRU HMHPSOR HO GHVSOD]DPLHQWR VREUH HOOD GH DOJXQRV RUJDQLVPRV 'HQVLGDG (O DJXD HQ HVWDGR OtTXLGR HV PDV GHQVD TXH HQ HVWDGR VyOLGR (VWR SHUPLWH OD YLGD DFXiWLFD HQ FOLPDV IUtRV D TXH DO GHVFHQGHU OD WHPSHUDWXUD VH IRUPD XQD FDSD GH KLHOR HQ OD VXSHUILFLH TXH IORWD SURWHJH DO DJXD OtTXLGD TXH TXHGD EDMR HOOD
- 292. )XQFLRQHV GHO DJXD HQ ORV VHUHV YLYRV 'HULYDQ GH ODV SURSLHGDGHV ItVLFRTXtPLFDV DQWHULRUPHQWH H[SOLFDGDV )XQFLyQ GH GLVROYHQWH XQLYHUVDO UHODFLRQDGD FRQ VX HVWUXFWXUD GLSRODU )XQFLyQ HVWUXFWXUDO )XQFLyQ WUDQVSRUWDGRUD HQ UHODFLyQ WDPELpQ FRQ VX HVWUXFWXUD GLSRODU VX HOHYDGD IXHU]D GH DGKHVLyQ )XQFLyQ WHUPRUUHJXODGRUD FRQGLFLRQDGD SRU VX JUDQ FDORU HVSHFtILFR FDORU GH YDSRUL]DFLyQ )XQFLyQ DPRUWLJXDGRUD UHODFLRQDGD FRQ OD HOHYDGD IXHU]D GH FRKHVLyQ HQWUH VXV PROpFXODV )XQFLyQ UHDFWLYD OR TXH HVWi UHODFLRQDGR FRQ VX HVWUXFWXUD GLSRODU /26 )/8Ë'26 (1 /26 6(5(6 9,926 (O HVWXGLR GH ODV GLVROXFLRQHV HV IXQGDPHQWDO SDUD FRPSUHQGHU OD PDRU SDUWH GH ORV SURFHVRV ELROyJLFRV TXH RFXUUHQ HQ HO LQWHULRU GH ORV VHUHV YLYRV /RV IOXtGRV SUHVHQWHV HQ ORV VHUHV YLYRV FRQVWDQ GH XQD IDVH GLVSHUVDQWH TXH HV DFXRVD GH XQD IDVH GLVSHUVD R VROXWR IRUPDGD SRU SDUWtFXODV GH SHTXHxR WDPDxR 6HJ~Q HO WDPDxR GH ODV SDUWtFXODV GH OD IDVH GLVSHUVD VH SXHGHQ FODVLILFDU HQ 'LVROXFLRQHV YHUGDGHUDV 6L HO WDPDxR HV LQIHULRU D QP /DV SDUWtFXODV GLVXHOWDV VRQ LRQHV PROpFXODV DLVODGDV R SHTXHxDV DJUXSDFLRQHV TXH QR VHGLPHQWDQ 'LVSHUVLRQHV FRORLGDOHV 6L HO WDPDxR HVWi HQWUH QP /DV SDUWtFXODV QR VHGLPHQWDQ SHUR UHIOHMDQ UHIUDFWDQ OD OX] TXH LQFLGH VREUH HOODV 8Q GH ORV SURFHVRV ItVLFRTXtPLFRV PiV LPSRUWDQWHV TXH WLHQHQ OXJDU HQ ODV GLVROXFLRQHV YHUGDGHUDV HV OD yVPRVLV Ï6026,6 /D yVPRVLV HV XQ SURFHVR ItVLFRTXtPLFR FRQVLVWHQWH HQ HO SDVR GHO GLVROYHQWH GH XQD GLVROXFLyQ QR GHO VROXWR
- 293. D WUDYpV GH XQD PHPEUDQD VHPLSHUPHDEOH (O SDVR GHO GLVROYHQWH VH UHDOL]D VLHPSUH GHVGH OD VROXFLyQ PiV GLOXtGD KLSRWyQLFD
- 294. D OD PiV FRQFHQWUDGD KLSHUWyQLFD
- 295. PDQWHQLpQGRVH KDVWD TXH ODV GRV VROXFLRQHV VHSDUDGDV SRU OD PHPEUDQD WHQJDQ OD PLVPD FRQFHQWUDFLyQ VHDQ LVRWyQLFDV
- 296. (VWH SURFHVR RFXUUH SRU HMHPSOR HQ ODV PHPEUDQDV FHOXODUHV (O PHGLR LQWHUQR GH ODV FpOXODV HV HPLQHQWHPHQWH DFXRVR VXV PHPEUDQDV SODVPiWLFDV VRQ VHPLSHUPHDEOHV OR TXH IDYRUHFH TXH HO DJXD SDVH D VX WUDYpV H LJXDOH ODV FRQFHQWUDFLRQHV GH VDOHV D DPERV ODGRV
- 297. 6L OD FRQFHQWUDFLyQ GH ORV IOXLGRV H[WUDFHOXODUHV H LQWUDFHOXODUHV HV OD PLVPD DPEDV GLVROXFLRQHV VRQ LVRWyQLFDV QR VH SURGXFHQ IHQyPHQRV RVPyWLFRV 6L SRU HO FRQWUDULR HO PHGLR H[WUDFHOXODU HVWi PiV GLOXLGR VH GLFH TXH HV KLSRWyQLFR UHVSHFWR D OD FpOXOD HO DJXD WLHQGH D HQWUDU HQ OD FpOXOD SRU yVPRVLV KDVWD LJXDODU FRQFHQWUDFLRQHV (Q HVWH FDVR VH SURGXFH WXUJHVFHQFLD HV GHFLU OD FpOXOD VH KLQFKD FRUULHQGR HO ULHJR LQFOXVR GH HVWDOODU 6L HO PHGLR H[WHUQR HVWi PiV FRQFHQWUDGR VH GLFH TXH HV KLSHUWyQLFR UHVSHFWR DO LQWHULRU FHOXODU (Q HVWH FDVR HO DJXD VDOH GH OD FpOXOD SDUD LJXDODU ODV FRQFHQWUDFLRQHV GH IRUPD TXH OD FpOXOD SLHUGH DJXD VH GHVKLGUDWD SXHGH OOHJDU D PRULU SODVPyOLVLV
- 298. x /$6 6$/(6 0,1(5$/(6 /DV VDOHV PLQHUDOHV VH SXHGHQ HQFRQWUDU HQ ORV VHUHV YLYRV HQ WUHV IRUPDV 6XVWDQFLDV PLQHUDOHV SUHFLSLWDGDV FRQVWLWXHQ HVWUXFWXUDV VyOLGDV LQVROXEOHV FRQ QDWXUDOH]D HVTXHOpWLFD IRUPDQGR WDQWR H[RHVTXHOHWRV FRPR HQGRHVTXHOHWRV 3RU HMHPSOR HO FDUERQDWR GH FDOFLR IRVIDWR GH FDOFLR OD VtOLFH HWF 6DOHV PLQHUDOHV GLVXHOWDV /DV VXVWDQFLDV PLQHUDOHV DO GLVROYHUVH HQ HO PHGLR LQWHUQR DFXRVR GDQ OXJDU D DQLRQHV FDWLRQHV (VWRV LRQHV PDQWLHQHQ FRQVWDQWH HO JUDGR GH VDOLQLGDG GHQWUR GHO RUJDQLVPR DXGDQ D PDQWHQHU HO JUDGR GH DFLGH] S+
- 299. OR TXH HV LPSUHVFLQGLEOH SDUD HO FRUUHFWR GHVDUUROOR GH ODV UHDFFLRQHV PHWDEyOLFDV FHOXODUHV (O PHGLR LQWHUQR GH ORV RUJDQLVPRV SUHVHQWD XQDV FRQFHQWUDFLRQHV LyQLFDV FRQVWDQWHV GH KHFKR FXDOTXLHU YDULDFLyQ SURYRFD DOWHUDFLRQHV LPSRUWDQWHV HQ OD GLQiPLFD FHOXODU /D PDRU R PHQRU SUHVHQFLD GH VDOHV HQ HO PHGLR LQWHUQR FHOXODU GHWHUPLQD TXH VH SURGX]FDQ IHQyPHQRV RVPyWLFRV TXH UHJXOHQ ODV FRQFHQWUDFLRQHV D DPERV ODGRV GH OD PHPEUDQD FHOXODU FRQ OR TXH VH UHJXOD OD SUHVLyQ RVPyWLFD HO YROXPHQ FHOXODU 3DUD HYLWDU ODV YDULDFLRQHV GH S+ TXH FDXVDUtDQ WUDVWRUQRV JUDYHV HQ DOJXQRV SURFHVRV PHWDEyOLFRV OD SpUGLGD GH OD FDSDFLGDG IXQFLRQDO GH PXFKDV HQ]LPDV DOJXQDV VDOHV PLQHUDOHV GLVXHOWDV FXPSOHQ HVWD IXQFLyQ IRUPDQGR GLVROXFLRQHV WDPSyQ R DPRUWLJXDGRUDV TXH FRPSHQVDQ HO H[FHVR R HO GpILFLW GH LRQHV HQ HO PHGLR PDQWHQLHQGR FRQVWDQWH HO S+ (VWDV GLVROXFLRQHV HVWiQ IRUPDGDV SRU XQ iFLGR GpELO VX EDVH FRQMXJDGD TXH DFW~DQ FRPR GDGRUHV R UHFHSWRUHV GH + UHJXODQGR DVt HO S+ D TXH HO S+ ORJ +
- 300. 8Q HMHPSOR HV HO VLVWHPD WDPSyQ IRVIDWR +32 +32 + 6DOHV PLQHUDOHV DVRFLDGDV D PROpFXODV RUJiQLFDV QRUPDOPHQWH DSDUHFHQ DVRFLDGDV D SURWHtQDV R OtSLGRV 6H UHFRPLHQGD FRQVXOWDU KWWSZZZRXWXEHFRPZDWFKY 82Z%ZF/$ IHDWXUH UHODWHG $FLGLILFD 1HXWUDOL]D
- 301. Tema 4. Aminoácidos y péptidos Bioquímica 49 TEMA 4 AMINOÁCIDOS Y PÉPTIDOS 1. Estructura y clasificación de los aminoácidos. 2. Propiedades ácido-base de los aminoácidos y péptidos 3. El enlace peptídico 4. Péptidos: hidrólisis y secuenciación 1. Estructura y clasificación de los aminoácidos. Como su nombre indica los aminoácidos son compuestos que poseen un grupo amino (-NH2) y un grupo ácido (carboxílico -COOH) en su estructura. Los aminoácidos son los precursores de los péptidos y las proteínas, y en ellos el grupo amino y el grupo carboxilo, se encuentran unidos al mismo átomo de carbono, conocido como carbono-D (D-aminoácidos). La estructura general de los D- aminoácidos (a excepción de la prolina, que es cíclica) se muestra en la Figura 1. Como se puede apreciar, el carbono-D (a excepción de la glicina) es un carbono quiral y como tal presenta dos enantiómeros (L- y D-). Los 20 D-aminoácidos Figura 1. Estructura química de un aminoácido. Estructura química en el plano y estructura espacial. Enantiómeros del aminoácido alanina.
- 302. Tema 4. Aminoácidos y péptidos Bioquímica 50 presentes en las proteínas son de la serie L- y en su representación de Fischer poseen el grupo amino hacia la izquierda. La diferencia entre los aminoácidos viene dada por el resto -R, o cadena lateral, unida al carbono-D. Atendiendo a la naturaleza del grupo -R los aas pueden clasificarse en: · Neutros o apolares · Polares sin carga · Polares con carga negativa · Polares con carga positiva La Figura 2 recoge las estructuras de los 20 L-D-aminoácidos a pH fisiológico. Neutros o Apolares. Son 8 los aminoácidos que se clasifican como poseedores de cadenas laterales no polares. La alanina, valina, leucina e isoleucina, poseen cadenas laterales de hidrocarburos alifáticos. La metionina posee una cadena lateral de éter tiólico (C-S-C). La prolina es el único aminoácido cíclico, pues el grupo -R se cierra sobre el N del grupo D-amino (realmente es un amina secundaria). Por su parte, la fenilalanina y el triptófano contienen grupos aromáticos. Polares sin carga. Siete son los D-aminoácidos cuyo resto -R es polar pero sin carga. La glicina posee la cadena más simple, un átomo de hidrógeno. La serina y la treonina son portadores de un grupo hidroxilo (-OH). La asparragina y la glutamina, poseen cadenas laterales portadoras de un grupo amida, y por hidrólisis dan lugar, respectivamente, a aspartato y glutamato, dos aminoácidos con carga negativa. La tirosina posee un grupo fenólico y la cisteína debe su polaridad a la presencia de un grupo tiólico (-SH). Polares con carga negativa. Existen dos D-aminoácidos cuyo resto polar posee carga negativa a pH fisiológico, debida a la presencia de un grupo carboxilo (- COOH) , el ácido glutámico y el ácido aspártico. Polares con carga positiva. Tres son los D-aminoácidos que poseen restos -R cargados positivamente a pH fisiológico. La lisina posee una cadena lateral de butilamonio, la arginina presenta un grupo -R de guanidina y la histidina es portadora de un grupo -R de imidazolio.
- 303. Tema 4. Aminoácidos y péptidos Bioquímica 51 APOLARES Glicina (gly) Alanina (ala) Valina (val) Leucina (leu) Metionina (met) Isoleucina (ile) Fenilalanina (phe) Prolina (pro) Triptófano (trp) Serina (ser) Treonina (thr) ( ) Cisteína (cys) asparragina (asn) glutamina (gln) Aspártato (asp) ( ) Glutamato (glu) ( ) lisina (lys) arginina (arg) Histidina (his) Figura 2. Estructura química de los L-aminoácidos.
- 304. Tema 4. Aminoácidos y péptidos Bioquímica 52 Esta clasificación se ha realizado en base al grupo -R, pero es importante indicar que a pH fisiológico (pH 7,3), el grupo D-amino se encuentra cargado positivamente y el grupo D-carboxilo lo está negativamente, por esta razón en la Figura 2 estos grupos aparecen siempre cargados. Dentro del conjunto de los aminoácidos naturales, existen unos que pueden ser sintetizados por las células humanas a partir de otras sustancias, pero también hay aminoácidos que debemos tomarlos en la dieta, ya que nuestras células no pueden sintetizarlos o, cuando menos, no en cantidad suficiente para satisfacer la demanda del organismo; se conocen con el nombre de aminoácidos esenciales y son valina, leucina, isoleucina, treonina, metionina, fenilalanina, triptófano y lisina. Ácido Aspártico (Asp) D Cisterna Cys) C Isoleucina (IIe) I Serina (Ser) S Ácido Glutámico (Glu)E Fenilalanina (Phe) F Leucina (Leu) L Tirosina (Tyr) Y Alanina (Ala) A Glicina (Gly) G Lisina (Lys) K Treonina (Thr) T Arginina (Arg) R Glutamina (Glu) Q Metionina (Met) M Triptófano (Trp) W Asparagina (Asn) N Histidina (His) H Prolina (Pro) P Valina (Val) V 2. Propiedades ácido-base de los aminoácidos y los péptidos El pH del medio en el que se encuentre el aminoácido es esencial para determinar sus propiedades ácido-base, aspecto importante pues de ello dependen las propiedades químicas y la funcionalidad biológica de los péptidos y proteínas que forman. Las propiedades ácido-base de un aminoácido vienen determinadas por los grupos protonables que posea. Un aminoácido puede actuar bien como ácido o como base (sustancias anfóteras), pudiendo tener hasta tres grupos con carácter ácido-base: el D-amino, el D-carboxilo y, en algunos casos, el resto -R. Lo importante es que estos grupos poseen un carácter ácido-base débil, lo que hace que, dependiendo del pH, el correspondiente equilibrio pueda desplazarse en un sentido o en otro (hacia la forma protonada o hacia la desprotonada, Figura 3).
- 305. Tema 4. Aminoácidos y péptidos Bioquímica 53 La expresión que regula la proporción entre las formas protonada y desprotonada es: Donde DP es la forma protonada y P es la forma desprotonada. Veamos como afecta el pH a la valina. La val posee sólo dos grupos protonables, el D-amino y el D- carboxilo. A pH fisiológico la valina presentaría la siguiente estructura: Tomemos los grupos por separado y veamos como les afecta el pH. El grupo D- amino presentaría dos formas, una protonada (P) y cargada positivamente (-NH3 +), y otra desprotonada (DP) y sin carga (-NH2), según el siguiente equilibrio: P DP pKpH a log CH COONH3 + CH CH3 CH3 -
- 306. 8log23 |o aa KpKeldondeHNHNH Figura 3 Ionización de un L-aminoácido.
- 307. Tema 4. Aminoácidos y péptidos Bioquímica 54 si el pH aumenta, el equilibrio se desplaza hacia la derecha (dominando la forma con carga 0) y si disminuye lo hará hacia la izquierda (dominando la forma con carga +1). Con el grupo D-carboxilo ocurriría algo similar: En función del pH, la proporción de forma protonada (carga 0) o forma desprotonada (carga -1) variará, respetando siempre la constante de ionización del grupo en cuestión si la temperatura se mantiene constante. Supongamos que estamos ahora a pH 1; en estas condiciones de elevada concentración de protones en el medio ambos equilibrios estarían desplazados en un 100 % hacia las formas protonadas. Si aumentamos el pH los equilibrios comenzarían a desplazarse hacia la derecha hasta llegar a un pH muy básico, momento en el que las formas dominantes (al 100 %) serían las desprotonadas. Pero, ¿qué ocurre a pHs intermedios?. Para ello debemos tener en cuenta la Ka de cada equilibrio, o mejor dicho su pKa (que sería el -logKa). El grupo D-amino de la valina tiene un pK de 8, y esto quiere decir que a pH 8 el 50 % de los grupos amino estarán protonados (si tenemos 100 moléculas de valina, 50 tendrán el grupo amino protonado y 50 lo tendrán desprotonado, al menos teóricamente, según se desprende de la constante de ionización). Por su parte el grupo D-carboxilo de la valina, (pK = 2), estará protonado al 50 % cuando el pH del medio sea 2. En general se asumen las siguientes consideraciones, para determinar el porcentaje de protonación de un grupo ionizable en un aminoácido: · Si el pH pK-1 el grupo esta al 100 % protonado · Si el pH pK+1 el grupo está al 100 % desprotonado · Si el pH = pK el grupo está al 50 % protonado Tomemos ahora un aminoácido con tres grupos ionizables, el ácido glutámico: CH COONH3 + CH2 CH2 COO - (D-carboxilo) (J-carboxilo) -(D-amino)
- 308. 2log |o aa KpKeldondeHCOOCOOH
- 309. Tema 4. Aminoácidos y péptidos Bioquímica 55 que posee el grupo D-amino, el D-carboxilo y el J-carboxilo. Los tres grupos ionizables darán lugar a tres equilibrios ácido-base distintos, cada uno con su correspondiente pKa (2, 4 y 8 respectivamente). Para ver como afecta el pH a la carga de cada grupo vamos a realizar la siguiente tabla, en la que ordenamos (de menor a mayor pK) los grupos protonables y sus correspondientes valores de carga en función del pH: GRUPO 1 2 3 4 5 6 7 8 9 10 D-carboxilo (pK=2) 0 -0,5 -1 -1 -1 -1 -1 -1 -1 -1 J-carboxilo (pK=4) 0 0 0 -0,5 -1 -1 -1 -1 -1 -1 D-amino (pK=8) +1 +1 +1 +1 +1 +1 +1 0,5 0 0 carga total +1 0,5 0 -0,5 -1 -1 -1 -1,5 -2 -2 1) a pH= 1, el pH es inferior en una unidad al pK del grupo D-COOH, el cuál estará protonado al 100 %, luego su carga será 0; y lo mismo le ocurrirá al grupo J-COOH, protonado al 100 % y con carga 0. Por su parte, el grupo D- amino también estará protonado, aunque en este caso la carga del grupo es +1. 2) a pH= 2, se produce coincidencia del pH con el pK del D-COOH, por lo que estará al 50 % protonado. Luego la carga será -0,5 ; este pH es aún dos unidades inferior al pK del grupo J-COOH, que seguirá protonado (0), como también le ocurriría al grupo D-amino (+1). La carga total del glutámico sería 0,5. 3) a pH= 3, se ha superado en una unidad el pKa del D-COOH, luego estará desprotonado al 100 % y su carga será -1 para valores superiores de pH. Los otros dos grupos siguen estando protonados al 100 % (0 y +1, respectivamente). Y la carga total será cero. 4) a pH= 4, el pH coincide con el pKa del grupo J-COOH y estará protonado en un 50% (carga -0,5). El D-COOH seguirá desprotonado (0) y el D-amino protonado (+1). La carga total será ahora -0,5.
- 310. Tema 4. Aminoácidos y péptidos Bioquímica 56 5) a pH=5 el grupo J-COOH estará al 100 % desprotonado y el resto de grupos seguirá igual, hasta llegar a pH= 8, donde el D-amino estará desprotonado al 50 % (0,5) , grupo que se desprotonará al 100 % a partir de un pH= 9. Como se puede apreciar en la tabla, la carga total del aminoácido depende del pH de la disolución en que se encuentre. Existe un pH al cual la carga neta del aminoácido es cero (si lo colocamos en un campo eléctrico no se desplazará hacia ninguno de los polos). El pH al cuál un aminoácido posee carga neta cero recibe el nombre de punto isoeléctrico (pI), que es la media aritmética de los valores de pK1 y pK2 que delimitan la forma con carga cero. En la siguiente tabla pueden localizarse los aminoácidos que, al igual que el ácido glutámico, poseen grupos –R protonables.
- 311. Tema 4. Aminoácidos y péptidos Bioquímica 57 3. El enlace peptídico Los aminoácidos se encuentran unidos en los péptidos y las proteínas mediante un enlace amida (-CO-NH-): Este enlace se forma por reacción entre el grupo D-COOH de un aminoácido y el D- amino del siguiente (con pérdida de una molécula de agua) y recibe el nombre de enlace peptídico. Figura 4. Estructura espacial del enlace peptídico. (a) Ilustración del carácter parcialmente doble del enlace peptídico. (b) Configuración del plano que conforman el enlace peptídico y los carbonos D extremos.
- 312. Tema 4. Aminoácidos y péptidos Bioquímica 58 Entre los años 1930-1940, Pauling y Corey, mediante el estudio de Rayos X de cristales de aminoácidos, dipéptidos y tripétidos, dilucidaron la estructura tridimensional del enlace peptídico (Figura 4). Así, descubrieron que la unión C-N del enlace peptídico era más corta que en la mayor parte de los demás enlaces C-N y llegaron a la conclusión de que el enlace debía tener algún carácter de doble enlace, por la aparición de dos formas resonantes: Luego dedujeron que los 4 átomos que rodeaban al enlace peptídico C-N (O, CD, CD, H) estaban situados en el mismo plano, de tal manera que el oxígeno del grupo carbonilo y el hidrógeno del N-H estarían en posición trans. Esta ordenación es rígida, y es el resultado de la estabilización por resonancia de las formas anteriormente citadas. Partiendo de estos dos hechos, puede describirse el armazón de una cadena polipeptídica como constituido por una serie de planos, con posibilidad de giro en los CD. De esta forma podemos escribir la estructura de un péptido como una sucesión de planos en la que los grupos -R se van alternando (Figura 5). Figura 5. Estructura espacial de un péptido. Secuencia ordenada de los planos de enlace peptídico en el espacio. Los grupos R se alternan por encima y debajo del plano general de la molécula.
- 313. Tema 4. Aminoácidos y péptidos Bioquímica 59 4. Secuenciación de un péptido La posición que ocupa cada aminoácido dentro de la cadena polipeptídica, esto es la secuencia, constituye el primer nivel estructural de las proteínas, su estructura primaria. La secuencia de un péptido tiene gran importancia porque entre otras cosas condiciona los siguientes niveles estructurales. La insulina bovina fue la primera proteína que se secuenció completamente por Sanger en 1953, lo que le valió el premio Nobel. La determinación de la secuencia de la insulina fue el resultado del trabajo de muchos científicos durante 10 años, desde entonces se han secuenciado miles de proteínas. La secuencia de una proteína, si conocemos el gen del que proviene, puede obtenerse indirectamente, secuenciando dicho gen. Pero también puede hacerse la secuenciación química directa. Los pasos a seguir son: x Determinación de la composición del péptido por hidrólisis total y posterior análisis cromatográfico. x Determinación de los extremos C-terminal y N-terminal x Fragmentación por hidrólisis selectiva x Secuenciación: Degradación de Edman La determinación de la composición del péptido se realiza por hidrólisis total presencia de HCl 6N, calentando a 100 °C durante 10-24h, y en tubo al que se le ha hecho el vacío. Tras el proceso se utiliza un sistema cromatográfico que permita separar y determinar cuántos y cuáles son los aminoácidos que forman la cadena. Hay distintos métodos que permiten determinar el primer aminoácido (Resto N- terminal) o el último (Resto C- terminal) de una cadena polipeptídica. x La determinación del resto N-terminal, se puede realizar, entre otros métodos, mediante la Degradación de Edman: en este proceso el péptido reacciona con fenil isotiocianato que se une selectivamente al primer aminoácido. A continuación se escinde con HF anhidro el aminoácido marcado, separándolo del resto selectivamente con un disolvente orgánico. Tras un tratamiento en medio ácido el compuesto resultante se determina cromatográficamente (Figura 6).
- 314. Tema 4. Aminoácidos y péptidos Bioquímica 60 x Por otro lado, la determinación del resto C-terminal, se puede realizar con Hidracina: este compuesto reacciona con todos los enlaces peptídicos del péptido, provocando la hidrólisis de los mismos y dando lugar a aminoacil-hidracinas con todos los aminoácidos excepto con el último (C-terminal), pudiendo separarse del resto fácilmente y determinarse con posterioridad su naturaleza. Figura 6. Determinación de la secuencia de un péptido. Hidrólisis total de la proteína. (a). Determinación del primer aminoácido utilizando 2,4-dinitrofluorobenceno (b) o fenilisotiocianato (c). Este último método también se conoce como degradación de Edman y permite la secuenciación del péptido.
- 315. Tema 4. Aminoácidos y péptidos Bioquímica 61 La fragmentación por hidrólisis parcial es necesaria porque por lo general no pueden secuenciarse péptidos con más de 20 o 30 aminoácidos. Se realiza con reactivos selectivos, en la mayoría de los casos se utilizan proteasas, enzimas que hidrolizan determinados enlaces peptídicos. x La tripsina hidroliza por la derecha de Arg , Lys x La quimotripsina hidroliza por la derecha de Phe, Trp, Tyr x La pepsina hidroliza por la izquierda de Phe, Trp, Tyr x La termolisina hidroliza por la izquierda de Val, Leu, Ile x El bromuro de cianógeno (BrCN) hidroliza por la derecha de la Met La secuenciación. Entre los distintos métodos existentes, podemos citar la degradación de Edman, cuyo fundamento hemos visto en la determinación del extremo N-terminal. La aplicación continuada de varios ciclos de la degradación de Edman me permite la secuenciación de todo el péptido, siempre que este no tenga más de 20 o 30 aminoácidos. No obstante los actúales requerimientos de secuenciación de gran cantidad de péptidos en poco tiempo, han dado origen al desarrollo de nuevos métodos de secuenciación, desarrollados principalmente para afrontar proyectos como el del proteoma humano. Entre estos métodos podemos citar el MALDI MS y el ESI MS, ambos basados en la espectrometría de masas. La espectrometría de masas permite calcular la masa del compuesto analizado con gran precisión. Esta técnica se basa en que la desviación que sufre una partícula cargada al atravesar un campo magnético depende básicamente de su carga y masa. Si ionizamos las moléculas, la mayoría con carga +1, y las sometemos a un barrido de campo magnético obtenemos un espectro de masas. Esta técnica se utilizaba con moléculas en fase gaseosa lo que impedía su aplicación a moléculas sensibles a la descomposición por calor o por los tratamientos tradicionales utilizados para pasar la muestra a fase gaseosa. En 1988 se desarrollaron dos técnicas que permiten evitar este problema. La espectrometría de masas da mucha información sobre la masa molecular, la presencia de cofactores, etc. Y además puede utilizarse para secuenciar pequeñas cadenas de polipéptidos, mediante una técnica conocida como tanden MS, que básicamente consiste en dos epectrometros de masas en serie. La proteína bajo
- 316. Tema 4. Aminoácidos y péptidos Bioquímica 62 estudio se trata con proteasas para obtener una mezcla de pequeños péptidos. En el primer espectrómetro la mezcla de péptidos se trata de forma que solo uno de los péptidos es seleccionado para su posterior análisis. El péptido seleccionado se fragmenta en la cámara de colisión que se encuentra entre los dos espectrómetros donde una pequeña cantidad de gas noble (He o Ar) produce la fragmetación del péptido preferentemente por los enlaces peptídicos, como la cámara está al vacío y no hay agua los productos son radicales. Los fragmentos son medidos en el segundo espectrómetro. En un especto típico los picos mayoritarios corresponden a radicales que difieren en la masa de un aminoácido particular. Así puede deducirse la secuencia. La única ambigüedad tiene lugar entre la leucina y la isoleucina que tienen la misma masa molecular. Este método es rápido, requiere sólo minúsculas cantidades de muestra que pueden ser extraídas de una electroforesis bidimensional. Las grandes compañías como Celera (participó en el proyecto genoma humano) disponen de sistemas automatizados en que una gran cantidad de proteínas se separan por electroforesis bidimensional o HPLC, cada punto puede ser luego secuenciado por un espectrómetro en tandem. Este método podría usarse también para la secuenciación de DNA, pero los métodos tradicionales son tan rápidos que no es rentable. La figura muestra un típico espectro realizado por espectrometría en tandem de un pequeño péptido de 10 aminácidos. La secuencia deducida de este péptido fue; Phe- Pro-Gly-Gln-(Ile/Leu)-Asn-Ala-Asp-(Ile/Leu)-Arg.
- 323. !
- 324. #
- 325. ! $
- 326. !%
- 327. ' %
- 328. #
- 329. # !
- 330. (
- 331. ! # )*
- 333. '
- 334. + , - .
- 335. # / !
- 336. 0 1 2 3
- 337. + '
- 338. !
- 339. !
- 340. 4
- 341. (
- 343. !
- 344. 4
- 345. ! 5 5
- 346. ! !
- 347. 0 #
- 349. $%
- 350. ' (
- 351. /
- 352. 6
- 353. ! 0 7 #( ' !
- 354. /
- 355. !
- 358. #
- 359. 0
- 360. #% 5
- 361. 5 ! !
- 362. 7 ))* (
- 363. 5
- 364. ( #
- 365. '
- 366. !
- 367. ! 7 !
- 368. 5
- 369. 7
- 372. 7 + :
- 373. !
- 374. /
- 376. ! ( /
- 377. /
- 378. :
- 379. /
- 380. /
- 382. 7 , +
- 383. #
- 385. 4 7 !
- 387. 5
- 388. !
- 389. #
- 391. #% #
- 392. ! (
- 393. /
- 394. #
- 395. 4
- 396. #
- 397. 7 -( %
- 399. #
- 400. # 7 ,* ( 5
- 402. !
- 403. !
- 404. %
- 406. 5
- 408. 0 !
- 409. !
- 410. ! 7 )*. (
- 411. ! !
- 413. '
- 414. - / #
- 415. :
- 417. *
- 418. !
- 419. # ! 5
- 420. 4
- 421. '
- 423. #
- 424. !
- 425. 0 !
- 426. #
- 427. 4
- 429. !
- 430. $7+--, !
- 431. $7.,; ( #
- 432. /
- 434. !
- 435. #
- 437. #
- 439. %
- 440. !
- 441. #
- 443. ;
- 444. #
- 446. Fórmula general de un amino-ácido. L-prolina; aminoácido polar no ionizable. Es el único aminoácido que no responde a la fórmula general. +--, ,. + , +--, ,. + ,
- 448. 1
- 449. %
- 450. #
- 452. $!
- 453. #
- 454. 4
- 455. ; $ !
- 456. $
- 457. ' ! 2 !
- 458. ,7
- 460. !
- 462. #
- 464. 5#
- 465. !
- 466. #
- 467. 4
- 468. #
- 469. $
- 470. 5
- 471. (
- 472. ;
- 473. 5# % ;
- 474. ' 5 5
- 476. ;
- 477. '
- 478. !
- 480. ;
- 481. ! ! (
- 482. /
- 483. 4
- 484. *
- 485. /
- 486. #
- 487. # 5# (
- 488. 5
- 489. /0 :5 ( ! , = ( ? 15 : '
- 490. $
- 491. 0# '
- 492. - / # '
- 493. 0 9
- 494. 0
- 495. *
- 496. '
- 498. ! ! 5
- 499. #
- 500. '
- 501. ! #
- 502. 5
- 503. # ! 9
- 504. 0
- 505. * +1* 1
- 507. 5
- 508. #
- 509. 5
- 510. $
- 511. 5
- 512. +
- 513. !
- 514. #
- 515. # ! L-leucina; aminoácido no polar. +--, ,;. + +,; +, , +,@ +,@ +--, ,;. + +,; +, , +,@ +,@ L-tirosina; aminoácido polar no ionizable. +--, ,;. + +,; , -, +--, ,;. + +,; , -, L-Glutámico; aminoácido polar ionizable ácido. +--, ,;. + +,; +,; +--, , +--, ,;. + +,; +,; +--, ,
- 516. L-Arginina; aminoácido polar ionizable básico. +--, ,;. + +,; +,; +--, , +--, ,;. + +,; +,; +--, ,
- 518. 9
- 519. 0
- 520. * 1 !
- 521. !
- 522. #
- 523. 4
- 524. '
- 525. , #
- 527. !
- 528. !
- 529. ! 7 9
- 530. =0
- 531. *1
- 533. !
- 534. '
- 535. !
- 536. ,
- 538. !
- 539. -
- 540. # '
- 541. - / # '4
- 542. !
- 544. #
- 546. $ #
- 548. (
- 549. 4
- 550. !
- 551. 0 6 ( .
- 553. 1
- 556. ( .
- 558. #
- 560. !
- 561. $ # #
- 562. !
- 563. # 4
- 565. 6 Ionización del grupo amino suplementario de un aminoácido polar ionizable ácido. Ionización del grupo amino suplementario de un aminoácido polar ionizable básico. ,2 , +--, ,;. + +,; +,; +,; +,; .,; , +--, ,;. + +,; +,; +,; +,; .,; , +--, ,;. + +,; +,; +,; +,; .,@ , +--, ,;. + +,; +,; +,; +,; .,@ , +--, ,;. + +,; +--, , +--, ,;. + +,; +--, , +--, ,;. + +,; +-- , +--, ,;. + +,; +-- , ,2 ,3 4 Asimetría de los aminoácidos. Todos los aminoácidos, excepto la glicocola, son asimétricos. De las dos formas, la D y la L, en los seres vivos sólo existe, normalmente, la L. , , ,2 , ,,2 (
- 566. 6
- 569. +--, ,;.7+7+,@ , +--, ,;.7+7+,@ , +--, ,;. + +,; +, , +,@ +,@ +--, ,;. + +,; +, , +,@ +,@ +--, ,;. + +, , +,@ +,@ +--, ,;. + +, , +,@ +,@ +--, ,;. + +, +,; , +,@ +,@ +--, ,;. + +, +,; , +,@ +,@ +--, ,;. + +,; , +--, ,;. + +,; , +--, ,;. + +,; +,; , +,@ +--, ,;. + +,; +,; , +,@ 7 ( 7( = 7=
- 570. 7 2 715 ?
- 571. 7?
- 572. *) 5*6 +--, ,. + , +--, ,. + , 1
- 573. 71
- 574. +--, ,;. + +,; , . , +--, ,;. + +,; , . , :
- 575. 7: +--, ,;. + +,; +--, , +--, ,;. + +,; +--, , +--, ,;. + +,; +,; +--, , +--, ,;. + +,; +,; +--, , +--, ,;. + +,; , . , . +--, ,;. + +,; , . , . +--, ,;. + +,; +,; +,; ., + .,; , ., +--, ,;. + +,; +,; +,; ., + .,; , ., +--, ,;. + +,; +,; +,; +,; .,; , +--, ,;. + +,; +,; +,; +,; .,; ,
- 576. *) 5*+1* 6
- 577. *) 7 5*+1* 16
- 578. 7 9
- 579. 79 , 7, ! 7 ! ( 7( 9
- 581. 79
- 582. *) 5*+1*6 +--, ,;. + , , +--, ,;. + , , +--, ,;. + +,; -, , +--, ,;. + +,; -, , +--, ,;. + +, +,@ , -, +--, ,;. + +, +,@ , -, +--, ,;. + +,; , -, +--, ,;. + +,; , -, +--, ,;. + +,; , , +--, ,;. + +,; +,;7+ , - .,; 7 :
- 583. 7: :
- 584. 7: ! 7 + 7+ +--, ,;. + +,; + , - .,; +--, ,;. + +,; + , - .,; 9 79
- 586. ' '
- 587. # +
- 588. !
- 590. !
- 592. #
- 593. *
- 594. ! ( 8
- 596. # ' '
- 597. # '
- 598. #
- 600. #
- 603. !
- 604. '
- 605. 5
- 606. # ! A
- 607. #
- 608. Reacción de formación del enlace peptídico. , . + + - , , , - , . + + - , , ; , - C , . + + , , - . + + - , , ; , - ,;-
- 609. ;
- 610. El enlace C-N se comporta como un doble enlace y no permite el giro.
- 612. ; (
- 613. D
- 614. 5
- 615. +7.
- 622. #
- 623. #
- 624. !
- 625. #
- 626. @ :
- 629. #
- 631. !
- 632. !
- 634. 9 # : ' 9 # ;
- 635. +
- 636. 8
- 637. #
- 638. !
- 640. !
- 641. #
- 642. 4
- 643. !
- 645. 8
- 646. *8 +
- 647. %
- 648. !
- 649. 4
- 650. ; 6
- 651. @ :
- 652. E - !
- 653. 1
- 654. 1
- 655. :
- 656. 4
- 658. !
- 659. # '
- 660. $,7 '
- 661. 4
- 662. # Características del enlace peptídico. Modelo de esferas de la insulina, un péptido.
- 664. !
- 665. #
- 666. 4
- 667. %
- 668. #
- 669. 4
- 670. $7-, :
- 671. ,7 7-, '
- 672. 0 ,797 71
- 673. 7( 7: 7? 7 7-, ? 5 !
- 674. F
- 675. 0 5
- 678. )* !
- 679. !
- 680. !
- 682. ; @
- 683. F * $)
- 684. #
- 686. 5
- 688. #
- 690. 5 0
- 691. 4
- 692. $G
- 693. %
- 694. F #
- 695. !
- 696. #
- 698. ! % %
- 699. $ -
- 700. 0 # '
- 702. (
- 704. (
- 706. 7
- 707. ,
- 709. #
- 710. / (
- 711. # 0 7
- 712. 6 7 ' % %
- 713. -
- 715. 7 =
- 716. )
- 717. !
- 718. = !
- 721. (
- 722. #
- 723. 7 La insulina, una hormona de carácter peptídico, está formada por dos cadenas polipeptídicas. Modelo de bolas de la ubicuitina, una proteína.
- 724. Modelo de barras y esferas de la oxitocina, una hormona peptídica.
- 726. #
- 727. ! !
- 728. !
- 729. +
- 731. #
- 732. / =
- 733. 0 ,7 797 7(7 7 7+7( 7? 7 7 7: 79771
- 734. 7 79 7-, 6 7 ' % %
- 735. %#
- 737. 7 (
- 738. # !
- 739. H 5 5
- 740. !
- 744. I '
- 746. !
- 747. 5
- 748. %
- 749. $
- 750. 5 ' 5 JEF 5
- 751. !
- 752. J@
- 754. I J;
- 755. 5
- 757. I
- 758. !
- 759. 6 ))8*
- 760. % '
- 761. 5
- 762. $
- 763. % 5 4
- 764. 5 @
- 765. '
- 767. ! / #
- 768. 7
- 769. 5 !
- 770. !
- 771. +J-
- 772. !
- 773. .7,
- 775. #
- 776. 5 16=
- 777. !
- 778. 7
- 779. / !7/! ( #
- 780. !
- 782. 1) Hélices alfa; 2) conformaciones beta; 3) enlaces de hidrógeno; 4) puentes disulfuro; 5) zonas irregulares. Hélice alfa. Mediante flechas se indican algunos enlaces de hidrógeno. R) restos de los aminoácidos. Modelo de cintas de la ubicuitina.
- 784. 6 # 5 !
- 785. !
- 786. +J- 7.7, (
- 787. 7
- 788. 5 # 5 #
- 789. .
- 791. #
- 792. 4
- 794. ! # / K
- 795. 4 7
- 798. (
- 800. 7
- 802. 5
- 805. I
- 807. + .)* 6 7 ' % %
- 809. 7 (
- 810. !
- 811. 5
- 812. (
- 813. !
- 814. ! #
- 816. 0
- 817. 5 !
- 818. ( # /
- 819. !
- 820. 0 '
- 821. 5 !
- 822. ;
- 823. # @ 1
- 824. '
- 825. %
- 826. !
- 827. 7 ,
- 828. 7+ 7 , C , 7+ 7 77777 7+ 7 7 7+ 7 Conformación beta o lámina plegada beta. En la figura se observan dos fragmentos de lámina plegada beta asociados por enlaces de hidrógeno. Estructura de una proteína. a) hélices alfa; b) conformaciones beta; c) zonas irregulares. Visión superior de una hélice alfa. Los números indican los aminoácidos.
- 830. '
- 831. '
- 832. 5
- 833. #
- 834. % 5
- 835. 5
- 836. 5 5 4
- 837. L !
- 838. 0 * .*1)* 5
- 840. (
- 843. # /
- 844. # !
- 845. 1
- 847. 0 # 7
- 848. !
- 849. (
- 852. !
- 853. #
- 854. # ! M
- 855. !
- 856. # /
- 857. # 5
- 858. (
- 859. !
- 860. # !
- 861. 75
- 863. #
- 865. #
- 866. 5
- 867. !
- 868. #
- 869. #
- 870. 5
- 871. 5 4
- 872. 5
- 873. #
- 874. #
- 875. 5
- 876. 5
- 877. #
- 878. 4
- 879. 76 % %
- 880. %
- 883. 7 +
- 884. !
- 887. !%
- 888. : #
- 891. '
- 892. ) +
- 894. !% %
- 896. 0 Estructura terciaria de una proteína. a) hélices alfa b) conformaciones beta; c) zonas irregulares.
- 897. Los anticuerpos tienen estructura cuaternaria pues están formados por la unión, mediante puentes disulfuro, de cuatro protómeros o dominios; dos de cadena larga y dos de cadena corta
- 899. (
- 900. ! 5 !
- 901. / = N
- 902. !%
- 903. K
- 904. 5
- 905. !
- 906. #
- 907. !
- 908. #
- 909. $
- 910. #
- 911. E
- 913. !
- 914. 5
- 915. -
- 916. #
- 917. ! #
- 918. # # '
- 919. (
- 920. !
- 924. 0 *)1* (
- 925. # !
- 928. +
- 930. !
- 934. !
- 936. (
- 937. 1
- 938. 4 '
- 939. ' / !
- 940. 5
- 941. #
- 942. /
- 943. 0 5
- 944. !
- 945. # ! ' 5
- 950. .
- 952. #
- 953. !
- 954. (1*
- 955. ?
- 956. (
- 957. #
- 958. #
- 959. # 5/
- 960. !
- 961. 1
- 962. 0 (
- 963. )
- 965. #
- 966. ; @
- 967. F
- 968. )
- 971. $
- 974. (
- 975. #
- 976. !
- 978. #
- 979. %
- 980. ' ?
- 981. 0# '
- 982. (
- 983. !
- 984. / $
- 985. F
- 986. )*+
- 987. ( /
- 988. #
- 989. #
- 990. 5 !
- 991. = N
- 992. # !
- 994. #
- 995. ! '
- 996. !
- 997. #
- 998. # ! /
- 999. A
- 1000. #
- 1001. !
- 1002. 1 4 / 4
- 1003. ! /
- 1004. $
- 1005. ! 5 5
- 1006. O O #
- 1007. '
- 1008. 0 '
- 1009. $ -
- 1010. 0'
- 1012. 7 #
- 1013. ## '
- 1014. (
- 1016. !
- 1017. 7 /
- 1018. /
- 1019. 0 (
- 1020. *) '
- 1021. %
- 1022. # /
- 1023. *. #
- 1024. ' !
- 1025. / '
- 1026. #
- 1027. !
- 1028. !
- 1029. !
- 1030. 7 !
- 1031. #
- 1035. !
- 1036. 7
- 1037. - # Variación de la actividad de una enzima con la temperatura. A partir de 45 C la enzima se desnaturaliza, por alterarse su conformación, y al destruirse el centro activo deja de actuar.
- 1038. (+ : Variación en la actividad de una enzima medida en función de la cantidad de substrato (ligando) transformado a 37oC. En t se ha aumentado la temperatura hasta 70o C. = /
- 1039. Diferencias en la estructura primaria de la insulina de diferentes vertebrados.
- 1040. ! #
- 1042. (
- 1043. #
- 1044. ! !
- 1045. /
- 1046. 4
- 1047. #
- 1049. 5
- 1051. !
- 1052. '
- 1054. 1
- 1055. !
- 1057. / # # #
- 1058. # / = N 5 !
- 1059. (
- 1061. 7
- 1062. #
- 1063. 5
- 1064. !
- 1065. # !
- 1066. 5
- 1068. +
- 1071. 5
- 1072. !
- 1073. #
- 1074. 4!
- 1075. 5
- 1076. $!#
- 1077. 5
- 1078. / +
- 1080. 5
- 1082. #
- 1083. /
- 1084. !
- 1086. # ( / #
- 1087. /
- 1089. B I O C A T A L I Z A D O R E S Clásicamente se han estudiado en este apartado tres grupos de sustancias con funciones muy importantes: enzimas, vitaminas y hormonas. De forma general, todas ellas tienen una función reguladora sobre los organismos. (En sentido estricto, sólo los enzimas son realmente biocatalizadores). ENZIMAS Concepto: Son los catalizadores de las reacciones bioquímicas, esto es, sustancias que favorecen dichas reacciones al disminuir la energía de activación (aquella que debemos suministrar a los reactivos para que se inicié una reacción química). Se trata de proteínas globulares que hacen posibles las reacciones bioquímicas, a una velocidad adecuada, en las condiciones de temperatura habituales en el interior de los seres vivos. Como todo catalizador, los enzimas no se consumen en el proceso por lo que se reutilizan, de ahí que se requieran en muy baja cantidad. Estructura Todos los enzimas son de naturaleza proteica y de tipo globular. (La única excepción a esta regla está representada por cierto tipo de ARN que presenta actividad enzimática). Puesto que son proteínas, los enzimas pueden pertenecer a uno de los dos tipos que hemos estudiado: - Proteínas puras (holoproteínas formadas sólo por aminoácidos). - Proteínas conjugadas (heteroproteínas), en cuyo caso están formadas por una fracción proteica (apoenzima) y otra fracción no proteica (cofactor). La unión apoenzima + cofactor origina el holoenzima, que es la molécula funcionalmente activa. 1. Apoenzima: Proteína globular que da al enzima su forma tridimensional, constituida por 3 clases de aminoácidos, desde el punto de vista funcional: - Aminoácidos estructurales: Dan la conformación espacial al enzima pero no intervienen de forma directa en la reacción. - Aminoácidos de fijación (~): Sobre sus radicales se adhiere el sustrato mediante enlaces no covalentes. (Sustrato es la sustancia sobre la cual actúa el enzima). - Aminoácidos catalizadores (~): Responsables directos de la reacción, desestabilizando los enlaces del sustrato (actúan en los casos en que no interviene un cofactor). ÷ (~) CENTRO ACTIVO.- Los aminoácidos de fijación y catalizadores constituyen el llamado CENTRO ACTIVO, una zona fundamental de toda enzima, en la cual se produce la reacción, tras un acoplamiento mutuo entre enzima y sustrato, a la manera de una mano y un guante (Este símil es conocido como “modelo del ajuste inducido” en el que el enzima cambia algo su conformación espacial al adaptarse a la forma del sustrato). NOTA: Es fundamental que el enzima mantenga su configuración espacial para que el sustrato encaje en el centro activo. Una subida de temperatura, cambio de pH o salinidad, etc. puede provocar la desnaturalización del enzima. La alteración de su estructura implica pérdida de funcionalidad.
- 1090. 2. Cofactor: Sustancia no proteica, de naturaleza química diversa, que se une al apoenzima para dar el holoenzima o molécula funcional. - Pueden ser sustancias de tipo catiónico: Ca , Mg , Mn , Cu , Zn . . .++ ++ ++ ++ ++ - Con frecuencia son moléculas orgánicas más o menos complejas, en cuyo caso se les llama coenzimas, en su mayoría son derivadas de las vitaminas, de ahí la importancia de éstas en nuestra dieta. Ejemplos de coenzimas son: NAD (derivado de la vitamina PP = Ac. nicotínico), el FAD (procedente de la vitamina 2B = riboflavina), Coenzima-A, el ATP , etc.V El coenzima se altera durante la reacción (ej. NAD ÷ NAD.2H), pero se regenera más tarde, en otros procesos. MECANISMO DE LAS REACCIONES ENZIMÁTICAS De forma muy esquemática se pueden resumir así: a- Formación del complejo enzima-sustrato: El sustrato, a veces más de uno, se adhiere al centro activo, por complementarse la forma de ambos, formando enlaces débiles con los radicales de los Aa de fijación. b- Transformación del sustrato.- Por acción de los Aa catalizadores, o del coenzima, según los casos, se inestabilizan los enlaces del sustrato y se efectúa la reacción, con un gran “abanico” de posibilidades, dependiendo del enzima y el sustrato en cuestión. El sustrato se transforma en producto. c- Se libera el producto, o productos, del centro activo y el enzima queda disponible para unirse a otras moléculas de sustrato e iniciar una nueva actuación.
- 1092. H O R M O N A S Introducción: SISTEMAS DE COORDINACIÓN EN ANIMALES La sensibilidad es una característica diferencial de los seres vivos. Consiste en captar estímulos del medio y elaborar respuestas adecuadas. Esto es mucho más complejo en animales que en vegetales, donde se requiere una coordinación adecuada entre todas las partes del organismo para que éste responda como una unidad ante el estímulo. Esta coordinación interna es realizada por dos sistemas muy relacionados: Sistema nervioso y sistema endocrino. ÷ Sistema nervioso, se caracteriza por: ÷ Sistema endocrino, se caracteriza por: - acción rápida - acción más lenta - actúa por impulsos eléctricos - actúa a través de mediadores químicos: hormonas transportadas - - efectos que duran poco tiempo - efectos más prolongados. [por la sangre. Ambos determinan el comportamiento global del organismo ante determinados estímulos, sus señales respectivas son recibidas, transcritas y obedecidas por los órganos correspondientes que, en consecuencia, desarrollan una respuesta ante el estímulo. Glándula: órgano especializado en segregar sustancias. Según su función se las clasifica en . . . - Exocrinas: De secreción externa, vierten sus productos al exterior o a cavidades comunicadas con él. Ej. Gl. Sudoríparas, sebáceas, lacrimales, etc... - Endocrinas: De secreción interna, vierten sus productos (hormonas) a la sangre, que las reparte por todo el organismo. - Mixtas: Son órganos que contienen los dos tipos de glándulas citadas anteriormente. Ej.- El páncreas cuyos acinos segregan jugo pancreático, mientras los islotes de Langerhans segregan insulina. Hormonas Son unas sustancias orgánicas de naturaleza diversa, generalmente esteroides o péptidos, elaboradas por glándulas endocrinas y vertidas a la sangre o líquido circulante. Ejercen una función coordinadora en el organismo actuando a modo de “mensajeros químicos”, sobre distintos órganos y tejidos modificando su actividad biológica. Las acciones pueden ser muy variadas: controlar el crecimiento, regular la composición del medio interno, modificar el metabolismo celular, regular ciclos reproductores . . . Órgano Diana: Cada hormona ejerce su acción sobre una zona concreta del organismo que se conoce como órgano diana, cuyas células están provistas de receptores para dicha hormona. Ej.- La oxitocina tiene como órgano diana el útero. Nota.- Aunque en los vegetales no se encuentran glándulas de este tipo (en sentido estricto), existen sustancias que actúan como mensajeros químicos entre diversos órganos que se consideran también como hormonas (fitohormonas, fito=planta). L Para el estudio de las hormonas se las suele agrupar según la glándula que las produce.- - HIPÓFISIS: La hipófisis es una glándula, de tamaño similar a un guisante, que tenemos en la base del cerebro (alojada en un hueco del hueso esfenoides, llamado 'silla turca) y se encuentra conectada con el hipotálamo, otra glándula también del cerebro. Entre sus hormonas citaremos . . . - Hormona del crecimiento, estimula el crecimiento de huesos y músculos sobre todo en etapas juveniles: Potencia la síntesis de proteínas, mitosis celulares, etc. Su déficit produce enanismo y su exceso, en etapas juveniles, provoca gigantismo.
- 1093. - Prolactina. Estimula la producción de leche en las glándulas mamarias después del parto. - Adiuretina o vasopresina (= H. Antidiurética = ADH). Estimula la retención de agua por el riñón, aumenta el volumen sanguíneo y, por tanto, aumenta la presión arterial. Cuando se ingiere una cierta cantidad de alcohol se suele orinar mucho porque éste inhibe a dicha hormona. - Oxitocina: Favorece las contracciones del útero durante el parto (hormona del “gotero”) - TIROIDES.- Está situado en el cuello, rodeado del primer cartílago de la traquea que es el que forma la nuez. Dentro de sus hormonas destacamos: - Tiroxina, principal hormona del tiroides, es la hormona del metabolismo: estimula la combustión de grasas y azúcares de todos los tejidos. Su déficit produce hipotiroidismo. El hipotiroideo es un propenso a la obesidad con un carácter aletargado (falta de actividad). - Calcitonina, disminuye la concentración de calcio en sangre incorporándolo a los huesos. Se administra con frecuencia a mujeres menopáusicas para frenar la osteoporosis. - GLÁNDULAS SUPRARRENALES (= adrenes): Situadas sobre los riñones. Producen hormonas como... - Adrenalina. Es la llamada hormona del susto o de la emoción, encargada de preparar al organismo para defenderse en situaciones de peligro: dilata la pupila, provoca la vasoconstricción cutánea y vasodilatación muscular, aumenta el ritmo cardiaco y respiratorio, dilatación bronquial, aumenta la glucosa en sangre, aumenta el catabolismo en general. - Corticoides. Unos tienen acción antiinflamatoria, otros actúan como anabolizantes, etc. - PÁNCREAS: Situado por debajo y detrás del estómago. Como ya se ha indicado, es una glándula mixta, es decir, presenta función exocrina segregando el jugo pancreático, producido por los acinos, y función endocrina a cargo de los islotes de Langerhans productores de . . . - Insulina: Reduce la glucemia favoreciendo la entrada de glucosa a las células. Su déficit produceV una enfermedad llamada Diabetes Mellitus caracterizada por altos niveles de glucosa en sangre, que se excreta en orina en la cual se detecta para su diagnóstico (no es habitual la glucosa en la orina). - Glucagón: Acción opuesta a la insulina, es decir, aumenta la glucemia liberando glucosa del hígado. - TESTÍCULOS: Producen andrógenos entre ellos la testosterona, que provoca la aparición de los caracteres masculinos secundarios (voz grave, barba, distribución del vello corporal, desarrollo de la musculatura, etc.) - OVARIOS: Producen estrógenos, que son los principales responsables de la aparición de los caracteres secundarios femeninos (voz aguda, distribución de las grasas). También producen progesterona, que actúa sobre el útero favoreciendo el embarazo, en general. VITAMINAS Concepto Son sustancias, de naturaleza química diversa, imprescindibles en la dieta, aunque en pequeñas cantidades, pues el organismo no puede producirlas a partir de otras sustancias. Sus funciones son variadas, buena parte de ellas actúan como coenzimas. Presentan la particularidad de ser sustancias lábiles, esto es, se alteran fácilmente por calor o almacena- miento prolongado. Para su estudio se las ha clasificado, atendiendo a su solubilidad, en liposolubles e hidrosolubles. ÷
- 1094. - 1 - CARBOHIDRATOS 1.-DEFINICIÓN Los carbohidratos son sustancias naturales compuestas de carbono, hidrógeno y oxígeno. Antiguamente se les conocía como “hidratos de carbono”. Cn(H2O)n C6H12O6 C6(H2O)6 D-glucose CHO CH2OH H OH OH H H OH H OH C C C C C CH2OH H OH OH H H OH H OH H O CHO C C C C CH2OH H OH OH H H OH H OH En la década de 1880 se reconoció que dicho concepto era erroneo, ya que los estudios estructurales de estos compuestos revelaron que no eran hidratos, pues no contenían moléculas intactas de agua. Además, otros compuestos naturales tenían fórmulas moleculares diferentes a las anteriores. CHO CH2 C C CH2OH H OH H OH CHO CH2 CH2OH H OH H OH 2-Desoxi-D-ribosa CHO CH2 C C CH2OH H OH H OH En la actualidad los carbohidratos se definen como aldehídos o cetonas polihidroxilados, o bien, derivados de ellos.
- 1095. - 2 - COOH C C C C CH2OH H OH OH H H OH H OH CHO CH2OH H OH H OH H OH D-ribosa D-Fructosa Ácido D-Glucónico CH2OH OH H H OH H OH O CH2OH Polihidroxi aldehido Polihidroxi cetona Polihidroxi ácido 2.- ORIGEN La glucosa es el carbohidrato más abundante en la naturaleza. También se le conoce como azúcar sanguinea, azúcar de uva, o dextrosa. Los animales obtienen glucosa al comer plantas o al comer alimentos que la contienen. Las plantas obtienen glucosa por un proceso llamado fotosíntesis. Glucosa Fotosíntesis C6H12O6 +6 CO2 6 H2O Energía+ + 6 O2 Oxidación Los mamíferos pueden convertir la sacarosa (azúcar de mesa), lactosa (azúcar de la leche), maltosa y almidón en glucosa, la cual es oxidada para obtener energía, o la almacenan como glicógeno (un polisacarido). Cuando el organismo necesita energía, el glicógeno es convertido de nuevo a glucosa. La glucosa puede convertirse a grasas, colesterol y otros esteroides, así como a proteínas. Las plantas convierten el exceso de glucosa en un polímero llamado almidón (el equivalente al glicógeno), o celulosa , el principal polímero estructural. CH3COGlucosa de la acetilcoenzima A Grupo acetilo Proteínas GrasasGlicógeno Almidón Celulosa Colesterol
- 1096. - 3 - 3.-CLASIFICACIÓN A) Monosacáridos o Azúcares Simples: no pueden ser hidrolizados a moléculas más pequeñas. CHO CH2OH H OH OH H H OH H OH CH2OH OH H H OH H OH O CH2OH CHO CH2OH H OH H OH H OH Aldosas CH2OH H OH H OH O CH2OH Cetosas D-Ribosa Una aldopentosa D-Glucosa Una aldohexosa D-Ribulosa Una cetopentosa D-Fructosa Una cetohexosa Azucares reductores El sufijo –osa se emplea en la nomenclatura sistemática de los carbohidratos para designar un azúcar reductor, que es un azúcar que contiene un grupo aldehído o un grupo α- hidroxicetona. PROBLEMA DE ESTUDIO No.1 Clasifica cada uno de los siguientes monosacáridos según el sistema de las aldosas y cetosas (aldohexosa, cetohexosa...etc.) (a) D-Manosa (b) D-Xilosa (c) D-Treosa (d) D-Gliceraldehido (c) D-Gulosa
- 1097. - 4 - B) Oligosacáridos (del griego oligo, pocos): Contienen de dos hasta diez unidades de monosacáridos. 1.-Disacáridos: producen dos moléculas de monosacáridos por hidrólisis. a) Reductores: reducen el Fehling, Benedic,o Tollens. b) No reductores: no reducen a los reactivos anteriores. 2. Trisacáridos: producen tres moléculas de monosácaridos por hidrólisis. 4. Tetra-.........Decasacáridos: producen cuatro........a diez moléculas de monosacáridos por hidrólisis C) Polisacáridos: producen más de diez moléculas de monosacáridos por hidrólisis. 1. Homopolisacáridos: producen un solo monosacárido por hidrólisis. 2. Heteropolisacáridos: producen más de una clase de monosacáridos por hidrólisis. 4.-PROYECCIONES DE FISCHER CHO H CH2OH OH CHO H CH2OH HO CHO H CH2OH OH CHO H CH2OHHO CHO H CH2OHHO Eje imaginario Proyección de Fischer (R)-Gliceraldehído Proyección de cuñas Hacia adelante del plano Hacia atrás del plano En el plano H OHH H OHOH HOH OH O CHO CH2OH OH OH HO OH H H H H CHO CH2 OH OH OH HO OH H H H HCH2 CH D-Glucosa (el grupo carbonilo en la parte superior)
- 1098. - 5 - Movimientos (a) Se puede girar 180º sobre el plano y se tiene la misma estructura. CHO H CH2 OH OH CHO H CH2OH OH CHO H CH2 OH CHO H CH2OH HO R R R HO R (b) Si se gira 90º se tiene una estructura diferente. CHO H CH2 OH OH CHO H OH CHO H OH CHO H CH2 OH OH R R R S Representación Incorrecta Representación Correcta HOCH2HOCH2 90o (c) Si se intercambian dos grupos se tiene el enantiómero. CHO H CH2OH OH CHOH OH CH2OHCH2OH CHOH OHCHO H CH2 OH OH R R SS PROBLEMA DE ESTUDIO No.2 ¿Cuáles de las siguientes proyecciones de Fischer del gliceraldehido representan al mismo enantiómero? A CH2OH H CHO HO B OH H CHO HOCH2 CH2OH H CHO HO C D CH2OH OH H CHO
- 1101. ! #$!#
- 1102. %#'(#!
- 1103. ! %**
- 1104. $
- 1105. ! % %!!%#
- 1106. % %$+# '
- 1108. ( '
- 1109. )* +
- 1110. ,
- 1111. -*, + . % %%# /
- 1114. % % %#%#%#
- 1115. % $! #%# ,# , 0
- 1116. 1
- 1117. -1 + $. 2
- 1118. ' /
- 1120. % $! #%# #,%#!%#! 3
- 1121. 4 5 Funciones de los lípidos en los seres vivos.
- 1122. -
- 1124. Modelo de esferas de un lípido, un acilglicérido.
- 1126. .
- 1127. 8 2 5 !
- 1128. 9:; +:;
- 1129. /# $
- 1130. #'#0
- 1131. .
- 1133. ! #'#
- 1134. #'# 0 = $ $
- 1135. '
- 1136. !
- 1138. 1
- 1139. $
- 1140. , %0!
- 1141. $
- 1142. #!%#
- 1143. #!%#
- 1144. 2
- 1145. Reacción de saponificación entre un ácido orgánico y el hidróxido sódico. ?,%0::; @ 9:; ?,%0::9 @ ;:
- 1147. '
- 1148. 2
- 1149. /
- 1150. %#2!(,# . #0%'#0$
- 1151. 2 +% . #0#'#0! 0 2 2
- 1152. -9:;. -+:;.
- 1153. /# -
- 1154. 2
- 1155. ,# $ +%
- 1156. # $ +%
- 1157. %# $ +% %$ +%
- 1158. ! $%##!%# $
- 1159. 5
- 1161. ,3
- 1162. 5
- 1163. 1) Acido graso saturado (ac. Palmítico) 2) ácido graso insaturado (ac. Oléico). Reacción de esterificación entre un ácido graso y un alcohol para dar un éster y agua. Reacción de formación de un triacilglicérido. 0::; 0::; 0::; 0::; 0::; 0::; 7
- 1164. ;:%0; ;:%0; ;:%0; 7
- 1165. ;:%0; ;:%0; ;:%0; 7
- 1166. ;:%0; ;:%0; ;:%0; ;:%0; ;:%0; ;:%0; @ 3 0:% 0:%:%0; :%0;0:% :%0; 3 0:% 0:%:%0; :%0;0:% :%0; A;:A;: ?,%0::; @ ;:0;%? ?,%0::%0;%? @ ;:
- 1168. .
- 1169. 4 .
- 1171. $
- 1172. 2
- 1173. 5 ! #
- 1174. #'6#
- 1175. 2
- 1176. ' $
- 1177. :;%
- 1178. 5 !'!0!
- 1179. 2
- 1180. '
- 1181. 2
- 1182. / B
- 1183. C
- 1184. -
- 1185. . 4
- 1186. $
- 1188. -.
- 1189. -#. $
- 1190. 2
- 1191. 2 2
- 1192. /
- 1193. 5
- 1194. $
- 1195. -
- 1196. .
- 1197. 5
- 1198. 0
- 1199. 2
- 1200. 5
- 1201. Las grasas animales y los aceites vegetales son mezclas complejas de acilglicéridos y otros lípidos. Monoacilglicérido. Las grasas que contienen ácidos grasos saturados son sólidas; pues sus componentes pueden empaquetarse más densamente, lo que aumenta el punto de fusión. 7 7 7 8 8 8 7 8 7 7 7 8 8 8 7 8
- 1203. 2
- 1205. $
- 1206. ## 2 /
- 1207. $
- 1208. 5
- 1209. 5
- 1210. =
- 1211. 2
- 1212. 1
- 1213. 2 5
- 1214. ''$ +%
- 1215. ! '$ ( 9 -
- 1216. D
- 1217. ''#(
- 1218. Saponificación de un triacilglicérido. 0::9 0::9 5
- 1219. 0::9 0::9 0::9 5
- 1220. 5
- 1221. 0::9 7
- 1222. ;:%0; ;:%0; ;:%0; 7
- 1223. ;:%0; ;:%0; ;:%0; ;:%0; ;:%0; ;:%0; @ 0:% 0:%:%0; :%0; 3 0:% :%0; A9:; Palmitato de miricilo, cera de abejas. -0,E. 2
- 1224. -0AF. $
- 1225. 4 - 5.
- 1227. 2 $ /
- 1228. $ 2
- 1229. -
- 1230. . 0 5
- 1231. -
- 1232. . : 5
- 1233. :
- 1234. ! ;=9 '$ +% 0
- 1235. =
- 1236. =
- 1237. 2
- 1238. 2
- 1239. $
- 1240. '$, #
- 1241. 4 .
- 1243. G
- 1245. - 5 .
- 1246. $
- 1247. 2
- 1248. Lecitina. X) Ácidos grasos. Y) Glicerina. Z) Ácido fosfórico. W) Colina. X y Y están unidos por enlaces éster; Y y Z, y Z y W lo están por enlaces éster fosfato. 0; 0 H:% : 0; :; 0 H:% : ;0H:H4H:H0;H0;H9H0;A : 0;A 0;A 0; 0 H:% : 0; :; 0 H:% : ;0H:H4H:H0;H0;H9H0;A : 0;A 0;A ? @ = A - . 2 - . Esfingonielina.
- 1251. -
- 1252. % 2
- 1253. %
- 1254. . 8 2
- 1255. 4 5 ! 2
- 1256. ' 2
- 1257. /
- 1258. 2 $
- 1259. )
- 1260. 5
- 1261. 1
- 1262. 1
- 1263. 4 0
- 1264. %
- 1266. ! 2 -
- 1267. .
- 1268. ! 2
- 1269. #'6# 2
- 1270. -2 .
- 1271. -2 .
- 1272. = ,I 0
- 1273. , # 2
- 1274. 2 2 2
- 1276. %
- 1277. ! ,## $
- 1278. 2
- 1279. 2
- 1280. 2 2 ' 4
- 1281. ##
- 1282. Monocapa y bicapa formada por un lípido anfipático. Esterano. Colesterol. Representación de un lípido anfipático.
- 1284. $
- 1285. 2
- 1286. 2
- 1287. 2
- 1288. ,#
- 1289. !
- 1291. $
- 1292. Micelas. Las membranas celulares están constituídas por bicapas lipídicas en la que se encuentran insertadas proteínas.
- 1294. B
- 1295. ! ! !
- 1296. !
- 1297. # !
- 1298. ! $
- 1299. %
- 1300. !$
- 1301. ! '
- 1302. !( )
- 1303. *
- 1304. +
- 1305. *
- 1306. , # - .
- 1307. -
- 1308. / !$
- 1309. + * '
- 1310. ! !! $. ) % !
- 1311. !
- 1313. /DV 9LWDPLQDV Enviado por Allison Aida Chilque Liñan | Comentar este trabajo | Ver trabajos relacionados ,QWURGXFFLyQ /DV YLWDPLQDV 9LWDPLQDV OLSRVROXEOHV 9LWDPLQD $ 9LWDPLQD ' 9LWDPLQD . 9LWDPLQD ( 9LWDPLQDV KLGURVROXEOHV 9LWDPLQD % $FLGR DVFyUELFR RQFOXVLRQHV 5HFRPHQGDFLRQHV %LEOLRJUDItD ,1752'8,Ï1 (Q HO ELRTXtPLFR LQJOpV ) +RSNLQV GHVFXEULy TXH ODV UDWDV VRPHWLGDV D XQD GLHWD GH SURGXFWRV SXULILFDGRV FRQWHQLHQGR WRGDV ODV VXVWDQFLDV FRQVLGHUDGDV KDVWD HVH PRPHQWR QHFHVDULDV SDUD OD QXWULFLyQ GHWHQtDQ VX SURFHVR GH FUHFLPLHQWR TXH VH YROYtD D LQLFLDU FXDQGR D ODV UDWDV VH OH VXPLQLVWUDED D GLDULR XQD SHTXHxD FDQWLGDG GH OHFKH IUHVFD (VWH RWURV H[SHULPHQWRV VLPLODUHV GHPRVWUDURQ OD H[LVWHQFLD HQ ORV DOLPHQWRV GH FLHUWDV VXVWDQFLDV RUJiQLFDV GHVFRQRFLGDV KDVWD HQWRQFHV LQGLVSHQVDEOHV SDUD HO GHVDUUROOR DQLPDO 6XVWDQFLDV D ODV TXH SRVWHULRUPHQWH HO ELRTXtPLFR )XQN SURSXVR GHQRPLQDU 9LWDPLQDV /DV YLWDPLQDV VRQ VXVWDQFLDV TXtPLFDV QR VLQWHWL]DEOHV SRU HO RUJDQLVPR VLQ HPEDUJR VRQ LQGLVSHQVDEOH SDUD OD YLGD OD VDOXG OD DFWLYLGDG ItVLFD FRWLGLDQD (V SRU HVWR TXH GHEHQ VHU DSRUWDGRV D WUDYpV GH OD DOLPHQWDFLyQ FRQ XQD GLHWD HTXLOLEUDGD DEXQGDQWHV HQ SURGXFWRV IUHVFRV QDWXUDOHV GLVSRQGUHPRV GH WRGDV ODV YLWDPLQDV QHFHVDULDV 6REUH WRGR FXDQGR QXHVWUD GLHWD FRQWLHQH DOLPHQWRV HQ
- 1314. HVWDGR FUXGR R QDWXUDO ODV YLWDPLQDV VH HQFXHQWUDQ HQ FDQWLGDGHV VXILFLHQWHV (Q WDQ VROR YHLQWH DxRV GH D
- 1315. VH LGHQWLILFDURQ WRGDV ODV YLWDPLQDV VH GHWHUPLQy VX HVWUXFWXUD TXtPLFD VH SURGXMHURQ GH IRUPD VLQWpWLFD HQ HO ODERUDWRULR VH HVWDEOHFLy VX SDSHO HQ ORV SURFHVRV QXWULWLYRV 9,7$0,1$6 6RQ FRPSXHVWRV KHWHURJpQHRV TXH QR SXHGHQ VHU VLQWHWL]DGRV SRU HO RUJDQLVPR SRU OR TXH pVWH QR SXHGH REWHQHUORV PiV TXH D WUDYpV GH OD LQJHVWLyQ GLUHFWD /DV YLWDPLQDV VRQ QXWULHQWHV HVHQFLDOHV LPSUHVFLQGLEOHV SDUD OD YLGD $FW~DQ FRPR FRHQ]LPDV JUXSRV SURVWpWLFRV GH ODV HQ]LPDV 6XV UHTXHULPLHQWRV QR VRQ PX DOWRV SHUR WDQWR VX GHIHFWR FRPR VX H[FHVR SXHGHQ SURGXFLU HQIHUPHGDGHV (VWDV PROpFXODV WLHQHQ ODV VLJXLHQWHV FDUDFWHUtVWLFDV • 6RQ FRPSXHVWRV RUJiQLFRV UHODWLYDPHQWH VHQFLOORV • 6RQ LQGLVSHQVDEOHV SDUD HO PDQWHQLPLHQWR GH OD YLGD DFWXDQGR FRPR FRHQ]LPDV HQ JUDQ FDQWLGDG GH UHDFFLRQHV ELRTXtPLFDV • 6RQ SURGXFLGDV JHQHUDOPHQWH SRU YHJHWDOHV /RV DQLPDOHV HQ HVSHFLDO HO KRPEUH QR VXHOHQ VLQWHWL]DUODV R VL OR KDFHQ HV HQ FDQWLGDGHV LQVXILFLHQWHV • 6RQ VXVWDQFLDV OiELOHV D TXH VH DOWHUDQ FRQ IDFLOLGDG R UHVLVWHQ PDO ORV FDPELRV GH WHPSHUDWXUD ORV DOPDFHQDPLHQWRV SURORQJDGRV /DV YLWDPLQDV VH GLYLGHQ HQ GRV JUDQGHV JUXSRV 9LWDPLQDV /LSRVROXEOHV 9LWDPLQDV +LGURVROXEOHV 9,7$0,1$6 /,3262/8%/(6 (Q HVWH JUXSR HQWUDQ ODV YLWDPLQDV $ ' ( . /DV PLVPDV VRQ VROXEOHV HQ ORV FXHUSRV JUDVRV VRQ SRFR DOWHUDEOHV HO RUJDQLVPR SXHGH DOPDFHQDUODV IiFLOPHQWH 'DGR TXH HO RUJDQLVPR SXHGH DOPDFHQDUODV FRPR UHVHUYD VX FDUHQFLD HVWDUtD EDVDGD HQ PDORV KiELWRV DOLPHQWDULRV 9,7$0,1$ $
- 1316. /D YLWDPLQD $ HV HO WpUPLQR TXH VH HPSOHD SDUD GHVFULELU ORV FRPSXHVWRV FRQ OD DFWLYLGDG ELROyJLFD GHO UHWLQRO (VWD YLWDPLQD HVWi SUHVHQWH HQ ORV DOLPHQWRV GH RULJHQ DQLPDO HQ IRUPD GH YLWDPLQD $ SUHIRUPDGD VH OD OODPD UHWLQRO PLHQWUDV TXH HQ ORV YHJHWDOHV DSDUHFH FRPR SURYLWDPLQD $ WDPELpQ FRQRFLGRV FRPR FDURWHQRV R FDURWHQRLGHV
- 1317. HQWUH ORV TXH VH GHVWDFD HO EHWD FDURWHQR /RV EHWD FDURWHQRV VRQ SLJPHQWRV QDWXUDOHV TXH VH SXHGHQ HQFRQWUDU HQ IUXWDV KRUWDOL]DV GH FRORU URMR QDUDQMD DPDULOOR R WDPELpQ HQ YHJHWDOHV YHUGHV RVFXURV (O EHWDFDURWHQR HV XQD IRUPD TXtPLFD UHTXHULGD SRU HO FXHUSR SDUD OD IRUPDFLyQ GH OD YLWDPLQD$ )XQFLRQHV GH OD YLWDPLQD $ HO UHWLQRO HQ HO RUJDQLVPR VLVWHPD yVHR 1HFHVDULD SDUD HO FUHFLPLHQWR GHVDUUROOR GH KXHVRV GHVDUUROOR FHOXODU HVHQFLDO SDUD HO FUHFLPLHQWR PDQWHQLPLHQWR UHSDUDFLyQ GH ODV FpOXODV GH ODV PXFRVDV HSLWHOLRV SLHO YLVLyQ XxDV FDEHOOR HVPDOWH GH GLHQWHV 6LVWHPD LQPXQH (VWLPXOD ODV IXQFLRQHV LQPXQHV HQWUH HOODV OD UHVSXHVWD GH ORV DQWLFXHUSRV OD DFWLYLGDG GH YDULDV FpOXODV SURGXFLGDV SRU OD PHGXOD yVHD TXH LQWHUYLHQH HQ OD GHIHQVD GHO RUJDQLVPR FRPR IDJRFLWRV OLQIRFLWRV 6LVWHPD UHSURGXFWLYR FRQWULEXH HQ OD IXQFLyQ QRUPDO GH UHSURGXFFLyQ FRQWULEXHQGR D OD SURGXFFLyQ GH HVSHUPD FRPR DVt WDPELpQ DO FLFOR QRUPDO UHSURGXFWLYR IHPHQLQR 9LVLyQ (V IXQGDPHQWDO SDUD OD YLVLyQ D TXH HO 5HWLQRO FRQWULEXH D PHMRUDU OD YLVLyQ QRFWXUQD SUHYLQLHQGR GH FLHUWDV DOWHUDFLRQHV YLVXDOHV FRPR FDWDUDWDV JODXFRPD SHUGLGD GH YLVLyQ FHJXHUD FUHSXVFXODU WDPELpQ DXGD D FRPEDWLU LQIHFFLRQHV EDFWHULDQDV FRPR FRQMXQWLYLWLV $QWLR[LGDQWH 3UHYLHQH HO HQYHMHFLPLHQWR FHOXODU OD DSDULFLyQ GH FiQFHU D TXH DO VHU XQ DQWLR[LGDQWH QDWXUDO HOLPLQD ORV UDGLFDOHV OLEUHV SURWHJH DO $'1 GH VX DFFLyQ PXWDJpQLFD 35,1,3$/(6 )8(17(6 '( 9,7$0,1$ $ )8(17( $1,0$/ ORV SURGXFWRV OiFWHRV OD HPD GH KXHYR HO DFHLWH GH KtJDGR GH SHVFDGR )8(17( 9(*(7$/ (Q WRGRV ORV YHJHWDOHV DPDULOORV D URMRV R YHUGHV RVFXURV ]DQDKRULD EDWDWD FDODED]D ]DSDOOR DMt HVSLQDFDV OHFKXJD EUyFROL FROHV GH %UXVHODV WRPDWH HVSiUUDJR
- 1318. )587$ 'XUD]QR PHOyQ SDSDD PDQJR '(),,(1,$ '( /$ 9,7$0,1$ $ /D FDUHQFLD GH YLWDPLQD $ WUDH DSDUHMDGR GLYHUVDV FRQVHFXHQFLDV HQWUD ODV TXH VH GHVWDFDQ • $OWHUDFLRQHV RFXODUHV 3XHGH RFDVLRQDU FHJXHUD FUHSXVFXODU QLFWDORSLD
- 1319. HV GHFLU GLVPLQXH OD DJXGH]D YLVXDO DO DQRFKHFHU VHQVLELOLGDG H[WUHPD D OD OX] FRPR DVt WDPELpQ UHVHFDPLHQWR RSDFLGDG GH OD FyUQHD FRQ SUHVHQFLD GH ~OFHUDV OODPDGR [HURIWDOPLD OD FXDO SXHGH FRQGXFLU D OD FHJXHUD • ,QPXQLGDG UHGXFLGD GHIHQVDV EDMDV
- 1320. $XPHQWD OD VXVFHSWLELOLGDG D LQIHFFLRQHV EDFWHULDQDV SDUDVLWDULDV R YLUDOHV D TXH OD YLWDPLQD $ FRQWULEXH DO PDQWHQLPLHQWR GH OD LQWHJULGDG GH ODV PXFRVDV $O FDUHFHU GH HOOD GHVDSDUHFH OD EDUUHUD FRQWUD ODV LQIHFFLRQHV • $OWHUDFLRQHV yVHDV ,QKLEH HO FUHFLPLHQWR GD PDOIRUPDFLRQHV HVTXHOpWLFDV DXPHQWD OD SUREDELOLGDG GH SDGHFHU GROHQFLDV HQ DUWLFXODFLRQHV GHELGR D TXH REVWDFXOL]D OD UHJHQHUDFLyQ yVHD • $OWHUDFLRQHV FXWiQHDV OD SLHO VH YXHOYH iVSHUD VHFD FRQ HVFDPDV SLHO GH JDOOLQD SLHO GH VDSR
- 1321. HO FDEHOOR VH WRUQD TXHEUDGL]R VHFR DO LJXDO TXH ODV XxDV • 2WURV DQVDQFLR JHQHUDO SpUGLGD GH DSHWLWR SpUGLGD GH SHVR DOWHUDFLyQ GH OD DXGLFLyQ JXVWR ROIDWR DOWHUDFLRQHV UHSURGXFWLYDV 72;,,'$' (IHFWRV Wy[LFRV GH XQD LQJHVWD H[FHVLYD GH YLWDPLQD $ /D KLSHUYLWDPLQRVLV $ VH UHILHUH D XQ GHSyVLWR DQRUPDO HQ HO RUJDQLVPR GH JUDQGHV FDQWLGDGHV GH YLWDPLQD $ UHWLQRO
- 1322. 1RUPDOPHQWH HVWD VH GD SRU OD LQJHVWD H[FHVLYD GH VXSOHPHQWRV YLWDPtQLFRV /RV VLJQRV VtQWRPDV GH WR[LFLGDG R KLSHUYLWDPLQRVLV SXHGHQ VHU • $QRUH[LD SpUGLGD GH SHVR YyPLWRV QDXVHD YLVLyQ ERUURVD LUULWDELOLGDG KHSDWRPHJDOLD DORSHFLD MDTXHFDV LQVRPQLR GHELOLGDG SRFD IXHU]D PXVFXODU DPHQRUUHD KLGURFHIDOLD H KLSHUWHQVLyQ FUDQHDQD HQ QLxRV
- 1323. • /RV ODELRV VHFRV TXHLOLWLV
- 1324. FRQVWLWXHQ XQ VLJQR WHPSUDQR FRP~Q VXFHGLGR GH OD VHTXHGDG GH OD PXFRVD QDVDO GH ORV RMRV /RV VLJQRV DQWHULRUHV FRQVLVWHQ HQ VHTXHGDG HULWHPD IRUPDFLyQ GH HVFDPDV GHVFDPDFLyQ GH OD SLHO SHUGLGD GH FDEHOOR IUDJLOLGDG GH ODV XxDV • 8Q VLJQR FDUHQWH GH SHOLJURVLGDG HV OD KLSHUFDURWHQRVLV (O FRQVXPR H[FHVLYR GH YHUGXUDV SXHGH SURGXFLUOR (O H[FHVR GH FDURWHQRV VH GHSRVLWD GHEDMR GH OD SLHO GDQGR XQ FRORU DPDULOOHQWR HQ SDOPD GH ODV PDQRV 9,7$0,1$ ' 6H HQFXHQWUD HQ GLVWLQWRV DOLPHQWRV HQ IRUPD GH µSUHFXUVRUHV¶ WDPELpQ SXHGH VHU SURGXFLGD SRU QXHVWUR RUJDQLVPR OXHJR GH OD H[SRVLFLyQ D ORV UDRV XOWUDYLROHWDV 89
- 1325. HPLWLGRV SRU HO VRO (VWD VtQWHVLV RFXUUH FRQYLUWLHQGR HO HUJRVWHURO GH OD SLHO HQ YLWDPLQD ' /RV SUHFXUVRUHV VRQ VXVWDQFLDV TXH DO VHU PHWDEROL]DGDV R SURFHVDGDV SRU HO RUJDQLVPR VH FRQYHUWLUiQ HQ YLWDPLQDV /D OX] VRODU HV XQD IXHQWH LPSRUWDQWH GH YLWDPLQD ' GDGR TXH ORV UDRV 89 GDQ LQLFLR D ODV VtQWHVLV GH YLWDPLQD ' HQ OD SLHO /D YLWDPLQD ' VH GHSRVLWD HQ HO KtJDGR FHUHEUR SLHO PDRUPHQWH HQ ORV KXHVRV )81,21(6 '( /$ 9,7$0,1$ ' )81,21(6 '( /$ 9,7$0,1$ ' (1 (/ 25*$1,602 VLVWHPD yVHR '(17$5,2 (O URO PiV LPSRUWDQWH GH HVWD YLWDPLQD HV PDQWHQHU ORV QLYHOHV GH FDOFLR IyVIRUR QRUPDOHV (VWLPXOD OD DEVRUFLyQ LQWHVWLQDO GH FDOFLR IyVIRUR VX UHDEVRUFLyQ HQ ORV ULxRQHV 5HJXOD HO PHWDEROLVPR GH HVWRV PLQHUDOHV ORV FXDOHV VRQ YLWDOHV SDUD HO FUHFLPLHQWR GHVDUUROOR QRUPDO GH KXHVRV GLHQWHV 6LVWHPD LQPXQH )RUWDOHFH DO VLVWHPD LQPXQH DXGDQGR D SUHYHQLU LQIHFFLRQHV 6LVWHPD 1(59,262 /RV QLYHOHV GH FDOFLR VRQ HVHQFLDOHV SDUD OD WUDQVPLVLyQ GHO LPSXOVR QHUYLRVR OD FRQWUDFFLyQ PXVFXODU /D YLWDPLQD ' DO UHJXODU ORV QLYHOHV GH FDOFLR HQ OD VDQJUH WLHQH XQ SDSHO LPSRUWDQWH HQ HO IXQFLRQDPLHQWR VDOXGDEOH GH QHUYLRV P~VFXORV /DV SULQFLSDOHV IXHQWHV QDWXUDOHV GH 9LWDPLQD ' )8(17( $1,0$/ /HFKH PDV DXQ VL HV IRUWLILFDGD FRQ YLWDPLQD '
- 1326. TXHVRV KXHYRV HPD
- 1327. PDQWHFD PDQWHTXLOOD PDUJDULQD DFHLWH GH
- 1328. KtJDGR GH SHVFDGRV SHVFDGRV JUDVRV VDOPyQ DW~Q DUHQTXH VDUGLQDVJHQHUDOPHQWH DOLPHQWRV DEXQGDQWHV HQ iFLGRV JUDVRV RPHJD
- 1329. )8(17( 9(*(7$/ (VWRV DOLPHQWRV FRQWLHQHQ FDQWLGDGHV GH YLWDPLQD ' PtQLPDV FDVL GHVSUHFLDEOHV 3RU HOOR PXFKRV FHUHDOHV HQYDVDGRV WLHQHQ YLWDPLQD ' DJUHJDGD SDUD FRQWUDUUHVWDU HVWD FDUHQFLD 'HILFLHQFLD GH YLWDPLQD ' /D GHILFLHQFLD GH YLWDPLQD ' FRQGXFH DO DXPHQWR HQ OD SURGXFFLyQ GH OD KRUPRQD SDUDWLURLGHD D OD UHPRFLyQ GH FDOFLR GH ORV KXHVRV /DV FRQVHFXHQFLDV GH OD FDUHQFLD GH HVWD YLWDPLQD VRQ 5DTXLWLVPR HQ QLxRV (O UDTXLWLVPR HV XQD HQIHUPHGDG yVHD FDUDFWHUL]DGD SRU OD PLQHUDOL]DFLyQ GHILFLHQWH GH OD PDWUL] yVHD RPR UHVXOWDGR ORV KXHVRV UHVXOWDQ EODQGRV FRQ PDOIRUPDFLRQHV VH FXUYDQ GHELGR D TXH QR VRSRUWDQ HO SHVR GHO RUJDQLVPR iQFHU (VWXGLRV HQ ODERUDWRULR FRQ DQLPDOHV VXJLHUHQ TXH OD YLWDPLQD ' WLHQH XQD IXQFLyQ SURWHFWRUD HQ FRQWUD GH FLHUWRV FiQFHUHV ORFDOL]DGRV HQ FRORQ SUyVWDWD PDPDV 3RU HOOR OD GHILFLHQFLD WUDHUtD PDRU ULHVJR GH DGTXLULUORV 'LDEHWHV /D GHILFLHQFLD GH YLWDPLQD ' LPSLGH HO PHWDEROLVPR GH OD JOXFRVD UHGXFLHQGR OD VHFUHFLyQ GH LQVXOLQD OR FXDO DXPHQWDUtD HO ULHJR GH SDGHFHU GLDEHWHV PHOOLWXV 3UREOHPDV FDUGLRYDVFXODUHV 1LYHOHV GHILFLHQWHV GH YLWDPLQD ' SRGUtDQ DXPHQWDU HO ULHVJR GH DUWHULRVFOHURVLV D TXH IDYRUHFH OD IRUPDFLyQ GH SODFDV GH FDOFLR HQ ODV DUWHULDV /D SUHVHQFLD GH HVWDV SODFDV SXHGH FRQGXFLU D XQ DWDTXH FDUGtDFR 7R[LFLGDG +LSHUFDOFHPLD 6H UHILHUH DO DXPHQWR GH ORV QLYHOHV GH FDOFLR HQ VDQJUH OR FXDO WUDH FRPR FRQVHFXHQFLD GLYHUVRV VtQWRPDV FRPR QiXVHD YyPLWRV DOWHUDFLRQHV PHQWDOHV FRQIXVLyQ SpUGLGD GH DSHWLWR SpUGLGD GH SHVR FRQVWLSDFLyQ GHELOLGDG GHSUHVLyQ GRORUHV DUWLFXODUHV PXVFXODUHV GRORUHV GH FDEH]D SROLXULD HPLVLyQ GH JUDQGHV FDQWLGDGHV GH RULQD
- 1330. PXFKD VHG FiOFXORV UHQDOHV DOFLQRVLV (V OD IRUPDFLyQ GH GHSyVLWR GH FDOFLR IRVIDWR HQ WHMLGRV EODQGRV SLHO ULxRQHV
- 1331. 1RUPDOPHQWH OD WR[LFLGDG FRQ YLWDPLQD ' VH GD FRPR FRQVHFXHQFLD GH OD LQJHVWD HOHYDGD GH VXSOHPHQWRV GH YLWDPLQD ' 3RU HOOR VH FXHQWD FRQ WDEODV GRQGH HVWD GHVLJQDGDV ODV FDQWLGDGHV Pi[LPDV WROHUDEOHV SRU QXHVWUR RUJDQLVPR SDUD TXH QR VH SURGX]FDQ HIHFWRV DGYHUVRV 9,7$0,1$ . 6RQ VXVWDQFLD WHUPRHVWDEOH GRWDGDV GH FRORU DPDULOOR TXH VH GHVWUXHQ SRU OD DFFLyQ GH ORV iOFDOLV GH OD OX] FXD IXQFLyQ ILVLROyJLFD FRQVLVWH HQ IDYRUHFHU OD VtQWHVLV KHSiWLFD GH OD SURWURPELQD VLQ FXD SUHVHQFLD OD VDQJUH QR VH FRDJXOD / D YLWDPLQD IXH GHVFXELHUWD HQ SRU 'DP HQ RSHQKDJXH FRPR XQ IDFWRU TXH HYLWDED OD KHPRUUDJLD JUDYH HQ DQLPDOHV DOLPHQWDGRV FRQ GLHWDV OLEUHV GH JUDVD $O IDFWRU VH OH GHQRPLQR .RDJXODWLRQVYLWDPLQ GH DKt SURYLHQH HO WHUPLQR GH YLWDPLQD )81,21(6 Ⴠ6X SULQFLSDO IXQFLyQ HV SDUWLFLSDU HQ OD FRDJXODFLyQ GH OD VDQJUH Ⴠ6X DFFLyQ SUHYLHQH ODV KHPRUUDJLDV LQWHUQDV RODERUD HQ HO PHWDEROLVPR GH ORV KXHVRV '(),,(1,$ /R FLHUWR HV TXH HO RUJDQLVPR QHFHVLWD FDQWLGDGHV PX SHTXHxDV GH YLWDPLQD . SRU OR TXH UHVXOWD GLItFLO GHWHFWDU VX FDUHQFLD ‡ DXVD KHPRUUDJLD ‡ 3XHGH RFDVLRQDU KLSRSURWURPELQHPLD TXH VH PDQLILHVWD FRPR XQ WLHPSR GH FRDJXODFLyQ SURORQJDGR 9,7$0,1$ ( 1HFHVDULR SDUD HYLWDU OD PXHUWH IHWDO OD UHVRUFLyQ GH URHGRUHV (Q OD DFWXDOLGDG VH UHFRQRFH TXH OD YLWDPLQD GHVHPSHxD XQ SDSHO IXQGDPHQWDO HQ HO PHWDEROLVPR QRUPDO GH WRGDV ODV FpOXODV )81,21(6 /D YLWDPLQD ( HV HO DQWLR[LGDQWH OLSRVROXEOH PiV LPSRUWDQWH Ⴠ (V XQ FRPSRQHQWH LPSRUWDQWH GHO VLVWHPD GH GHIHQVD DQWLR[LGDQWH GH ODV FpOXODV
- 1332. Ⴠ 0DQWHQLPLHQWR GH XQ IXQFLRQDOLVPR QRUPDO GH OD SODFHQWD GH ORV RYDULRV GH ORV WHVWtFXORV DVt FRPR GH ORV P~VFXORV /2$/,=$,21 $FHLWHV GH VHPLOODV JHUPHQ GH WULJR YHUGXUDV HVFDUROD '(),,(1,$ 6H KD FRPSUREDGR HQ URHGRUHV TXH VX GHILFLHQFLD SURGXFH DGHPiV GH HVWHULOLGDG SDUiOLVLV GLVWURILD PXVFXODU 9,7$0,1$6 +,'5262/8%/(6 RQIRUPDGD SRU ODV YLWDPLQDV % FRPR WDPELpQ SRU OD 'HQWUR GH HVWH JUXSR GH YLWDPLQDV ODV UHVHUYDV HQ HO RUJDQLVPR QR UHYLVWHQ LPSRUWDQFLD SRU OR TXH OD DOLPHQWDFLyQ GLDULD GHEH DSRUWDU FXEULU GLDULDPHQWH ODV QHFHVLGDGHV YLWDPtQLFDV (VWR VH GHEH MXVWDPHQWH D TXH DO VHU KLGURVROXEOHV VX DOPDFHQDPLHQWR HV PtQLPR /D QHFHVLGDG GH YLWDPLQDV KLGURVROXEOHV GHEH VLHPSUH WHQHU HQ FXHQWD HO QLYHO GH DFWLYLGDG ItVLFD GHO LQGLYLGXR GDGR TXH HO HMHUFLFLR DFWLYD QXPHURVDV UHDFFLRQHV PHWDEyOLFDV FXDV YLWDPLQDV VRQ ODV FRHQ]LPDV $Vt VH OOHJD D XQD VLWXDFLyQ HQ OD TXH SDUD ODV DFWLYLGDGHV ItVLFDV LQWHQVDV H[LVWHQ ULHVJRV GH FDUHQFLDV SRU WDQWR DSDUHFHQ ORV VXSOHPHQWRV 9,7$0,1$ % /DV 9LWDPLQDV % DEDUFDQ XQ JUDQ Q~PHUR GH VXVWDQFLDV TXH WRPDQ SDUWH HQ HO PHWDEROLVPR GH WRGDV ODV FpOXODV YLYDV $FWXDQGR FRPR FRHQ]LPDV WUDEDMDQ FRQMXQWDPHQWH FRQ ODV SURWHtQDV HQ YDULRV GH ORV VLVWHPDV HQ]LPiWLFRV GH QXHVWUR RUJDQLVPR Ⴠ /DV IXQFLRQHV GH OD 9LWDPLQD % VRQ FLHUWDPHQWH VLQpUJLFDV GHELGR D HVWDV LQWHUUHODFLRQHV XQ FRQVXPR GHILFLWDULR GH XQD R PiV GH HOODV SXHGH FDXVDU GHILFLHQFLDV HQ ORV UHVWDQWHV REVWDFXOL]DQGR VX XWLOL]DFLyQ Ⴠ /DV 9LWDPLQDV % VRQ KLGURVROXEOHV QR VRQ DOPDFHQDGDV HQ HO FXHUSR 'HEHQ VHU UHHPSOD]DGDV GLDULDPHQWH FXDOTXLHU H[FHVR HV HOLPLQDGR $ FRQWLQXDFLyQ PHQFLRQDUHPRV ODV PiV LPSRUWDQWHV 9,7$0,1$ %
- 1333. )XH XQD GH ODV SULPHUDV YLWDPLQDV HQ GLOXFLGDUVH FRQRFLGD FRPR WLDPLQD WDPELpQ FRPR FRFDUER[LODVD OD FXDO VLUYH GH FRHQ]LPD HQ HO PHWDEROLVPR HQHUJpWLFR HQ OD VtQWHVLV GH SHQWRVDV /D WLDPLQD LQWHUYLHQH HQ OD WUDQVPLVLyQ QHUYLRVD GHVHPSHxD IXQFLRQHV PHWDEyOLFDV IXQGDPHQWDOHV HQ HO PHWDEROLVPR GH ORV FDUERKLGUDWRV HO IXQFLRQDPLHQWR QHXURQDO )8(17(6 0XFKRV GH ORV DOLPHQWRV OD SRVHHQ SHUR HQ EDMDV FRQFHQWUDFLRQHV /DV IXHQWHV PiV DEXQGDQWHV VRQ ORV KRQJRV HO KtJDGR SHUR VRQ ORV JUDQRV GH ORV FHUHDOHV OD IXHQWH PiV LPSRUWDQWH GH HVWD YLWDPLQD QHFHVDULDV HQ OD GLHWD KXPDQD '(),,(1,$ Ⴠ 6H FDUDFWHUL]D SRU DQRUH[LD SHUGLGD GH SHVR SRU VLJQRV FDUGLDFRV QHXUROyJLFRV Ⴠ 6H SXHGH PDQLIHVWDU HO EHULEHUL XQD HQIHUPHGDG TXH VH FDUDFWHUL]D SRU OD SDUiOLVLV DWURILD PXVFXODU LQIODPDFLyQ GHO FRUD]yQ FDODPEUHV HQ ODV SLHUQDV H LQFOXVR SXHGH OOHJDUD FDXVDU OD PXHUWH 72;,,'$' (Q DOWDV FRQFHQWUDFLRQHV HQ HO RUJDQLVPR SXHGHQ SURGXFLU FHIDOHDV FRQYXOVLRQHV GHELOLGDG PXVFXODU DUULWPLD FDUGLDFD UHDFFLRQHV DOpUJLFDV $,'2 3$1727(1,2 $QWHULRUPHQWH VXSXHVWR FRPR YLWDPLQD % HO iFLGR SDQWRWpQLFR (VWH FRPSXHVWR QR VH HQFXHQWUD HQ QLQJ~Q DOLPHQWR GH RULJHQ YHJHWDO VLHQGR IDFWLEOH GH DGPLQLVWUDU PHGLDQWH HO FRQVXPR GH FDUQHV KtJDGR ULxyQ OiFWHRV KXHYRV GH DYH FRPR WDPELpQ GH SHVFDGR )81,21(6 • *UDFLDV D OD YLWDPLQD % VH IRUPD OD KHPRJORELQD SURWHtQD IRUPDGD SRU KLHUUR TXH FRQWLHQHQ ORV JOyEXORV URMRV GH OD VDQJUH • (VWLPXOD UHJHQHUD HO FUHFLPLHQWR GH SLHO PXFRVDV XxDV • $XGD DO VLVWHPD LQPXQLWDULR D GHIHQGHUVH IUHQWH D ODV DJUHVLRQHV H[WHUQDV VX GpILFLW GLVPLQXH OD FDSDFLGDG GH UHVLVWHQFLD D ODV LQIHFFLRQHV '(),,7
- 1334. 6X DXVHQFLD JHQHUD XQD GLVPLQXFLyQ HQ ODV GHIHQVDV DQWH FDVRV GH LQIHFFLRQHV KHPRUUDJLDV GHELOLGDG PDUHRV )8(17(6 )8(17( $1,0$/ +XHYRV VDOPyQ )8(17( 9(*(7$/ FROLIORU UHSROOR EUpFRO JXLVDQWHV SDWDWDV WRPDWHV SLPLHQWRV DSLR ]DQDKRULD DUUR] LQWHJUDO FRSRV GH DYHQD QXHFHV PLHO 203/(0(1726 ',(7Ê7,26 21 0$25 5,48(=$ (1 È,'2 3$1727e1,2 MDOHD UHDO OHYDGXUD GH FHUYH]D VDOYDGR GH WULJR 3URSyOHR HO JHUPHQ GH WULJR 9,7$0,1$ % (VWD YLWDPLQD KLGURVROXEOH HV WDPELpQ FRQRFLGD FRPR SLULGR[LQD )81,21(6 Ⴠ 6tQWHVLV GH SURWHtQDV JUDVDV Ⴠ )RUPDFLyQ GH JOyEXORV URMRV FpOXODV VDQJXtQHDV KRUPRQDVVHURWRQLQD PHODWRQLQD GRSDPLQD
- 1335. Ⴠ 3DUWLFLSD GH OD SURGXFFLyQ GH DQWLFXHUSRV Ⴠ $XGD DO PDQWHQLPLHQWR GHO HTXLOLEULR GH VRGLR SRWDVLR HQ HO RUJDQLVPR /2$/,=$,21 /D HPD GH KXHYRV ODV FDUQHV HO KtJDGR HO ULxyQ ORV SHVFDGRV ORV OiFWHRV JUDQRV LQWHJUDOHV OHYDGXUDV IUXWDV VHFDV ODV SDSDV ORV SOiWDQRV ORV FHUHDOHV GH VDOYDGR SDVDV ODV OHQWHMDV HO SDYR HO DW~Q '(),,(1,$ 6X FDUHQFLD HV PX UDUD GDGD VX DEXQGDQFLD SHUR VX FDUHQFLD VH SXHGH YHU UHIOHMDGD HQ DQHPLD DFRPSDxDGD GH DOWHUDFLRQHV GH VXHxR LUULWDELOLGDG SRVLEOHV WUDQVWRUQRV PHQWDOHV 72;,,'$' (V UHODWLYDPHQWH EDMD SHUR ODV GRVLV DJXGDV HV GHFLU ORV FRQVXPRV GH GHPDVLDGRV JUDPRV SRU GtD KDQ SURGXFLGR QHXURSDWtD VHQVRULDO TXH VH FDUDFWHUL]D SRU FDPELRV HQ OD PDUFKD 9,7$0,1$ %
- 1336. (V HO ~QLFR FRPSXHVWR TXH FRQWLHQH FREDOWR TXH VH KD HQFRQWUDGR HQ XQ WHMLGR YLYR (VWD HV HVHQFLDO SDUD OD VtQWHVLV GH OD KHPRJORELQD OD HODERUDFLyQ GH FpOXODV FRPR WDPELpQ SDUD HO EXHQ HVWDGR GHO VLVWHPD QHUYLRVR )8(17(6 (Q HO VHU KXPDQR OD YLWDPLQD % VLQWHWL]DGD HQ HO FRORQ ~OWLPD SRUFLyQ GHO LQWHVWLQR JUXHVR
- 1337. QR HVWi GLVSRQLEOH SDUD VX DEVRUFLyQ SRU OR TXH HO UHTXHULPLHQWR QXWULFLRQDO GLDULR GHEH REWHQHUVH GH VXESURGXFWRV DQLPDOHV HQ OD GLHWD 3XHGH HQFRQWUDUVH HQ IXHQWHV DQLPDOHV GDGR TXH D KD VLGR VLQWHWL]DGD 3RU HOOR DSDUHFH HQ FDUQHV KtJDGR ULxyQ OiFWHRV )81,Ñ1 5HVXOWD LQGLVSHQVDEOH SDUD OD IRUPDFLyQ GH JOyEXORV URMRV SDUD HO FUHFLPLHQWR FRUSRUDO OD UHJHQHUDFLyQ GH ORV WHMLGRV '(),,(1,$ 'HELGR D TXH HO FXHUSR WLHQH OD FDSDFLGDG GH DOPDFHQDU JUDQGHV FDQWLGDGHV GH YLWDPLQD % VX GHILFLHQFLD QXWULFLRQDO HV VXPDPHQWH UDUD /RV EDMRV QLYHOHV GH YLWDPLQD % SXHGHQ FDXVDU DQHPLD GHQRPLQDGD SHUQLFLRVD È,'2 )Ï/,2 $QWHULRUPHQWH FRQRFLGR FRPR YLWDPLQD % (O iFLGR IyOLFR WUDEDMD MXQWR FRQ OD YLWDPLQD % OD YLWDPLQD SDUD DXGDU DO FXHUSR D GLJHULU XWLOL]DU ODV SURWHtQDV VLQWHWL]DU ODV SURWHtQDV QXHYDV FXDQGR VH QHFHVLWHQ (V QHFHVDULR HQ OD SURGXFFLyQ GH JOyEXORV URMRV $GHPiV DXGD D LQFUHPHQWDU HO DSHWLWR FXDQGR HV QHFHVDULR HVWLPXOD OD IRUPDFLyQ GH iFLGRV GLJHVWLYRV )8(17(6 (O iFLGR IyOLFR VH SXHGH REWHQHU GH FDUQHV UHV FHUGR FDEUD HWF
- 1338. GHO KtJDGR FRPR DVt WDPELpQ GH YHUGXUDV YHUGHV RVFXUDV HVSLQDFDV HVSDUUDJRV UDGLFFLR HWF
- 1339. FHUHDOHV LQWHJUDOHV WULJR DUUR] PDL] HWF
- 1340. WDPELpQ GH SDSDV '(),,(1,$ /D GHILFLHQFLD GH iFLGR IyOLFR SXHGH FDXVDU UHWUDVR HQ HO FUHFLPLHQWR HQFDQHFLPLHQWR GHO FDEHOOR LQIODPDFLyQ GH OD OHQJXD JORVLWLV
- 1341. ~OFHUDV EXFDOHV ~OFHUD SpSWLFD GLDUUHD 7DPELpQ SXHGH OOHYDU D FLHUWRV WLSRV GH DQHPLDV
- 1342. 8QD FDQWLGDG DGHFXDGD GH iFLGR IyOLFR HV LPSRUWDQWH SDUD ODV PXMHUHV HQ HGDG IpUWLO D TXH VH KD GHPRVWUDGR TXH SUHYLHQH DOJXQRV GHIHFWRV GH QDFLPLHQWR HQWUH HOORV ORV GHIHFWRV GHO WXER QHXUDO FRPR OD HVSLQD EtILGD 72;,,'$' /RV H[FHVRV QR SDUHFHQ GHPRVWUDU HIHFWRV DGYHUVRV DQWH VX DSDULFLyQ GDGD VX KLGURVROXELOLGDG VX H[FHGHQWH HV HOLPLQDGR SRU YtD XULQDULD È,'2 $6Ï5%,2 /D YLWDPLQD WDPELpQ OODPDGD iFLGR DVFyUELFR R IDFWRU DQWLHVFRUE~WLFR IXH DLVODGD SRU SULPHUD YH] GH ODV DGUHQDOHV ODV QDUDQMDV HO UHSROOR (O iFLGR DVFyUELFR QR HV VLQWHWL]DEOH SRU HO RUJDQLVPR SRU OR TXH VH GHEH LQJHULU GHVGH ORV DOLPHQWRV TXH OR SURSRUFLRQDQ 9HJHWDOHV YHUGHV IUXWDV FtWULFDV SDSDV /D YLWDPLQD VH R[LGD UiSLGDPHQWH SRU WDQWR UHTXLHUH GH FXLGDGRV DO PRPHQWR GH H[SRQHUOD DO DLUH FDORU DJXD 3RU WDQWR FXDQWR PHQRV FDORU VH DSOLTXH PHQRU VHUi OD SpUGLGD GH FRQWHQLGR (Q ORV MXJRV OD R[LGDFLyQ DIHFWD SRU H[SRVLFLyQ SURORQJDGD FRQ HO DLUH SRU QR FRQVHUYDUORV HQ UHFLSLHQWHV RVFXURV )XQFLyQ ELROyJLFD /D YLWDPLQD DXGD DO GHVDUUROOR GH GLHQWHV HQFtDV KXHVRV D OD DEVRUFLyQ GHO KLHUUR DO FUHFLPLHQWR UHSDUDFLyQ GHO WHMLGR FRQHFWLYR QRUPDO D OD SURGXFFLyQ GH FROiJHQR 'HILFLHQFLD /D GHILFLHQFLD GH YLWDPLQD SURGXFH HO HVFRUEXWR TXH HQ ORV DGXOWRV VH PDQLILHVWD D ORV GtDV GH PDQWHQLPLHQWR GH XQD GLHWD H[HQWD GH YLWDPLQD (Q ORV QLxRV HVWH VtQGURPH GH GHQRPLQD HQIHUPHGDG GH 0RHOOHU%DUORZ 7R[LFLGDG /RV ~QLFRV HIHFWRV DGYHUVRV TXH VH SXHGHQ SURGXFLU GHVSXpV GH GRVLV DOWDV GH YLWDPLQD VRQ GLDUUHD PROHVWLDV JDVWURLQWHVWLQDOHV 21/86,21(6 /DV YLWDPLQDV VRQ HVHQFLDOHV QHFHVDULDV SDUD TXH HO FXHUSR UHDOLFH PXFKDV GH VXV IXQFLRQHV FRQVHUYH VX VDOXG D TXH WDQWR VXV
- 1343. GHILFLHQFLDV FRPR VXV H[FHVRV SXHGHQ SURGXFLU GLYHUVDV HQIHUPHGDGHV 6LQ HOODV HO RUJDQLVPR QR HV FDSD] GH DSURYHFKDU ORV HOHPHQWRV HQHUJpWLFRV SURSRUFLRQDGRV SRU ORV DOLPHQWRV (O JUXSR TXH FRQWLHQH PDRU FDQWLGDG GH YLWDPLQDV OR LQWHJUDQ ODV IUXWDV YHUGXUDV 5(20(1'$,21(6 D TXH ODV YLWDPLQDV QR VRQ VLQWHWL]DGDV HQ HO FXHUSR KXPDQR VH UHFRPLHQGD OOHYDU XQD GLHWD HTXLOLEUDGD DEXQGDQWH HQ SURGXFWRV IUHVFRV QDWXUDOHV $Vt PLVPRV VH VXJLHUH HYLWDU HO FRQVXPR GH WDEDFR DOFRKRO R GURJDV D TXH OHMRV GH FDXVDU DOJ~Q EHQHILFLR HQ JHQHUDO SURYRFDQ XQ PDRU JDVWR GH YLWDPLQDV %,%/,2*5$)Ë$ .5$86( 0(1'(/621 0DULH 1875,,Ñ1 ',(727(5$3,$ (GLFLzQ
- 1344. 0 *5$: +,//,17(5$0(5,$1$ (',725(6 6$ KWWSZZZRXQJZRPHQVKHDOWKRUJVSIROLFDFLGKWPO KWWSZZZOHQQWHFKFRPHVSDQRO9LWDPLQDVIRODWRKWP $/9(7 )HUQDQGR %,248,0,$ 3$5$ 0e',26 48Î0,26 )$50$(87,26
- 1345. (GLWRULDO $ODPEUD 6$ KWWSZZZ]RQDGLHWFRPQXWULFLRQYLWDPLQDVKWP 0,//(5 .($1( 'LFFLRQDULR HQFLFORSpGLFR GH HQIHUPHUtD (GLWRULDO 0pGLFD 3DQDPHULFDQD KWWSZZZELRSVLFRORJLDQHWILFKDVSDJHBKWPO KWWSZZZHQEXHQDVPDQRVFRPDUWLFXORVPXHVWUDDVSDUW *5$11(5 0$(6 0855$ 52':(// %LRTXtPLFD GH +DUSHU (GLWRULDO (O 0DQXDO PRGHUQR 6$ (1752 35( 81,9(56,7$5,2 81060 %,2/2*Ë$ $OOLVRQ $LGD KLOTXH /LxDQ DOOLVRQFBDUURED@KRWPDLOFRP %,2*5$)Ë$
- 1346. La Célula: estructura interna y metabolismo Definición de la célula La célula se entiende como la unidad mínima de un organismo capaz de actuar de manera autónoma en su funcionamiento y reproducción. En consecuencia en el interior de las células se producen numerosas reacciones químicas que las permiten crecer, reproducirse, producir energía y eliminar residuos. El conjunto de estas acciones se llama metabolismo. Todos los seres vivos están constituidos por una célula o por un número muy variable de ellas que actúan en funcionamiento conjunto. Las diferencias entre los seres vivos, surgen de la organización y complejidad de las células de cada uno, del medio en que se desarrollan y del papel que cumplen en el equilibrio natural. En general, podemos clasificar los seres vivos en: Unicelulares: son aquellos constituidos por una única célula querealiza todas lasfunciones, por lo que son muy elementales como por ejemplo algunas algas. Pluricelulares: formado por un conjunto organizado de células que se especializan en una función, forman entidades superiores como tejidos, órganos, etcétera. A esta categoría pertenecen la mayoría de los seres vivos. Para saber más Célula: una definición. Este documento ofrece una sencilla definición del concepto de célula y aborda la teoría celular. Realiza las actividades de autocomprobación. http://recursos.cnice.mec.es/biosfera/alumno/3ESO/seruni- pluricelulares/contenidos3.htm [versión en caché] Célula: su descubrimiento Este artículo aborda de forma sencilla, el descubrimiento de la célula y aquellos personajes históricos responsables de ello. http://icarito.latercera.cl/icarito/2002/851/pag4.htm Área de Ciencias Naturales - Módulo III La Célula: estructura interna y metabolismo
- 1347. La Célula: estructura interna y metabolismo Tipos de células De acuerdo con su estructura, las células pueden ser: Procariotas, cuando carecen de núcleo, estando su ADN disperso en el citoplasma, como ocurre en las bacterias y cianofíceas. Eucariotas, que son las que poseen un verdadero núcleo, conteniendo el ADN, protegido por la envoltura nuclear. Son las células de animales, plantas, hongos y protoctistas (organismos unicelulares). Los virus son organismos acelulares, necesitando la presencia de una célula para poder desarrollar su actividad vital. Como has visto, existe gran diversidad de células. Cada una de ellas posee una forma específica dependiendo de la función a la que esté destinada. En general, las vegetales suelen tener forma poliédrica, mientras que las animales, y entre ellas las nuestras, presentan aspectos esféricos o redondeados. Las células animales pueden presentar formas muy diversas: Cúbicas como las epiteliales que recubren el organismo. Alargadas como las de los músculos. Estrelladas como las nerviosas. Con formas especiales, como los espermatozoides. Como podrás pensar, las células no son visibles a simple vista debido a su minúsculo tamaño. Por ello es necesario emplear un instrumento que nos permita verlas; éste es el microscopio. Autoevaluación Para saber más Célula procariota Este documento proporciona una amena definición de célula procariota. Una vez leído este documento realiza las actividades propuestas. http://recursos.cnice.mec.es/biosfera/alumno/3ESO/seruni-pluricelulares/contenidos4.htm [versión en caché] Célula eucariota: animal y vegetal Este documento describe esquemáticamente la célula eucariota estableciendo semejanzas y diferencias. Realiza las actividades de autocomprobación. http://recursos.cnice.mec.es/biosfera/alumno/3ESO/seruni-pluricelulares/contenidos5.htm [versión en caché] Célula y microscopio Este artículo, aborda la importancia del uso y descubrimiento del microscopio para el hallazgo de la célula. http://icarito.latercera.cl/enc_virtual/c_nat/celula/celula1.html Área de Ciencias Naturales - Módulo III La estructura de la célula: membrana plasmática, citoplasma y núcleo Toda célula está formada por tres partes: membrana plasmática, citoplasma y núcleo. En una célula animal encontramos:
- 1348. La Célula: estructura interna y metabolismo La membrana plasmática, que es una estructura que envuelve a la célula, con la función de aislar el interior y permitir el paso de ciertas sustancias y eliminar otras. El citoplasma es un componente viscoso en el cual se encuentran disueltos diferentes elementos como agua, sales minerales y nutrientes. Asimismo, encontramos los orgánulos, que son unas estructuras que cumplen distintas funciones, y se clasifican en: Ribosomas: intervienen en la síntesis de proteínas Mitocondrias: realizan la respiración celular Retículo endoplasmático: encargado de almacenar sustancias Lisosomas: con una función digestiva El aparato de Golgi: realiza la secreción de sustancias El núcleo es el encargado de transmitir las órdenes a los orgánulos, conteniendo la cromatina constituida por moléculas de ADN, las cuales cuandose condensan forman los cromosomas, básicos para la reproducción. Los vegetales también están formados por células. Sus células contienen los mismos elementos que las células animales, pero además, poseen dos componentes más: la pared celular y los plastos. La pared celular es la parte externa de la membrana plasmática que en los vegetales se encuentra formada por material celulósico que le da rigidez. Los plastos son orgánulos específicos de tres tipos: cloroplastos, leucoplastos y cromoplastos. Los más importantes son los cloroplastos ya que son los que contienen la clorofila necesaria para realizar la fotosíntesis. Para saber más Variedad celular Mediante la lectura de este artículo, podrás ampliar tus conocimientos sobre los distintos tipos de células y partes constituyentes. Además puedes acceder a una serie de imágenes que ayudarán a comprender la información presentada. http://icarito.latercera.cl/icarito/2002/851/pag2.htm Área de Ciencias Naturales - Módulo III Funciones básicas de la célula La célula, al igual que los organismos pluricelulares, lleva a cabo una serie de funciones básicas, que le van a permitir la supervivencia dentro de su ambiente. Las funciones básicas de la célula y de cualquier ser vivo son la nutrición, la relación y la reproducción. Todas las células llevan a cabo estas funciones, pero no de igual manera.
- 1349. La Célula: estructura interna y metabolismo Área de Ciencias Naturales - Módulo III Nutrición La célula para nutrirse debe incluir en su interior diversas sustancias, llevar a cabo el metabolismo y realizar la excreción de los productos de deshecho. En la incorporación de esas nuevas sustancias, la membrana plasmática tendrá un comportamiento diferenciado según sea el tipo: Cuando las sustancias están disueltas, la célula no necesita hacer un gran esfuerzo, ya que pueden pasar a su interior a favor de un gradiente de concentración (desde la solución más concentrada a la más diluida), mediante el proceso de la ósmosis. Las partículas de mayor tamaño (sólidas, gotas de líquidos, etcétera) no pueden penetrar fácilmente, desempeñando la membrana un papel más activo, mediante el proceso de la endocitosis. Para ello, rodea a la partícula con la membrana, invaginándola e introduciéndola en el interior. Para saber más Célula: nutrición Este documento aborda de forma esquemática el concepto de nutrición celular y los distintos tipos de alimentación existentes. Realiza las actividades de autocomprobación. http://recursos.cnice.mec.es/biosfera/alumno/3ESO/seruni-pluricelulares/contenidos6.htm [versión en caché] Célula: alimentación Este artículo ofrece una simple explicación del proceso de nutrición celular mediante el apoyo de una ilustración que representa dicho proceso. http://icarito.latercera.cl/infografia/chumano/celula/alimentacion.htm Área de Ciencias Naturales - Módulo III
- 1350. La Célula: estructura interna y metabolismo Reproducción Para la reproducción celular existen varios mecanismos: En las células procariotas, se produce una división por bipartición. En las células eucariotas, primero se divide el núcleo en dos partes exactamente iguales por mitosis, luego el citoplasma puede dividirse de diferentes formas: La gemación, es un proceso en el que salen unas yemas con material hereditario que se separan al final originando una nueva célula. Es característica de las levaduras. En la esporulación, el núcleo se divide, originando varias células que quedan en el interior de la célula madre, hasta que la membrana se rompe y quedan liberadas. La mayoría de las células se reproducen por bipartición, dando origen a dos células idénticas. Para saber más Célula: función de reproducción Este documento describe detalladamente los distintos procesos reproductivos correspondientes a las diferentes células existentes, apoyando dicha información mediante ilustraciones. Realiza las actividades de autocomprobación. http://recursos.cnice.mec.es/biosfera/alumno/3ESO/seruni-pluricelulares/contenidos8.htm [versión en caché] Mitosis: nuevas células
- 1351. La Célula: estructura interna y metabolismo La Célula: estructura interna y metabolismo Este artículo ofrece una información esquemática sobre el proceso reproductivo de las células eucariotas. http://icarito.latercera.cl/enc_virtual/c_nat/celula/celula8.html Área de Ciencias Naturales - Módulo III Relación Las funciones de relación permiten a la célula, mediante reacciones de sensibilidad, recibir estímulos (luminosos, químicos o mecánicos) de su medio y responder ante ellos, de forma positiva o negativa. La respuesta se efectúa desplazándose, mediante una movilidad que puede ser: Por movimiento ameboide, que se realiza por deformaciones de la membrana. Por cilios y flagelos, que son filamentos de la membrana plasmática. Para saber más Célula: función de relación Este documento proporciona una descripción sencilla sobre la función de relación que establecen las células con el medio. Realiza las actividades de autocomprobación. http://recursos.cnice.mec.es/biosfera/alumno/3ESO/seruni-pluricelulares/contenidos7.htm [versión en caché] Área de Ciencias Naturales - Módulo III Introducción al metabolismo celular El metabolismo es el conjunto de todas las reacciones bioquímicas que tiene lugar en la célula, con el objetivo de intercambiar materia y energía entre la célula y su medio. En el metabolismo se distinguen dos fases:
- 1352. La Célula: estructura interna y metabolismo La Célula: estructura interna y metabolismo Catabolismo, son procesos de degradación, en los cuales a partir de moléculas complejas se obtiene energía y moléculas sencillas. Anabolismo, son procesos de síntesis, en los cuales a partir de moléculas sencillas y energía se obtiene las moléculas complejas que constituyen nuestro organismo Área de Ciencias Naturales - Módulo III Fuentes de materia y energía: autótrofos y heterótrofos De acuerdo con la forma de obtención de la materia y la energía, las células pueden ser: Autótrofas, cuando las células fabrican materia orgánica a partir de materia inorgánica utilizando una fuente de energía externa. Es la forma de nutrirse las células vegetales, mediante la fotosíntesis, que es un proceso anabólico. Heterótrofas, cuando las células no pueden sintetizar materia orgánica. Utilizan la materia orgánica que obtienen del medio, a partir de la cual también adquieren la energía necesaria para su funcionamiento mediante el proceso catabólico de la respiración. Área de Ciencias Naturales - Módulo III Fotosíntesis En la fotosíntesis, la célula utiliza como fuente de energía la luz solar, cuyos fotones altamente energéticos van a transferir parte de esa energía para formar moléculas orgánicas, como la glucosa, a partir del dióxido de carbono de la atmósfera, liberándose oxigeno. Este proceso tiene lugar en el interior de los cloroplastos, interviniendo la clorofila como molécula fundamental. La fotosíntesis se realiza en dos etapas: Fase luminosa: la clorofila, pigmento verde contenido en los cloroplastos, absorbe energía luminosa para transformarlo en energía química. En ella se rompen las moléculas de agua que la planta ha
- 1353. La Célula: estructura interna y metabolismo captado por la raíz junto con las sales minerales, transformando la savia bruta en nitrógeno y oxígeno. Este último será vertido al exterior como gas residual para la planta pero como elemento básico para el resto de los seres vivos, manteniendo así el equilibrio biológico. Fase oscura: el hidrógeno se mezcla con el dióxido de carbono que también ha tomado la planta del aire produciendo, gracias a la energía química, hidratos de carbono básicos para la alimentación de la planta. Estos junto con los azúcares, derivados también del mismo proceso, darán lugar junto con el agua a la savia elaborada. Además, la fotosíntesis no es necesaria sólo para la planta sino para todos los seres vivos ya que es la base de la cadena alimenticia que alimentará a otros para que estos a su vez, puedan alimentar a otros seres puesto que los demás no pueden realizar el proceso de fotosíntesis. Para saber más Fotosíntesis Este documento aborda una explicación breve del proceso de alimentación de las plantas. http://thales.cica.es/rd/Recursos/rd99/ed99-0574-02/fotosintesis.html Área de Ciencias Naturales - Módulo III Respiración celular En la respiración, la célula va a obtener la energía acumulada en las moléculas orgánicas, como la glucosa, utilizando para ello el oxígeno atmosférico, liberándose como productos de desecho dióxido de carbono y agua. La respiración se produce en el interior de las mitocondrias, que son orgánulos presentes en todas las células, tanto animales como vegetales. Para saber más Respiración Este documento aborda una explicación breve del proceso de respiración de las plantas. http://thales.cica.es/rd/Recursos/rd99/ed99-0574-02/respiracion.html Área de Ciencias Naturales - Módulo III
- 1360. I D E A S CLARAS La célula eucariota: orgánulos membranosos Tipos de orgánulos membranosos En la célula eucariota existen orgánulos constituidos fundamentalmente por vesículas membranosas (retículo endoplásmico y complejo de Golgi) y otros implicados en el metabolismo energético de la célula (mitocondrias, peroxisomas y cloroplastos). Retículo endoplásmico Se trata de un sistema de sáculos y túbulos membranosos conectados entre sí y con la membrana nuclear y el complejo de Golgi. Se trata de un sistema de sáculos aplanados con ribosomas asociados. Sus funciones son la síntesis, modificación y almacenamiento de las proteínas en la célula. En él se produce el plegamiento y ensamblaje de las proteínas, así como la degradación de las proteínas incorrectas. Son unos túbulos membranosos interconectados, no asociados a ribosomas. Sus funciones son: ¼ Síntesis de lípidos destinados a la membrana y hormonas lipídicas. ¼ Degradación de compuestos tóxicos liposolubles. ¼ Almacén de calcio en las células musculares. ¼ Hidrólisis de carbohidratos, como el glucógeno hepático, cuando el organismo necesita glucosa. Complejo de Golgi Es un conjunto de cisternas aplanadas rodeadas de pequeñas vesículas, con una cara de formación relacionada con el retículo endoplásmico rugoso y una cara de maduración en la que se originan las vesículas de secreción. Sus funciones son: ¼ Modificación y maduración de las proteínas que proceden del retículo endoplásmico rugoso (proteolisis, adición de carbohidratos y grupos fosfatos). ¼ Transporte de lípidos y proteínas destinadas a vesículas de secreción o de endocitosis. Lisosomas Son vesículas membranosas que contienen enzimas hidrolíticas, como la fosfatasa ácida, las lipasas o la carboxipeptidasa. Se forman a partir del complejo de Golgi (lisosomas primarios) y se unen a las vesículas de endocitosis o fagocitosis durante los procesos de digestión celular. Los lisosomas permiten la digestión de elementos nutritivos en los fagolisosomas y la de los restos celulares en los autofagolisosomas (autofagia). Vacuolas Son vesículas cuyo contenido fundamental es el agua. Es una vacuola de gran tamaño que contiene enzimas hidrolíticas. Contribuye a la turgencia de la célula y sirve como almacén para diversas sustancias (tóxicas o de desecho) en las plantas. Recoge el agua que entra por ósmosis a la célula y la expulsa al exterior.Vacuola contráctil (vacuola pulsátil) Vacuola vegetal Funciones de los lisosomas Retículo endoplásmico liso Retículo endoplásmico rugoso
- 1361. Orgánulos energéticos Son orgánulos membranosos en los que tienen lugar reacciones metabólicas fundamentales para la obtención de energía. Son orgánulos relacionados con el metabolismo respiratorio aeróbico. Están constituidas por una membrana mitocondrial externa y una membrana mitocondrial interna replegada hacia el interior (crestas mitocondriales), separadas por un espacio intermembranoso y una matriz mitocondrial que contiene ADN mitocondrial. Las mitocondrias albergan enzimas relacionadas con el metabolismo respiratorio aerobio en las células. La membrana mitocondrial interna contiene las cadenas de transporte y sistemas enzimáticos necesarios para la síntesis de ATP por fosforilación oxidativa. En la matriz mitocondrial tiene lugar el ciclo del ácido cítrico o de los ácidos tricarboxílicos (ciclo de Krebs) y la beta-oxidación de los ácidos grasos. Las mitocondrias se dividen por bipartición o gemación en el interior de la célula. Peroxisomas Son vesículas membranosas que contienen enzimas oxidativas. En los peroxisomas se oxidan compuestos orgánicos y se inactivan productos tóxicos para la célula, como el peróxido de hidrógeno (catalasa). Cloroplastos Son orgánulos relacionados con el metabolismo fotosintético (fotosíntesis oxigénica). Están rodeados por una envoltura compuesta por una membrana plastidial externa y una membrana plastidial interna, separadas por un espacio intermembranoso. Contienen un sistema de vesículas aplanadas interconectadas, los tilacoides, que se apilan formando los grana. El estroma contiene ADN plastidial y el pirenoide, un acúmulo de enzimas del ciclo de Calvin rodeado de reservas de carbohidratos (almidón). En los cloroplastos se lleva a cabo el proceso fotosintético oxigénico de forma compartimentalizada. En los tilacoides están los pigmentos fotosintéticos, las cadenas de transporte y enzimas necesarios para la síntesis de ATP por fotofosforilación. En el estroma tiene lugar el proceso anabólico de fijación del CO2 por el ciclo reductor de las pentosas fosfato (ciclo de Calvin). Los cloroplastos se dividen por escisión binaria. Durante el desarrollo del organismo se originan a partir de proplastos. Mitocondrias Génesis de los cloroplastos Función de los cloroplastos Estructura de los cloroplastos Función de los peroxisomas Génesis de las mitocondrias Función de las mitocondrias Estructura y composición de las mitocondrias
- 1362. ORGANULOS NO MEMBRANOSOS CITOESQUELETO RIBOSOMAS INCLUSIONES CITOPLASMICAS 9 CITOESQUELETO No está presente en células Procarióticas Red de filamentos proteicos, compleja e interconectada Funciones: Mantenimiento de la forma celular Control de los cambios de forma celular Control del movimiento celular Control del movimiento y posición de orgánulos Control del reparto de material genético en la división Tipos de filamentos MICROTUBULOS formados por tubulina MICROFILAMENTOS formados por Actina y Miosina FILAMENTOS INTERMEDIOS formados por queratinas y otras proteínas 1. MICROTUBULOS Presentes en todas células eucarióticas animales y vegetales menos eritrocitos de mamíferos ESTRUCTURA 13 Subfilamentos Dímeros de tubulina alfa y beta. Polaridad Estabilizados por proteínas MAPs (proteínas asociadas a microtúbulos) Proceso de polimerización ligado a GTP Se inician en Centros COM o MTOC MICROTUBULOS ESTABLES 1. Asociados a filamentos intermedios se extienden a lo largo de los axones y dendritas formando un citoesqueleto estable 2. Transporte intracelular. : Vesículas y partículas son transportadas con frecuencia varios micrómetros. La difusión por si sola no explica ni la direccionalidad ni la velocidad del proceso por tanto se vincula a la estructura cito esquelética El movimiento requiere la presencia de una proteína motora QUINESINA que se une por un lado a la vesícula o molécula u por otro al microtúbulo. Desarrolla el movimiento anterógrado Otra proteína la DINEINA CITOPLASMICA facilita el movimiento retrógrado En axones: En el cuerpo neuronal es donde se sitúan los ribosomas y las proteínas que deben ser transportadas hasta las terminaciones sinápticas. Hay movimientos anterógrados hacia las sinapsis y movimientos retrógrados hacia el soma de estructuras viejas que deben ser degradas en lisosomas Movimiento de melanina en melanóforos de peces
- 1363. 3. CILIOS Y FLAGELOS 4. CENTRIOLOS Y CUERPOS BASALES MICROTUBULOS OCASIONALES HUSO MITOTICO. FIBRAS POLARES CINETOCORICAS Y ASTRALES 2. MICROFILAMENTOS ESTRUCTURA Polímeros de Actina (Proteína globular muy abundante)‰ ‰ Forma filamentos constituidos por dos hebras enrolladas helicoidalmente y asociadas a iones Ca Tienen polaridad La polimerización es inducida por iones Mg, K, y Na La polimerización provoca un aumento de la viscosidad del citosol Los hay de gran estabilidad como los que conforman los músculos y los hay de menor estabilidad presentando facilidad de polimerización y despolimerización siendo estos cambios controlados esenciales para el movimiento celular La Miosina contiene una región globular que se asocia a la actina y un segmento fibroso que le permite agregarse en filamentos. Tiene una larga cola en alfa-hélice y dos cabezas globulares En el músculo las colas fibrosas se empaquetan formando los filamentos gruesos con las cabezas sobresaliendo dispuestas helicoidalmente Tiene actividad ATPásica FUNCIONES EN MUSCULO ESTRIADO Y CARDIACO Estructura del Sarcomero Comprendido entre dos líneas Z Contiene filamentos delgados de Actina que forman las bandas claras I. Divididas por la línea Z Contiene filamentos gruesos de Miosina que forman la banda oscura A Los extremos + se unen a los discos Z Durante la contracción los micro filamentos no modifican su longitud, lo que sí varia es la longitud del sarcómero al deslizarse los filamentos de Miosina sobre los de Actina Para este proceso hace falta la presencia de Ca almacenado en el retículo Sarcoplásmico (REL) Las membranas del RS bombean en contra de gradiente Ca desde el citosol. Cuando la onda des despolarización llega al músculo se produce la apertura de los canales del calcio y de las uniones GAP desencadenándose la contracción Cada microfibrilla esta rodeado de mitocondrias y de granos de glucógeno para generar ATP EN MUSCULO LISO No tiene un Retículo Sarcoplásmico desarrollado y los cambios de Ca son más lentos No hay una organización sarcomérica de las fibras EN CELULAS NO CONTRÁCTILES: Anillo contráctil de las células en Telofase durante la citocinesis. Generalmente uno de los extremos de la mayor parte de los filamentos de actina no muscular se sitúa unido a la membrana. Por tanto cualquier tensión que se genere sobre los micro filamentos repercute en la membrana
- 1364. Microfilamentos de Actina en microvellosidades En el interior de las microvellosidades aparecen ordenados filamentos de actina. Tiene función estructural Microfilamentos de Actina en desmosomas en barra Forman redes por debajo de las microvellosidades y de las uniones estrechas Microfilamentos de Actina en procesos de ciclosis El flujo del citoplasma y el movimiento de orgánulos también esta relacionado con los micro filamentos de actina Microfilamentos de Actina en movimiento ameboideo Los movimientos de las amebas y de los macrófagos implican transiciones reversibles gel - sol de una red de Actina 3. FILAMENTOS INTERMEDIOS Se les consideran los principales determinantes estructurales de muchas células: conectan desmosomas, estabilizan el epitelio; forman las proteínas estructurales principales de la piel y el cabello; forman el andamiaje que soporta los discos Z y las miofibrillas; dan fuerza y rigidez a los axones Características individuales x Los componentes proteicos son diversos según el tipo celular x Normalmente se encuentran en forma polimérica y permanecen insolubles. No son tan lábiles como microtúbulos y microfilamentos x No parecen necesitar energía en su montaje x Son apolares, no tienen direccionalidad Se han identificado cinco clases: Vimentina: Está con frecuencia asociada a microtúbulos. Su función podría ser la de mantener el núcleo y otros orgánulos en un lugar definido dentro de la célula, o aíslan por EJ. gotas de lípidos Desmina: Se encuentran en las células musculares cerca de los discos Z del músculo estriado. Su función es anclar y orientar los discos Z Neurofilamentos: presentes en los axones de las neuronas de vertebrados Las proteínas ácidas de las fibras gliales PAFG presentes en las células de la Glía Citoqueratinas típicas de células epiteliales, se han descrito mas de 30 tipos diferentes. Unas son características de tejidos duros (uñas, cabellos..) y otras son característics de tejido epiteliales internos
- 1365. 9 RIBOSOMAS Son orgánulos no membranosos descubiertos por PALADE 1953. Pueden estar libres por el citoplasma aislados o formando polirribosomas. También pueden estar asociados a las membranas del RE rugoso y a la membrana exterior del núcleo, pero nunca a la citoplásmica ESTRUCTURA Tienen un tamaño muy constante y su estructura es similar en todas las especies. Están formados por moléculas individuales de ARN asociado a mas de 50 proteínas y organizado en dos subunidades, una grande y otra pequeña Las proteínas y el ARN de las dos subunidades es diferente Los tamaños son designados en unidades Sverberg El ribosoma Eucariótico tiene un tamaño de 80 S ( 60 S + 40 S) El procariótico es de 70 S ( 50 S + 30 S) El procesamiento del pre-ARNr se produce en el nucleolo FUNCION Síntesis de proteínas Los ribosomas asociados a la membrana del retículo y los no asociados traducen diferentes tipos de ARNm El Ribosoma proporciona el espacio donde realizarse la unión de los aminoácidos colocados en la secuencia correcta según se va traduciendo la información proporcionada por el ARNm Para ello presenta dos sitios ocupados respectivamente por aminoacil-ARNt (locus A) y por peptidil- ARNt (locus P) Necesita la presencia de ARNm y la colaboración de proteínas especificas factores de iniciación, de elongación y de terminación 9 INCLUSIONES CITOPLASMÁTICAS Son acumulaciones de diversos tipos de sustancias no rodeadas de membranas 9 Inclusiones vegetales o Glúcidos. Se almacenan como productos de reserva en tubérculos y en semillas. La forma mas común es en forma de Almidón (polímero de la glucosa); otra forma menos importante es la inulina (polímero de la fructosa). La morfología del almidón es en capas alrededor de un punto mas o menos central denominado hilio o Grasas. Aparecen dispuestas en numerosas gotitas de distintos tamaños a diferencia de los sucede con las grasa animales. Se observan en semillas o Proteínas. Forman los llamados granos de Aleurona que constituyen un material de reserva de muchas semillas. Este material proteico es consumido durante la germinación o Sales inorgánicas. En especial de carbonato y oxalato cálcico o Pigmentos. Carotenoides de color anaranjado 9 Inclusiones animales o Grasas es la forma mas comun de almacenamiento estable de energía. Se realiza en células especializadas, los adipositos en el tejido celular subcutáneo y junto a las paredes intestinales o Glúcidos. En tejidos animales es el glucógeno (polímero de glucosa) Especialmente importante en hepatocitos y músculo. Es un almacenamiento a corto plazo o Pigmentos: Hemoglobina presente en eritrocitos y Melanina presente en el ojo y en celulas epiteliales
- 1366. /D UHVSLUDFLyQ FHOXODU Enviado por Jhonny Valle Ayuque | Comentar este trabajo | Ver trabajos relacionados ,QWURGXFFLyQ 5HVSLUDFLyQ FHOXODU 7LSRV GH UHVSLUDFLyQ FHOXODU /D PLWRFRQGULD VXV SDUWHV LFOR GH .UHEV ,1752'8,Ï1 /D UHVSLUDFLyQ FHOXODU FRQVWLWXH HO SURFHVR PiV LPSRUWDQWH GHQWUR GH OD FpOXOD HO FXDO DERUGDUHPRV HQ SHTXHxD PHGLGD SHUR GH PDQHUD VLJQLILFDWLYD (VWD LQYHVWLJDFLyQ WRPD HQ FXHQWD D WRGRV DTXHOORV TXH GH DOJXQD PDQHUD SDUWLFLSDQ DXQTXH VHD GH IRUPD PtQLPD HQ OD UHVSLUDFLyQ FHOXODU +DEODU GH UHVSLUDFLyQ FHOXODU HV UHIHULUQRV D XQ SURFHVR ELRTXtPLFR GHO FXDO QRV UDPLILFDUHPRV D GRV WLSRV GH UHVSLUDFLyQ FHOXODU DHUyELFD DQDHUyELFD (Q HVWH SURFHVR LQWHUILHUHQ IDFWRUHV TXtPLFRV FDSDFHV GH VHU SURFHVDGRV GHQWUR GH ODV FpOXODV TXH HQ JUDQ PHGLGD FRQVWLWXHQ ODV EDVHV SDUD TXH OD UHVSLUDFLyQ FHOXODU VH OOHYH D FDER 5(63,5$,Ï1 (/8/$5 /D UHVSLUDFLyQ FHOXODU HV HO FRQMXQWR GH UHDFFLRQHV ELRTXtPLFDV TXH RFXUUHQ HQ OD PDRUtD GH ODV FpOXODV 7DPELpQ HV HO FRQMXQWR GH UHDFFLRQHV TXtPLFDV PHGLDQWH ODV FXDOHV VH REWLHQH HQHUJtD D SDUWLU GH OD GHJUDGDFLyQ GH VXVWDQFLDV RUJiQLFDV FRPR ORV D]~FDUHV ORV iFLGRV SULQFLSDOPHQWH RPSUHQGH GRV IDVHV 35,0(5$ )$6( 6H R[LGD OD JOXFRVD D]~FDU
- 1367. QR GHSHQGH GHO R[tJHQR SRU OR TXH UHFLEH HO QRPEUH GH UHVSLUDFLyQ DQDHUyELFD JOXFROLVLV UHDFFLyQ TXH VH OOHYD D FDER HQ HO FLWRSODVPD GH OD FHOXOD 6(*81'$ )$6( 6H UHDOL]D FRQ OD LQWHUYHQFLyQ GHO R[tJHQR UHFLEH HO QRPEUH GH UHVSLUDFLyQ DHUyELFD R HO FLFOR GH NUHEV VH UHDOL]D HQ HVWUXFWXUDV HVSHFLDOHV GH ODV FpOXODV OODPDGDV PLWRFRQGULDV 7DQWR TXH HV XQD SDUWH GHO PHWDEROLVPR FRQFUHWDPHQWH GHO FDWDEROLVPR HQ HO FXDO OD HQHUJtD FRQWHQLGD HQ GLVWLQWDV ELRPROpFXODV FRPR ORV JO~FLGRV D]~FDUHV FDUERKLGUDWRV
- 1368. HV OLEHUDGR GH PDQHUD FRQWURODGD ,03257$1,$ UHFLPLHQWR 7UDQVSRUWH DFWLYR GH VXVWDQFLDV HQHUJpWLFDV 0RYLPLHQWR FLFORVLV 5HJHQHUDFLyQ GH FpOXODV 6tQWHVLV GH SURWHtQDV 'LYLVLyQ GH FpOXODV 7,326 '( 5(63,5$,Ï1 (/8/$5 5(63,5$,Ï1 $1$(5Ï%,$
- 1369. /D UHVSLUDFLyQ DQDHUyELFD HV XQ SURFHVR ELROyJLFR GH R[LGRUUHGXFFLyQ GH D]~FDUHV RWURV FRPSXHVWRV /R UHDOL]DQ H[FOXVLYDPHQWH DOJXQRV JUXSRV GH EDFWHULDV (Q OD UHVSLUDFLyQ DQDHUyELFD QR VH XVD R[tJHQR VLQR SDUD OD PLVPD IXQFLyQ VH HPSOHD RWUD VXVWDQFLD R[LGDQWH GLVWLQWD FRPR HO VXOIDWR1R KD TXH FRQIXQGLU OD UHVSLUDFLyQ DQDHUyELFD FRQ OD IHUPHQWDFLyQ DXQTXH HVWRV GRV WLSRV GH PHWDEROLVPR WLHQHQ HQ FRP~Q HO QR VHU GHSHQGLHQWH GHO R[LJHQR 7RGRV ORV SRVLEOHV DFHSWRUHV HQ OD UHVSLUDFLyQ DQDHUyELFD WLHQHQ XQ SRWHQFLDO GH UHGXFFLyQ PHQRU TXH HO 2 SRU OR TXH VH JHQHUD PHQRU HQHUJtD HQ HO SURFHVR (7$3$6 *OXFyOLVLV )HUPHQWDFLyQ */8Ï/,6,6 7DPELpQ GHQRPLQDGR JOLFyOLVLV HV OD VHFXHQFLD PHWDEyOLFD HQ OD TXH VH R[LGD HQ OD JOXFyOLVLV FXDQGR KD DXVHQFLD GH R[tJHQR OD JOXFyOLVLV HV OD ~QLFD YtD TXH SURGXFH $73 HQ ORV DQLPDOHV (VWi SUHVHQWH HQ WRGDV ODV IRUPDV GH YtDV DFWXDOHV (V OD SULPHUD SDUWH GHO PHWDEROLVPR HQHUJpWLFR HQ ODV FpOXODV HXFDULRWDV HQ GRQGH RFXUUH HO FLWRSODVPD 3RU OR WDQWR HV XQD VHFXHQFLD FRPSOHMD GH UHDFFLRQHV TXH VH HIHFWXDQ HQ HO FLWRVRO GH XQD FHOXOD PHGLDQWH ODV FXDOHV XQD PROpFXOD GH JOXFRVD VH GHVGREOD HQ GRV PROpFXODV GH DFLGR SLUXYLFR 'H PDQHUD TXH OD JOXFROLVLV FRQVWD GH GRV SDVRV SULQFLSDOHV $FWLYDFLRQ GH OD JOXFRVD 3URGXFFLyQ GH HQHUJtD ,03257$1,$ 3HUPLWH D ORV P~VFXORV HVTXHOpWLFRV UHDOL]DU VX FRQWUDFFLyQ )(50(17$,Ï1 (V XQ SURFHVR FDWDEyOLFR GH R[LGDFLyQ FRPSOHWD VLHQGR HO SURGXFWR ILQDO GH XQ FRPSXHVWR RUJiQLFR /D IHUPHQWDFLyQ WtSLFD HV OOHYDGD DFDER SRU ODV OHYDGXUDV 7DPELpQ XQRV PHWD]RRV SODQWDV PHQRUHV VRQ FDSDFHV GH SURGXFLUOD (O SURFHVR GH IHUPHQWDFLyQ DQDHUyELFD VH SURGXFH HQ OD DXVHQFLD GH R[LJHQR FRPR DFHSWRU ILQDO GH ORV HOHFWURQHV GHO 1$'+ SURGXFLGR HQ OD JOXFyOLVLV (Q ORV VHUHV YLYRV OD IHUPHQWDFLyQ HV XQ SURFHVR DQDHUyELFR HQ HO QR LQWHUYLHQH OD FDGHQD UHVSLUDWRULD TXH VRQ SURSLRV GHO PLFUR RUJDQLVPR FRPR ODV EDFWHULDV OHYDGXUDV $GHPiV HQ OD LQGXVWULD G HOD IHUPHQWDFLyQ SXHGH VHU R[LGDWLYD HV GHFLU FRPR SUHVHQFLD GH R[LJHQR SHUR HV XQD R[LGDFLyQ DHUyELFD LQFRPSOHWD FRPR OD SURGXFFLyQ GH DFLGR DFpWLFR DSDUWLU GHO HWDQRO /D IHUPHQWDFLyQ SXHGH VHU QDWXUDOHV FXDQGR ODV FRQGLFLRQHV DPELHQWDOHV SHUPLWDQ OD LQWHUDFFLyQ GHO PLFURRUJDQLVPR VXVWUDWRV RUJiQLFRV VXVFHSWLEOHV R DUWLILFLDOHV FXDQGR HO KRPEUH SURSLFLD FRQGLFLRQHV HQ FRQWDFWR UHIHULGR 8626 • (O FRQRFLPLHQWR GH OD GLHWD D WUDYpV GHO GHVDUUROOR GH XQD GLYHUVLGDG GH VDERUHV DURPDV WH[WXUDV HQ ORV VXEVWUDWRV GH ORV DOLPHQWRV • 3UHVHUYDFLyQ GH FDQWLGDGHV VXEVWDQFLDOHV GH DOLPHQWRV D WUDYpV GHO DFLGR OiFWHR DOFRKyOLFR DFLGR DFpWLFR IHUPHQWDFLyQ DOFDOLQDV /D IHUPHQWDFLyQ WLHQH DOJXQRV XVRV H[FOXVLYRV SDUD ORV DOLPHQWRV SXHGHQ SURGXFLU QXWULHQWHV LPSRUWDQWHV R HOLPLQDU DXWRQXWULHQWHV 7,326 '( )(50(17$,Ï1 • )HUPHQWDFLyQ DFHWLFD • )HUPHQWDFLyQ DOFRKROLFD
- 1370. • )HUPHQWDFLyQ EXWLULFD • )HUPHQWDFLyQ GH OD JOLFHULQD • )HUPHQWDFLyQ ODFWLFD • )HUPHQWDFLyQ SXWULFD 5(63,5$,Ï1 $(5Ï%,$ (V XQ WLSR GH PHWDEROLVPR HQHUJHWLFR HQ HO TXH ORV VHUHV YLYRV H[WUDHQ HQHUJtD GH PROpFXODV RUJDQLFDV FRPR OD JOXFRVD SRU XQ SURFHVR FRPSOHMR HQ GRQGH HO FDUERQR TXHGD R[LGDGR HQ HO TXH HO DLUH HV HO R[LGDQWH HPSOHDGR /D UHVSLUDFLyQ DHURELFD HV SURSLD GH ORV RUJDQLVPR HXFDULRQWHV HQ JHQHUDO GH DOJXQRV WLSRV GH EDFWHULDV • /D VXVHFLRQ GH UHDFFLRQHV TXLPLFDV TXH RFXUUHQ GHQWUR GH ODV FHOXODV PHGLDQWH ODV FXDOHV VH UHDOL]D ODV GHVFRPSRVLFLyQ ILQDO GH ODV PROpFXODV HQ ORV DOLPHQWRV HQ OD TXH VH SURGXFH 2 +2 • 6H UHDOL]D VROR HQ HO SURFHVR GH R[LJHQR RQVLVWH HQ OD GHJUDGDFLRQ GH ORV SLUXYDWRV SURGXFLGRV GXUDQWH OD JOXFRVLV KDVWD 2 +2 FRPR REWHQFLyQ GH D $73 ,03257$1,$ 3DUWLFLSD HQ OD UHVSLUDFLyQ FHOXODU IRUPDQGR $73 5($,21(6 $(5Ï%,$6 • /DV UHDFFLRQHV DHURELFDV RFXUUH HQ OD PLWRFRQGULD VRQ )RUPDFLyQ GHO DFHWLOR 7UDQVIHUHQFLD GHO DFHWLOR $FWLYLGDGHV HQ PDWUL] LFOR GH NUHEV 7UDQVSRUWH GH HOHFWURQHV DGHQD UHVSLUDWRULD )RVIRULODFLRQ R[LGDWLYD DFWLYLGDG GH FUHVWDV
- 1371. /$ 0,7221'5,$ 686 3$57(6
- 1373. ,/2 '( .5(%6 3URSXHVWR SRU +DQV $ .UHEV HQ TXLHQ GHVFXEULR HO FLFOR HVWXGLDQGR VXVSHQVLRQHV GH SDSLOODV GHO P~VFXOR SHFWRUDOGH OD SDORPD TXH SHoUHVHEWD XQ HOHYDGR ULWPR UHVSLUDWRULR (O FLFOR GH NUHEV WDPELHQ OODPDGR FLFOR GHO DFLGR FLWULFR R FLFOR GH OVR DFLGRV WULFDUER[LOLFRV
- 1374. HV XQD VHULH GH UHDFFLRQHV TXLPLFDV GH JUDQ LPSRUWDQFLD TXH IRUPDQ SDUWH GH OD UHVSLUDFLyQ FHOXODU HQ WRGD ODV FHOXODV DHURELFDV HV GHFLU TXH XWLOL]DQ R[LJHQR (Q RUJDQLVPR DHURELFR HO FLFOR GH NUHEV HV SDUWH GH OD YLD FDWDEROLFD TXH UHDOL]DQ R[LGDFLyQ GH KLGUDWRV GH FDUERQR DFLGRV JUDRV DPLQRiFLGRV KDVWD SURGXFLU 2 +2 OLEHUDQGR HQHUJtD HQ IRUPD XWLOL]DEOH (O FLFOR GH NUHEV WDPELHQ SURSRUFLRQD UHFXUVR SDUD PXFKDV ELRPROHFXODV WDOHV FRPR FLHUWRV DQLPRDFLGRV 3RU HOOR VH FRQVLGHUD XQD YLD DQILEROLFD HV GHFLU TXH HV FDWDEROLFR DQDEROLFD DO PLVPR WLHPSR 8%,$,Ï1 7LHQH OXJDU HQ WUHV SDUWHV • 0DWUL] PLWRFRQGULDO • (Q ODV HXFDULRWDV • (Q HO FLWRSODVPD GH HXFDULRWDV
- 1375. ,/2 '( .5(%6 (VWH WUDEDMR HVWi GHGLFDGR $ QXHVWUD SURIHVRUD TXH FRQ SDFLHQFLD HVPHUR QRV HGXFD SDUD SRGHU VREUHOOHYDU ORV REVWiFXORV TXH QRV GD OD YLGD -KRQQ 9DOOH $XTXH MKRKRDUURED@KRWPDLOFRP
- 1376. 101 La fermentación láctica es un proceso celular anaeróbico donde se utiliza glucosa para obtener energía y donde el producto de desecho es el ácido láctico. Este proceso lo realizan muchas bacterias (llamadas bacterias lácticas), hongos, algunos protozoos y en los tejidos animales. En efecto, la fermentación láctica también se verifica en el tejido muscular cuando, a causa de una intensa actividad motora, no se produce una aportación adecuada de oxígeno que permita el desarrollo de la respiración aeróbica. Cuando el ácido láctico se acumula en las células musculares produce síntomas asociados con la fatiga muscular. Algunas células, como los eritrocitos, carecen de mitocondrias de manera que se ven obligadas a obtener energía por medio de la fermentación láctica; por contra, las neuronas mueren rápidamente ya que no fermentan, y su única fuente de energía es la respiración. 1. PROCESO. En condiciones de ausencia de oxígeno (anaerobias), la fermentación responde a la necesidad de la célula de generar la molécula de NAD+ , que ha sido consumida en el proceso energético de la glucólisis. En la glucólisis la célula transforma y oxida la glucosa en un compuesto de tres átomos de carbono, el ácido pirúvico, obteniendo dos moléculas de ATP; sin embargo, en este proceso se emplean dos moléculas de NAD+ que actúan como aceptores de electrones y se reducen a NADH (Ver IMAGEN X). Para que puedan tener lugar las reacciones de la glucólisis productoras de energía es necesario reoxidar el NADH; esto se consigue mediante la cesión de dos electrones del NADH al ácido pirúvico, que se reduce a ácido láctico. piruvato + NADH + H+ ------- ácido láctico + NAD+ FOTO 44. Esquema fermentación láctica.
- 1377. 102 2. APLICACIONES. Un ejemplo de este tipo de fermentación es la acidificación de la leche. Ciertas bacterias (Lactobacillus, Streptococcus), al desarrollarse en la leche utilizan la lactosa (azúcar de leche) como fuente de energía. La lactosa, al fermentar, produce energía que es aprovechada por las bacterias y el ácido láctico es eliminado. La coagulación de la leche (cuajada) resulta de la precipitación de las proteínas de la leche, y ocurre por el descenso de pH debido a la presencia de ácido láctico. Este proceso es la base para la obtención del yogur. El ácido láctico, dado que otorga acidez al medio, tiene excelentes propiedades conservantes de los alimentos. 3. FACTORES A CONTROLAR EN LA FERMENTACIÓN ÁCIDO LÁCTICA. La temperatura, la concentración de sal común, y la exclusión del aire son los principales factores que influencian el curso de la fermentación. 3.1. Temperatura. Crea las condiciones óptimas para el desarrollo de microorganismos responsables. Ejerce una influencia fundamental en la calidad de la col fermentada, y de ella depende además la duración de la fermentación. La temperatura más favorable para el desarrollo de lactobacilos que intervienen en la fermentación de la col viene a ser 30 ºC. A esta temperatura se garantiza sobre todo una rápida propagación de la acidez y con esto una reducción del tiempo de fermentación, por desgracia a esta ventaja se une un inconveniente. El producto así preparado tienen mal aroma, ya que las bacterias lácticas heterofermentativas no se multiplican suficientemente. La temperatura alta favorece el ablandamiento de las verduras por proceso autoliticoenzimáticos y la aparición de sustancias mucilaginosas, y se acelera la destrucción del ácido ascórbico que tienen gran valor y las coles fermentadas presentan peor color. Para evitar estas pérdidas de calidad, es práctica corriente mantener la temperatura de fermentación entre 10 y 20 ºC.
- 1378. 103 3.2. Concentración de sal común. El NaCl (Cloruro de sodio o sal de cocina), es la única sal utilizada en la fermentación, debido a que otras sales pueden ser tóxicas o amargas y comunicarles condiciones peligrosas e indeseables al producto. La cantidad de sal añadida puede ser alta o baja, y depende del tiempo de vegetal; zanahoria, cebolla, coliflor y otras, que no se marchitan cuando se colocan en la salmuera son conservados en salmuera fuerte (10,5 al 15% de sal). A estas concentraciones de sal no ocurre ningún deterioro por microorganismos, ni tampoco ocurre fermentación láctica, porque la preservación se debe fundamentalmente al alto contenido de sal. En salmueras diluidas, los azúcares que fluyen del interior del vegetal, son fermentados por las bacterias productoras de ácido láctico, y la sal y el ácido, acoplados con las condiciones anaeróbicas preservan el vegetal. Los gérmenes perjudiciales que compiten con los lácticos, por ejemplo, los proteolíticos y los esporulados aerobios y anaerobios son mucho más inhibidos por la sal que los productores de ácido láctico. La aplicación de sal en la fermentación de vegetales inhibe la proliferación de microorganismos putrefactivos; también afecta el desarrollo de especies patogénicas y toxigénicas. El crecimiento de especies de Salmonella se previene por concentraciones de 6 % de NaCl; el Clostridium botulinum, es el microorganismo que más interesa controlar; porque produce una toxina fatal, pero todos los tipos de C. botulinum se inhiben por 10- 12 % sal. El Staphylococcus aureus es capaz de resistir una concentración superior al 15 % en algunos casos hasta un 20 %, pero 5% es la concentración de sal más alta a la cual puede formar toxina. De otra parte, especies útiles e inocuas, incluyendo bacterias productoras de ácido láctico, y algunas especies de levaduras, son afectados por la sal, Lactobacillus delbrueckii puede crecer en medio que contiene 18 % de NaCl. Es bueno tener en mente, que una concentración de sal por encima de 8 % para pepinos y aceitunas, y mayor de 2,5 % para repollo, puede prevenir o retardar una fermentación láctica deseable. De otra parte, concentraciones muy bajas de sal, pueden resultar en el reblandecimiento de los vegetales encurtidos. El repollo acondicionado con sal seca (dry salting), por el proceso de fermentación produce el Sauerkraut, en cambios los vegetales colocados en salmuera (brine salting) nos produce los encurtidos.
- 1379. 104 3.3. Exclusión de Aire. Las bacterias lácticas pertenecen a los microorganismos anaerobios facultativos, es decir, que pueden desarrollarse tanto en presencia como en ausencia de oxígeno. Sin embargo, la fermentación no tiene lugar en presencia de aire, por lo que se toman las correspondientes medidas para desalojarlo procurando que durante la fermentación no penetre aire de nuevo. Las bacterias productoras de ácido láctico, especialmente hongos y levaduras, son solo convenientes en cantidades limitadas en la primera fase de la fermentación. Cantidades mayores de levaduras y de hongos, por su intenso metabolismo aerobio destruyen en breve tiempo cantidades relativamente grandes de hidratos de carbono que serán necesario para la formación de ácido láctico, y además ciertas levaduras y hongos consumen el ácido láctico, resultando la elevación del pH y la aparición de bacterias proteolíticas que pueden causar alteraciones de la col fermentada. La mayor forma de evitar la presencia de oxígeno en la col en fermentación consiste en cerrar herméticamente el tanque de fermentación, usando recipientes de gomas con hojas de plásticos, evitando que la cimas o parte superior de las verduras en fermentación sobresalgan del borde del tanque, es decir, procurando que esté bien sumergidas, en la salmuera. Lo microorganismos aerobios, al consumir los restos de oxígenos existentes en la cuba de fermentación proporcionan de esta forma condiciones favorables para el desarrollo de las bacterias anaerobias productoras de ácido láctico.
- 1380. UNIVERSIDAD NACIONAL DE CUYO FACULTAD DE CIENCIAS AGRARIAS DEPARTAMENTO DE CIENCIAS ENOLÓGICAS Y AGROALIMENTARIAS CATEDRA DE ENOLOGÍA I FERMENTACIÓN ALCOHÓLICA INTRODUCCIÓN La síntesis de la materia viva es endergónica, es decir que necesita un gasto de energía. Las levaduras, microorganismos quimiorganótrofos (quimioheterótrofos), obtienen energía por la degradación de materia orgánica. En función de las condiciones de aerobiosis, las levaduras pueden degradar los azúcares utilizando dos vías metabólicas: la fermentación y la respiración, ambos procesos tienen su inicio común en la glicólisis. La sucesión de reacciones que transforman la glucosa en piruvato con formación de ATP, constituye una vía casi universal en los sistemas biológicos. El significado de la palabra fermentación hace referencia a los fenómenos de descomposición de la materia orgánica (líquido azucarado) con rápido y tumultuoso desprendimiento de gas. Como síntesis sobre las fermentaciones podemos establecer: 1. Las fermentaciones son reacciones en cadena catalizadas por una serie de enzimas. 2. Las secreciones enzimáticas de las distintas especies microbianas que tienen en común una fundamental actividad fermentativa presentan una gran diversidad cualitativa y cuantitativa, y a menudo sucede, aunque en menor medida, entre cepas, variedades o razas de una misma especie. 3. Los agentes fisicoquímicos del medio influyen notablemente sobre la producción y funcionalidad de las enzimas microbianas. Por lo tanto, el desarrollo de cada fermentación y el resultado final pueden ser diferentes tanto por las características fisiológicas de las levaduras como por las condiciones en que se realice la fermentación. LAS ENZIMAS Las enzimas intervienen en los procesos fermentativos catalizando las reacciones bioquímicas. En la Fermentación Alcohólica (FA) interviene un número importante de enzimas, se las clasificó en cuatro grupos: - Fosforilantes, que ligan o separan los radicales fosfato de la molécula orgánica, - Oxidorreductoras, que intervienen en reacciones de oxidoreducción, transportando hidrogeniones, - Carboxilasas, que catalizan reacciones de descarboxilación, con liberación de CO2, y de carboxilación; - y el cuarto grupo, integrado por las enzimas que catalizan otras reacciones tales como mutación, isomerización, enolización, etc. Para ejercer su actividad catalítica, un cierto número de enzimas necesita de un cofactor que puede ser: un ion metálico; un grupo prostético sólidamente ligado a la proteína enzimática o una coenzima que no está ligada a la proteína (o lo está poco) y se comporta como un sustrato de la reacción. A continuación se describen cuatro cofactores que desempeñan un papel importante en los mecanismos de las fermentaciones.
- 1381. ,/2 '( .5(%6 17 ,/2 '( .5(%6 0DWHULDO HODERUDGR SRU - 0RQ]D 6 'ROGiQ 6 6LJQRUHOOL (Q ODV FpOXODV DHURELDV GLVWLQWDV YtDV FDWDEyOLFDV FRQYHUJHQ HQ HO FLFOR GH .UHEV (O FLFOR GH .UHEV GH ORV iFLGRV WULFDUER[tOLFRV R GHO iFLGR FtWULFR
- 1382. HV XQD YtD PHWDEyOLFD SUHVHQWH HQ WRGDV ODV FpOXODV DHURELDV HV GHFLU ODV TXH XWLOL]DQ R[tJHQR FRPR DFHSWRU ILQDO GH HOHFWURQHV HQ OD UHVSLUDFLyQ FHOXODU (Q ORV RUJDQLVPRV DHURELRV ODV UXWDV PHWDEyOLFDV UHVSRQVDEOHV GH OD GHJUDGDFLyQ GH ORV JO~FLGRV iFLGRV JUDVRV DPLQRiFLGRV FRQYHUJHQ HQ HO FLFOR GH .UHEV TXH D VX YH] DSRUWD SRGHU UHGXFWRU D OD FDGHQD UHVSLUDWRULD OLEHUD 2 ILJXUD
- 1383. )LJXUD 9LVLyQ SDQRUiPLFD GH OD FRQYHUJHQFLD GH ODV YtDV FDWDEyOLFDV GH JO~FLGRV DPLQRiFLGRV iFLGRV JUDVRV DO FLFOR GH .UHEV /RV KLGUyJHQRV SUHVHQWHV HQ HVDV PROpFXODV VRQ ORV TXH DEDVWHFHQ D OD FDGHQD UHVSLUDWRULD GHVGH HO 1$' R )$' KDVWD FRPELQDUVH FRQ HO R[tJHQR IRUPDU DJXD /RV FDUERQRV VH HOLPLQDQ FRPR 2 • (O FDWDEROLVPR R[LGDWLYR GH JO~FLGRV iFLGRV JUDVRV DPLQRiFLGRV SXHGH GLYLGLUVH HQ WUHV HWDSDV GH ODV FXDOHV HO FLFOR GH .UHEV HV OD VHJXQGD (Q OD SULPHUD HWDSD TXH LQFOXH D ODV YtDV FDWDEyOLFDV GH iFLGRV JUDVRV D OD JOXFyOLVLV VH JHQHUD DFHWLOR$
- 1384. /RV DPLQRiFLGRV SXHGHQ GDU LQGLUHFWDPHQWH DFHWLO R$ R GLUHFWDPHQWH LQWHUPHGLDULRV GHO FLFOR GH .UHEV (Q OD WHUFHUD HWDSD HO SRGHU UHGXFWRU DSRUWDGR SRU HO FLFOR GH .UHEV HV GUHQDGR KDVWD HO R[tJHQR D WUDYpV GH ORV WUDQVSRUWDGRUHV GH FDGHQD UHVSLUDWRULD 1$'+.+ )$'+ R4 FLWRFURPRV
- 1385. SDUWH GH OD HQHUJtD OLEHUDGD VH HPSOHD HQ OD VtQWHVLV GH $73 SRU IRVIRULODFLyQ R[LGDWLYD ILJXUD
- 1386. • (O FLFOR GH .UHEV HV XQD UXWD DQILEyOLFD SDUWLFLSD HQ SURFHVRV FDWDEyOLFRV DQDEyOLFRV (O FLFOR SURSRUFLRQD αFHWRJOXWDUDWR R[DODFHWDWR SDUD OD VtQWHVLV GH JOXWDPDWR DVSDUWDWR UHVSHFWLYDPHQWH HQWUH RWUDV PROpFXODV IXQGDPHQWDOHV SDUD OD FpOXOD
- 1387. ,/2 '( .5(%6 18 (O SLUXYDWR JHQHUD OD SULQFLSDO PROpFXOD DEDVWHFHGRUD GHO FLFOR OD DFHWLO FRHQ]LPD $ • /D UHDFFLyQ GH R[LGDFLyQ GHFDUER[LODFLyQ GHO SLUXYDWR HV HO QH[R HQWUH OD JOXFyOLVLV HO FLFOR GH .UHEV (VWD UHDFFLyQ LUUHYHUVLEOH HV FDWDOL]DGD SRU XQ FRPSOHMR HQ]LPiWLFR SLUXYDWR GHVKLGURJHQDVD
- 1388. ORFDOL]DGR HQ OD PDWUL] PLWRFRQGULDO GH HXFDULRWDV HQ HO FLWRVRO GH SURFDULRWDV ILJXUD
- 1389. • (O SLUXYDWR SLHUGH HO JUXSR FDUER[LOR FRPR 2 ORV GRV FDUERQRV UHVWDQWHV XQLGRV D OD R$ FRQIRUPDQ OD DFHWLOR$ ILJXUD
- 1390. (Q OD UHDFFLyQ VH UHGXFH XQ 1$' D 1$'++ TXH D VX YH] FHGH ORV + D ORV RWURV WUDQVSRUWDGRUHV GH FDGHQD UHVSLUDWRULD FRQ OD FRQVHFXHQWH IRUPDFLyQ GH $73 )LJXUD 5HDFFLyQ UHVXPHQ GH OD GHVFDUER[LODFLyQ R[LGDWLYD GHO SLUXYDWR 3'+ SLUXYDWR GHVKLGURJHQDGD
- 1391. 8QD YLVLyQ SDQRUiPLFD GHO FLFOR GH .UHEV • /D DFHWLOR$ JHQHUDGD SRU ORV GLIHUHQWHV FDWDEROLVPRV VH FRQGHQVD FRQ HO R[DODFHWDWR JHQHUD FLWUDWR $ WUDYpV GH UHDFFLRQHV GH R[LGDFLyQ GHVFDUER[LODFLyQ VXFHVLYDV GH OD D OD ILJXUD
- 1392. VH UHJHQHUD R[DODFHWDWR FDSD] GH LQLFLDU XQ QXHYR FLFOR )LJXUD 5HSUHVHQWDFLyQ GHO FLFOR GH .UHEV DGD UHDFFLyQ VH LQGLFD FRQ XQ Q~PHUR
- 1393. ,/2 '( .5(%6 19 • (Q FXDWUR UHDFFLRQHV GHO FLFOR RFXUUHQ R[LGDFLyQ GH LQWHUPHGLDULRV UHGXFFLyQ GH FRHQ]LPDV GH FDGHQD UHVSLUDWRULD WUHV 1$' XQ )$' ILJXUD
- 1394. (VDV PROpFXODV UHGXFLGDV TXH LQWHJUDQ OD FDGHQD UHVSLUDWRULD VH UHR[LGDQ SDUWH GH OD HQHUJtD OLEHUDGD VH XVD SDUD IRVIRULODU HO $'3 D $73 (Q HO FLFOR SURSLDPHQWH GLFKR VH SURGXFH XQD IRVIRULODFLyQ D QLYHO GH VXVWUDWR TXH SURGXFH XQ *73 TXH HTXLYDOH HQHUJpWLFDPHQWH D XQ $73 (O FLFOR VH SXHGH UHVXPLU HQ OD VLJXLHQWH HFXDFLyQ $FHWLOR$ 1$' )$' *'3 3L Æ R$6+ 1$'++ )$'+ *73 2 /DV UHDFFLRQHV GHO FLFOR • 5HDFFLyQ FRQGHQVDFLyQ GHO R[DODFHWDWR FRQ OD DFHWLO R$ /D HQ]LPD FLWUDWR VLQWDVD FRQGHQVD D OD DFHWLOR$
- 1395. FRQ HO R[DODFHWDWR
- 1396. SDUD GDU XQD PROpFXOD GH FLWUDWR
- 1397. RPR FRQVHFXHQFLD GH HVWD FRQGHQVDFLyQ VH OLEHUD OD FRHQ]LPD $ +6R$
- 1398. /D UHDFFLyQ HV IXHUWHPHQWH H[HUJyQLFD HV LUUHYHUVLEOH • 5HDFFLyQ LVRPHUL]DFLyQ GHO FLWUDWR D LVRFLWUDWR /D LVRPHUL]DFLyQ GHO FLWUDWR HQ LVRFLWUDWR RFXUUH SRU GRV UHDFFLRQHV TXH VH UHVXPHQ HQ XQD • 5HDFFLyQ R[LGDFLyQ GHFDUER[LODFLyQ GHO LVRFLWUDWR (O LVRFLWUDWR HV VXVWUDWR GH OD LVRFLWUDWR GHVKLGURJHQDVD HQ]LPD TXH WLHQH FRPR FRIDFWRU XQ 1$' TXH IRUPD SDUWH GH OD FDGHQD UHVSLUDWRULD (Q OD UHDFFLyQ VH UHVXPHQ GRV UHDFFLRQHV D SDUWLU GH ODV FXDOHV HO LVRFLWUDWR IRUPD ĮFHWRJOXWDUDWR
- 1399. 3DUD ORJUDU HVH SURGXFWR RFXUUH XQD GHFDUER[LODFLyQ HV GHFLU OD OLEHUDFLyQ GH XQD PROpFXOD GH 2 OD UHGXFFLyQ GH XQ 1$' TXH SHUPLWH OD IRUPDFLyQ GH $73
- 1400. ,/2 '( .5(%6 20 • 5HDFFLyQ HO įFHWRJOXWDUDWR VH WUDQVIRUPD HQ VXFFLQLOR$ (VWH SDVR LPSOLFD OD VHJXQGD GHFDUER[LODFLyQ R[LGDWLYD FDWDOL]DGD SRU OD ĮFHWRJOXWDUDWR GHVKLGURJHQDVD TXH OOHYD D OD IRUPDFLyQ GH VXFFLQLOR$
- 1401. (O 1$' HV OD FRHQ]LPD GH OD GHVKLGURJHQDVD GH PDQHUD TXH VH IRUPDUiQ $73 FRPR FRQVHFXHQFLD GH OD DFWLYLGDG GH FDGHQD UHVSLUDWRULD • 5HDFFLyQ OD VXFFLQLOR$ ULQGH VXFFLQDWR *73 /D VXFFLQLOR$ HV XQ WLRpVWHU GH DOWD HQHUJtD FRQ XQ ǻ*ƒƍ GH KLGUyOLVLV GH .-PRO DSUR[LPDGDPHQWH /D HQHUJtD OLEHUDGD SRU OD UXSWXUD GH HVH HQODFH VH XWLOL]D SDUD JHQHUDU XQ HQODFH IRVIRDQKLGUR HQWUH XQ IRVIDWR XQ *'3 SDUD GDU *73 SRU IRVIRULODFLyQ D QLYHO GH VXVWUDWR (Q OD UHDFFLyQ VH OLEHUD +6R$ (O *73 VH SXHGH FRQYHUWLU HQ $73 VHJ~Q OD VLJXLHQWH UHDFFLyQ *73 $'3 *'3 $73 ǻ*ƒƍ .-PRO • 5HDFFLyQ HO VXFFLQDWR VH WUDQVIRUPD HQ IXPDUDWR (O VXFFLQDWR HV R[LGDGR D IXPDUDWR SRU OD VXFFLQDGR GHVKLGURJHQDVD HQ]LPD TXH WLHQH FRPR FRIDFWRU DO )$' VH SURGXFHQ $73 HQ OD FDGHQD UHVSLUDWRULD /D HQ]LPD XVD )$' SRUTXH OD HQHUJtD DVRFLDGD D OD UHDFFLyQ QR HV VXILFLHQWH SDUD UHGXFLU DO 1$' (O FRPSOHMR HQ]LPiWLFR GH OD VXFFLQDWR GHVKLGURJHQDVD HV HO ~QLFR GHO FLFOR TXH HVWi DVRFLDGR D OD PHPEUDQD PLWRFRQGULDO GH HXFDULRWDV HQ OD PHPEUDQD SODVPiWLFD GH SURFDULRWDV
- 1402. ,/2 '( .5(%6 21 • 5HDFFLyQ HO IXPDUDWR VH KLGUDWD JHQHUD PDODWR /D IXPDUDVD FDWDOL]D OD DGLFLyQ GH DJXD HV GHFLU OD KLGUDWDFLyQ GHO IXPDUDWR (O SURGXFWR GH OD UHDFFLyQ HV HO PDODWR • 5HDFFLyQ HO PDODWR VH R[LGD D R[DODFHWDWR 'DGD OD QDWXUDOH]D FtFOLFD GH OD YtD ODV UHDFFLRQHV HQ VX FRQMXQWR FRQGXFHQ D OD UHJHQHUDFLyQ GHO R[DODFHWDWR /D PDODWR GHVKLGURJHQDVD FDWDOL]D OD R[LGDFLyQ GHO PDODWR D R[DODFHWDWR FRQ OD UHGXFFLyQ GH XQ 1$' VH IRUPDQ $73 HQ OD FDGHQD UHVSLUDWRULD 5HJXODFLyQ GHO LFOR GH .UHEV /D UHJXODFLyQ GHO FLFOR KDFH SRVLEOH OD SURGXFFLyQ GH PROpFXODV GH DFXHUGR D ODV QHFHVLGDGHV FHOXODUHV DVHJXUD TXH QR RFXUUD VREUH R VXE SURGXFFLyQ HQ XQ PRPHQWR GDGR /D UHJXODFLyQ GHO FLFOR VH GD HQ GLIHUHQWHV SXQWRV SRUTXH SXHGH DOLPHQWDUVH R VHU DEDVWHFLGR D WUDYpV GH FXDOTXLHUD GH VXV LQWHUPHGLDULRV /D UHJXODFLyQ HV FRPSOHMD HQ FRPSDUDFLyQ FRQ OD GH YtDV FDWDEyOLFDV FRPR OD JOXFyOLVLV VH FRQVLGHUDUiQ VLWXDFLRQHV GH UHJXODFLyQ UHODFLRQDGDV DO HVWDGR HQHUJpWLFR FHOXODU • /D UHJXODFLyQ GH ODV HQ]LPDV HV SRU PRGXODFLyQ DORVWpULFD SRU PRGLILFDFLyQ FRYDOHQWH SRU DFXPXODFLyQ GH SURGXFWRV /D ³OyJLFD´ GH OD UHJXODFLyQ VH ULJH SULQFLSDOPHQWH SRU OD UHODFLyQ $73$'3 1$'++1$' DVt FRPR SRU ODV FRQFHQWUDFLRQHV GH DOJXQRV LQWHUPHGLDULRV GHO FLFOR • /DV UHODFLRQHV HQWUH $73$'3 1$'++1$' HVWiQ UHODFLRQDGDV HQWUH Vt D WUDYpV GH OD IRVIRULODFLyQ R[LGDWLYD TXH RFXUUH HQ OD FDGHQD UHVSLUDWRULD DPEDV VRQ VHxDOHV GHO HVWDGR HQHUJpWLFR GH OD FpOXOD $ FRQWLQXDFLyQ VH SUHVHQWDQ WUHV VLWXDFLRQHV UHJXODWRULDV UHODFLRQDGDV D OD HQHUJtD FHOXODU PRPHQWiQHD 6LWXDFLyQ UHJXODFLyQ GH OD SULQFLSDO UHDFFLyQ DEDVWHFHGRUD GHO FLFOR (O FRPSOHMR SLUXYDWR GHVKLGURJHQDVD 3'+
- 1403. GH YHUWHEUDGRV TXH FDWDOL]D OD WUDQVIRUPDFLyQ GH SLUXYDWR HQ DFHWLOR$ HV XQ SXQWR GH UHJXODFLyQ FODYH SRUTXH OD DFHWLOR$ HV OD SULQFLSDO PROpFXOD DEDVWHFHGRUD GHO FLFOR /D UHJXODFLyQ VH ORJUD SRU GRV PHFDQLVPRV DORVWHULVPR PRGLILFDFLyQ FRYDOHQWH GH OD HQ]LPD
- 1404. ,/2 '( .5(%6 22 )LJXUD (VTXHPD GH OD UHJXODFLyQ GH OD DFWLYLGDG GH OD SLUXYDWR GHVKLGURJHQDVD 3'+
- 1405. D WUDYpV GH OD IRVIRULODFLyQGHVIRVIRULODFLyQ GH VHULQDV GH OD VXEXQLGDG ( GH HVWD HQ]LPD /D TXLQDVD HV LQKLELGD DORVWpULFDPHQWH SRU HO $73 GH PDQHUD TXH FXDQGR ORV QLYHOHV GH HVWH VRQ HOHYDGRV HO FRPSOHMR 3'+ HV LQDFWLYDGR SRU IRVIRULODFLyQ XDQGR GHVFLHQGH OD FRQFHQWUDFLyQ GH $73 FHOXODU OD DFWLYLGDG TXLQDVD GHFUHFH OD DFWLYLGDG IRVIDWDVD VH LQFUHPHQWD HOLPLQD HO IRVIDWR GH OD VXEXQLGDG ( FRQYLUWLHQGR D OD HQ]LPD HQ VX HVWDGR DFWLYR • XDQGR ODV UHODFLRQHV $73$'3 1$'++ 1$' DFHWLOR$ +6R$ VRQ DOWDV OD HQ]LPD 3'+ HV PRGXODGD QHJDWLYDPHQWH XDOTXLHUD GH ODV WUHV UHODFLRQHV LQGLFDQ TXH HQ OD FpOXOD KD XQ HVWDGR PHWDEyOLFR ULFR HQ HQHUJtD XDQGR HVDV UHODFLRQHV GHVFLHQGHQ OD HQ]LPD VH DFWLYD VH LQFUHPHQWD HQWRQFHV OD R[LGDFLyQ GHO SLUXYDWR VH VLQWHWL]D DFHWLO R$ • /D UHJXODFLyQ GH OD 3'+ D WUDYpV GH OD VXEXQLGDG ( ILJXUD
- 1406. HV SRU PRGLILFDFLyQ FRYDOHQWH GH OD HQ]LPD D OD TXH XQD TXLQDVD IRVIRULOD XQD IRVIDWDVD GHVIRVIRULOD UHVLGXRV HVSHFtILFRV GH VHULQDV 3DUD TXH OD TXLQDVD IRVIRULOH D ( GHEH KDEHU DOWD FRQFHQWUDFLyQ GH $73 TXH HV XQ PRGXODGRU SRVLWLYR GH OD TXLQDVD TXH HVWi UHJXODGD HQWRQFHV DORVWpULFDPHQWH XDQGR DXPHQWD OD FRQFHQWUDFLyQ GH $'3 OD DFWLYLGDG TXLQDVD GHVFLHQGH VH LQFUHPHQWD OD IRVWDWDVD TXH GHVIRVIRULOD D OD HQ]LPD TXH SDVD D VX IRUPD DFWLYD ILJXUD
- 1407. • $GHPiV OD DFWLYLGDG GHO FRPSOHMR 3'+ HVWi PRGXODGD QHJDWLYDPHQWH D QLYHO GH OD VXEXQLGDG ( SRU DOWD FRQFHQWUDFLyQ GH DFHWLOR$ D QLYHO GH OD VXEXQLGDG ( SRU DOWD FRQFHQWUDFLyQ GH 1$'++ (V GHFLU WDPELpQ HVWi UHJXODGR DORVWpULFDPHQWH D WUDYpV GH GLVWLQWRV PRGXODGRUHV FRQ GLIHUHQWHV VXEXQLGDGHV 6LWXDFLyQ UHJXODFLyQ GH OD HQ]LPD FLWUDWR VLQWDVD /D DFWLYLGDG GH OD FLWUDWR VLQWDVD UHDFFLyQ ILJXUD
- 1408. HVWi UHJXODGD SRU GLVSRQLELOLGDG GH VXV VXVWUDWRV OD DFHWLOR$ HO R[DODFHWDWR FXD FRQFHQWUDFLyQ YDUtD GHWHUPLQD OD YHORFLGDG GH IRUPDFLyQ GH FLWUDWR (O $73 HV XQ PRGXODGRU DORVWpULFR QHJDWLYR GH OD FLWUDWR VLQWDVD TXH DXPHQWD OD .0 GH OD HQ]LPD SRU HO DFHWLO R$ $Vt FXDQWR PDRU VHD OD FRQFHQWUDFLyQ GH $73 PHQRU VHUi OD DFWLYLGDG GH OD HQ]LPD /R PLVPR SURGXFH HO DXPHQWR GH OD FRQFHQWUDFLyQ GH 1$'++ ILJXUD
- 1409. 6LWXDFLyQ UHJXODFLyQ GH ODV GHVKLGURJHQDVDV 1$' /RV SDVRV FDWDOL]DGRV SRU ODV GHVKLGURJHQDGDV 1$' GHSHQGLHQWHV UHDFFLRQHV ILJXUD
- 1410. UHJXODQ OD YHORFLGDG GHO FLFOR VHJ~Q OD UHODFLyQ 1$'++1$' XDQGR OD FRQFHQWUDFLyQ GH 1$'++ DXPHQWD OD DFWLYLGDG GH ODV GHVKLGURJHQDVDV GHVFLHQGH (O $73 WLHQH HO PLVPR HIHFWR LQKLELGRU VREUH ODV HQ]LPDV PLHQWUDV HO $'3 HV XQ DFWLYDGRU ILJXUD
- 1411. (Q UHVXPHQ VL ELHQ QR HV HO ~QLFR KD XQ SULQFLSLR XQLILFDGRU HQ OD UHJXODFLyQ FXDQGR D QLYHO FHOXODU VH GDQ FRQGLFLRQHV GH DOWD HQHUJtD OD FpOXOD HV FDSD] GH UHGXFLU OD HILFLHQFLD GHO SURFHVR GH SURGXFFLyQ GH $73 YLFHYHUVD ILJXUD
- 1412. ,/2 '( .5(%6 23 )LJXUD (VTXHPD JHQHUDO GH UHJXODFLyQ GHO FLFOR GH .UHEV 7RPDGR GH %LRTXtPLFD 0DWKHZV YDQ +ROGH (GLWRULDO 0F*UDZ +LOO ± ,QWHUDPHULFDQD 8Q EDODQFH SRVLEOH GH OD GHJUDGDFLyQ WRWDO GH OD JOXFRVD 3DUD FDOFXODU OD HQHUJtD TXH VH REWLHQH GH OD JOXFRVD VH SXHGHQ HVWDEOHFHU FXDWUR LQVWDQFLDV HQ VX GHJUDGDFLyQ JOXFyOLVLV GHFDUER[LODFLyQ R[LGDWLYD GHO SLUXYDWR FLFOR GH .UHEV FDGHQD UHVSLUDWRULD /D FDQWLGDG GH $73 JHQHUDGR GLILHUH VHJ~Q ODV ODQ]DGHUDV LPSOLFDGDV HO WLSR GH FpOXOD SURFDULRWD R HXFDULRWD
- 1413. (Q HO FXDGUR VH SODQWHD XQ EDODQFH HQ XQD FpOXOD HXFDULRWD HQ OD TXH RSHUy VyOR OD ODQ]DGHUD GHO JOLFHURO IRVIDWR 7DEOD 5HVXPHQ GHO EDODQFH HQHUJpWLFR HQ $73 GH OD GHJUDGDFLyQ WRWDO GH OD JOXFRVD 6H XVy SDUD HVWH EDODQFH OD ODQ]DGHUD GHO JOLFHURO IRVIDWR
- 1414. 1 SSÍÍNNTTEESSIISS DDEE PPRROOTTEEÍÍNNAASS La información genética del ADN debe descodificarse para poder ser utilizada por la célula, ya que el ADN como tal tiene una escasa acción sobre el funcionamiento de los organismos: los genes no transportan oxígeno, no catalizan reacciones para obtener energía, ni destruyen a los gérmenes invasores… lo hacen las proteínas que se sintetizan a partir de dichos genes. Los genes que formarán proteínas se denominan genes estructurales, se transcriben y se traducen, produciendo ARNm. No obstante, no todos los genes almacenan información para sintetizar proteínas, algunos se transcriben pero no se traducen dando lugar a moléculas de ARNr y ARNt, colaboradores del proceso de biosíntesis proteica. Además, existen secuencias génicas reguladoras, que ni se transcriben ni se traducen, pero son de gran importancia ya que actúan como signos de puntuación, indicando donde se debe comenzar a transcribir el gen y dónde debe finalizar la lectura. Los avances en las distintas ramas de la biología permitieron a Francis Crick enunciar en 1970 el DOGMA CENTRAL DE LA BIOLOGÍA MOLECULAR: De manera que la información genética contenida en el ADN se mantiene mediante su capacidad de replicación. La información contenida en el ADN se expresa dando lugar a proteínas, mediante los procesos de transcripción, paso por el que la información se transfiere a una molécula de ARN mensajero y, mediante el proceso de la traducción el mensaje transportado por el ARN-m se traduce a proteína. Este esquema central de flujo de la información pronto fue modificado, ya que en algunos virus cuyo material hereditario es ARN, la información se mantiene mediante replicación del ARN. Además, también se comprobó que la información no va siempre del ADN hacia el ARN (ADN→ARN), en algunos casos se puede sintetizar ADN tomando como molde (ARN→ADN), es decir, teniendo lugar el fenómeno de la transcripción inversa. Los priones (partícula proteinácea infecciosa) son proteínas, carentes, por tanto, de información genética codificada por medio de ácidos nucleicos. Interaccionan con otras proteínas similares a él, cambiándoles de forma externa, las induce a adoptar la forma anómala del prión, mediante un mecanismo todavía desconocido. Todo ello en una acción en cadena que acaba por destruir la operatividad de todas las proteínas sensibles.
- 1415. 2 CCAARRAACCTTEERRÍÍSSTTIICCAASS DDEE LLAA EEXXPPRREESSIIÓÓNN GGÉÉNNIICCAA En líneas generales, la expresión de los genes es un proceso universal característico de todos los seres vivos, pero existen algunas diferencias entre células eucariotas y procariotas: ƒ EL ADN de procariotas tiene bajo grado de empaquetamiento siendo de fácil acceso para la transcripción, mientras que en eucariotas está asociado a histonas para formar la cromatina y debe desempaquetarse para acceder a él, por lo tanto es de difícil acceso. ƒ En procariotas hay un solo tipo de ARN polimerasa para la síntesis de las tres clases de ARN. Sin embargo, en eucariontes hay diferentes polimerasas encargadas de sintetizar los distintos tipos de ARN. o ARN polimerasa I: sintetiza ARN-r. o ARN polimerasa II: síntesis de ARN-m. o ARN polimerasa III: síntesis de ARN-t y otros ARN de pequeño tamaño. Las ARN polimerasas, a diferencia de lo que ocurre con las ADN polimerasas, carecen de función correctora de pruebas. Esta diferencia se debe, en primer lugar, a que los transcritos son cortos y la probabilidad de que uno de los ARN posea una alteración es baja, y en segundo lugar, a que la vida media de los ARN es corta y pronto se vuelve a sintetizar otro ARN nuevo. Por consiguiente el que exista un ARN con una alteración no es grave ya que durará poco y será remplazado pronto por otro nuevo sin la alteración. Sin embargo, un error en la replicación del ADN puede transmitirse a todas las células que deriven por división de la célula afectada. ƒ Los procariotas carecen de núcleo, por lo que la transcripción y la traducción tienen lugar en el citoplasma bacteriano y al mismo tiempo, son simultáneas. Sin embargo, en eucariotas la transcripción tiene lugar en el núcleo y después en el citoplasma sucede la traducción. ƒ Casi todos los genes de procariotas son policistrónicos, de manera que se transcriben en una larga cadena de ARNm que contiene información para la síntesis de varios polipéptidos distintos.
- 1416. 3 En eucariontes los ARN-m son monocistrónicos, de manera que un ARN-m contiene información para sintetizar un solo polipéptido. ƒ Los genes procariotas son unidades continuas que contienen toda la información necesaria para la síntesis de las proteínas; sin embargo en los eucariotas, los genes se encuentran fragmentados: cada gen consta de segmentos con información llamados exones (se transcriben y se traducen) y segmentos sin información llamados intrones (se transcriben pero no se traducen). TTRRAANNSSCCRRIIPPCCIIÓÓNN La transcripción consiste en la síntesis de ARN tomando como molde ADN y significa el paso de la información contenida en el ADN hacia el ARN. La transferencia de la información del ADN hacia el ARN se realiza siguiendo las reglas de complementariedad de las bases nitrogenadas. El ARN producto de la transcripción recibe el nombre de transcrito. Este proceso lo realiza una ARN polimerasa que tienen los siguientes requerimientos: ƒ Une nucleótidos mediante enlace fosfodiéster, en sentido 5’Æ 3’. ƒ Utiliza nucleótidos trifosfato. ƒ Se fija a regiones específicas del ADN, llamadas regiones promotoras, para comenzar su acción a partir de ese punto. ƒ Necesitan una molécula de ADN que utilizar como molde para realizar la síntesis de ARN. La hebra molde será siempre la hebra de dirección 3’Æ5’, a la otra (5’Æ3’) se le denomina hebra informativa. TTRRAANNSSCCRRIIPPCCIIÓÓNN EENN PPRROOCCAARRIIOOTTAASS Como hemos mencionado anteriormente, en las células procariotas existe una única ARN polimerasa. Ésta, para poder reconocer a la secuencia promotora del ADN, donde debe comenzar la trascripción tiene que unirse al factor1 sigma, tras lo cual cambia de conformación y puede unirse a la región promotora, una secuencia rica en bases de T y A (TATAATG). Una vez realizada la unión, el factor se separa, listo para volver a comenzar. La ARN polimerasa fijada en el ADN produce el desenrollamiento de una vuelta de la hélice y comienza la síntesis de ARN en dirección 5’Æ3’. La síntesis termina cuando la ARN polimerasa llega a una zona del ADN denominada señal de terminación, que tienen 1 Un factor de transcripción es una proteína que participa en la regulación de la transcripción del ADN, pero que no forma parte de la ARN polimerasa.
- 1417. 4 una secuencia rica en G y C. En esta fase intervienen el factor rho, una enzima con actividad ATPasica, que reconoce esta secuencia. La transcripción tiene lugar en los procariotas en el citoplasma, y una vez formado este ARNm puede comenzar la traducción, de hecho, antes de que termine la transcripción puede comenzar la traducción, ya que el ARNm no necesita maduración y el compartimento de síntesis es el mismo. TTRRAANNSSCCRRIIPPCCIIÓÓNN EENN EEUUCCAARRIIOOTTAASS INICIACIÓN. Para la síntesis de ARNm existen dos señales de inicio denominadas secuencias de consenso en una región del ADN denominada región promotora: la TATA, a 25 pares de bases del inicio de la transcripción hacia el extremo 5’, y la CAAT, algo más alejada. En lugar del factor sigma, existen otros factores que ayudan a la localización y unión de la enzima al promotor, denominadas factores basales. ALARGAMIENTO. El proceso de síntesis continúa en sentido 5’ Æ3’. Al cabo de 30 nucleótidos transcritos se añade al extremo 5’ una caperuza de 7-metil- guanosín-trifosfato, que protege al ARNm de su degradación y es lugar de reconocimiento para el inicio de la traducción. La FINALIZACIÓN de la síntesis del ARNm parece ser que está relacionada con la secuencia TTATTT. A continuación interviene la enzima poli.A-polimerasa que añade al extremo final 3’ un segmento de unos 200 ribonucleótoidos de adenina, denominado cola de poli-A. Interviene en la maduración posterior y en su transporte desde el núcleo. MADURACIÓN. Se debe producir la eliminación de los intrones y la posterior unión de los exones. En este
- 1418. 5 proceso intervienen un conjunto de ribonucleoproteínas pequeñas nucleares (RNPpn), denominadas en su conjunto, espliceosoma. Reconocen a los intrones que suelen empezar por GU y acabar por AG, los corta y los retira. A continuación actúan ARN ligasas que empalman exones. Puede darse la unión de los exones consecutivos como se encontraban en el gen, o hacerlo en una ordenación alternativa. Asimismo, puede producirse la eliminación o introducción de bases, o transformación de unas bases en otras. Todo ello produce una amplificación de la expresión génica, ya que un solo gen puede dar lugar a proteínas distintas según la maduración post-transcripcional que se lleve a cabo. RREETTRROOTTRRAANNSSCCRRIIPPCCIIÓÓNN OO TTRRAANNSSCCRRIIPPCCIIÓÓNN IINNVVEERRSSAA Se creía que no se podía violar el dogma central de la biología molecular y que, por tanto, la información solo fluía desde el ADN, pero se descubrió que los virus de ARN, como el del SIDA, eran capaces de invertir el flujo de la información genética al sintetizar ADN a partir del ARN vírico mediante una enzima llamada transcriptasa inversa o retrotranscriptasa. Los retrovirus, entre los que se encuentra el virus del SIDA, se caracterizan porque su genoma está constituido por una o más cadenas de ARN sencillas que tienen la información necesaria para construir nuevos virus; además, tienen la particularidad de llevar una doble vida: unas veces con ARN y otras con ADN. Como todos los virus, carecen de la maquinaria enzimática necesaria que les permita sintetizar sus propios componentes, de ahí que deban infectar una célula. Se pueden encontrar en forma de virus infectantes de vida libre, constituidos por una envoltura proteica o cápsida en cuyo interior se aloja la hebra de ARN junto con la enzima retrotranscriptasa. Y también adoptan la estructura de provirus, formados por una doble hebra de ADN que está integrada en un cromosoma de la célula infectada como si fuera uno más de sus genes.
- 1419. 6 CCiicclloo vviittaall ddee uunn rreettrroovviirruuss ƒ El retrovirus (en la forma de virus infectante) penetra en la célula mediante un proceso de endocitosis. ƒ Una vez en su interior, se despoja de su cápsida proteica y quedan libres las dos hebras de ARN y las enzimas retrotranscriptasas que transportan. ƒ Cada retrotranscriptasa utiliza una cadena de ARN como molde para sintetizar una secuencia de ADN complementaria, que forma un híbrido con el ARN. Después la retrotranscriptasa degrada la hebra de ARN y sintetiza otra cadena de ADN complementaria a la sintetizada anteriormente. ƒ Se forma una doble hélice de ADN vírico, que se integra en el genoma de la célula hospedadora y se convierte en provirus. ƒ Una vez integrado en el cromosoma celular el provirus se comporta como un gen más, utiliza la maquinaria celular para replicar, transcribir y traducir sus genes que dan lugar a nuevas copias de ARN vírico, proteínas de la cápsida, de la envoltura y enzimas retrotranscriptasas. ƒ Los componentes víricos se ensamblan y los retrovirus abandonan las células por gemación para volver a la vida libre pudiendo infectar a otras células.
- 1439. %LRORJtD ž (62 'LYLVLyQ HOXODU 0LWRVLV (/ ,/2 '( /$ ',9,6,Ï1 (/8/$5 /DV FpOXODV FUHFHQ VH GLYLGHQ PHGLDQWH XQD VHULH UHSHWLGD GH HYHQWRV OODPDGRV FLFORV GH GLYLVLyQ FHOXODU R FLFOR FHOXODU
- 1440. 'XUDQWH OD IDVH SULPHUD *
- 1441. OD FpOXOD FUHFH VH SUHSDUD SDUD OD UHSOLFDFLyQ GH $'1 TXH RFXUUH HQ OD VXEVLJXLHQWH IDVH 6 (O FUHFLPLHQWR WLHQH OXJDU HQ OD IDVH * ILQDOPHQWH PLWRVLV RFXUUH HQ OD IDVH 0 ,QWHUIDVH RPSUHQGH ODV IUDVHV * 6 * • * )DVH GH SUHVtQWHVLV GH PDWHULDO FHOXODU • 6 )DVH GH VtQWHVLV GH PDWHULDO FHOXODU • * )DVH GH SRVWVtQWHVLV GH PDWHULDO FHOXODU 0LWRVLV FLWRFLQHVLV FRPSUHQGH OD IDVH 6 • )DVH 6 )DVH GH UHSDUWR GLYLVLyQ
- 1442. GH PDWHULDO FHOXODU
- 1443. %LRORJtD ž (62 'LYLVLyQ HOXODU 0LWRVLV ,17(5)$6( /D FpOXOD VH SUHSDUD SDUD LQLFLDU OD PLWRVLV • /RV FURPRVRPDV TXH VH GXSOLFDURQ HQ OD IDVH 6 HVWiQ WDQ HPSDTXHWDGRV FURPDWLQD
- 1444. TXH QR SXHGHQ YHUVH LQGLYLGXDOPHQWH QR VRQ REVHUYDEOHV DO PLFURVFRSLR
- 1445. • )XHUD GHO Q~FOHR GH ODV FpOXODV DQLPDOHV WHQHPRV GRV FHQWURVRPDV TXH FRQWLHQHQ XQ SDU GH FHQWULRORV /RV GRV FHQWURVRPDV VRQ SURGXFLGRV SRU OD GXSOLFDFLyQ GH XQ VROR FHQWURVRPD HQ OD LQWHUIDVH WHPSUDQD ),1$/ '( /$ ,17(5)$6( • /RV FURPRVRPDV TXH VH GXSOLFDURQ HQ OD IDVH HVWiQ WDQ H[WHQGLGRV TXH QR SXHGHQ YHUVH LQGLYLGXDOPHQWH • )XHUD GHO Q~FOHR GH ODV FpOXODV DQLPDOHV WHQHPRV GRV FHQWURVRPDV TXH FRQWLHQHQ XQ SDU GH FHQWULRORV /RV GRV FHQWURVRPDV VRQ SURGXFLGRV SRU OD GXSOLFDFLyQ GH XQ VROR FHQWURVRPD HQ OD LQWHUIDVH WHPSUDQD HQWURVRPDV VLUYHQ FRPR FHQWURV RUJDQL]DGRUHV GH PLFURW~EXORV 20
- 1446. /RV PLFURW~EXORV VH H[WLHQGHQ GH ORV FHQWURVRPDV UDGLDOPHQWH SDUD IRUPDU XQ DVWHU
- 1447. %LRORJtD ž (62 'LYLVLyQ HOXODU 0LWRVLV • /DV FpOXODV YHJHWDOHV QR WLHQHQ FHQWURVRPDV 'LIHUHQWHV FODVHV GH PLFURW~EXORV IXQFLRQDQ FRPR VLWLRV GH IRUPDFLyQ GH KXVRV 0,726,6 • /D PLWRVLV GLYLVLyQ GHO Q~FOHR
- 1448. HV XQ SURFHVR FRQWLQXR TXH FRQVLVWH HQ YDULDV IDVHV SURIDVH PHWDIDVH DQDIDVH WHORIDVH • /D GLYLVLyQ FHOXODU TXH VLJXH VH OODPD FLWRFLQHVLV GLYLVLyQ GHO FLWRSODVPD
- 1449. (VWXGLDPRV OD PLWRVLV HQ XQD FpOXOD DQLPDO GLSORLGH 1
- 1450. FRQ GRV SDUHV GH FURPRVRPDV 3URIDVH /RV FURPRVRPDV VH KDFHQ YLVLEOHV HO QXFOpROR GHVDSDUHFH HO KXVR PLWyWLFR VH IRUPD OD PHPEUDQD QXFOHDU GHVDSDUHFH • /RV FURPRVRPDV VH GHVKLGUDWDQ SXHGHQ VHU YLVWRV DO PLFURVFRSLR • DGD FURPRVRPD GXSOLFDGR VH YH FRPR XQ SDU GH FURPiWLGDV KHUPDQDV XQLGDV SRU HO GXSOLFDGR SHUR QR VHSDUDGR FHQWUyPHUR • (O QXFOpROR GHVDSDUHFH GXUDQWH HVWD IDVH • (Q HO FLWRSODVPD VH IRUPD HO KXVR PLWyWLFR D H[SHQVDV GH ORV PLFURW~EXORV GH ORV GRV SDUHV GH FHQWULRORV DO WLHPSR TXH HVWRV HPLJUDQ D ORV SRORV GH OD FpOXOD • /D PHPEUDQD QXFOHDU GHVDSDUHFH DO ILQDO GH OD SURIDVH (VWR GD OD VHxDO SDUD HO LQLFLR GH OD VLJXLHQWH IDVH OD PHWDIDVH
- 1451. %LRORJtD ž (62 'LYLVLyQ HOXODU 0LWRVLV 0HWDIDVH /RV FURPRVRPDV VH RUGHQDQ HQ OD SODFD GH OD PHWDIDVH VH XQHQ DO D FRPSOHWDPHQWH IRUPDGR KXVR • /RV FHQWURVRPDV HVWiQ HQ ORV SRORV RSXHVWRV GH OD FpOXOD • /RV FURPRVRPDV HVWiQ DOWDPHQWH HQUROODGRV FRQGHQVDGRV VH GLVSRQHQ DOLQHDQ
- 1452. HQ XQ SODQR HTXLGLVWDQWH GH ORV GRV SRORV GH OD FpOXOD FRQVWLWXpQGRVH OD OODPDGD SODFD HFXDWRULDO GH OD PHWDIDVH $QDIDVH /DV FURPiWLGDV KHUPDQDV VH VHSDUDQ ODV QXHYDV FURPRVRPDV KHUPDQDV VH PXHYHQ D ORV SRORV RSXHVWRV GH OD FpOXOD • /D DQDIDVH FRPLHQ]D FXDQGR ORV FHQWUyPHURV GXSOLFDGRV GH FDGD SDU GH ODV FURPiWLGDV KHUPDQDV VH VHSDUDQ ODV QXHYRV FURPRVRPDV KHUPDQRV VH YDQ PRYLHQGR D ORV SRORV RSXHVWRV GH OD FpOXOD GHELGR D OD DFFLyQ GH KXVR
- 1453. %LRORJtD ž (62 'LYLVLyQ HOXODU 0LWRVLV • $O ILQDO GH OD DQDIDVH XQ MXHJR FRPSOHWR GH FURPRVRPDV Q
- 1454. VH DJUXSD HQ FDGD SROR GH OD FpOXOD 7HORIDVH /RV MXHJRV GH FURPRVRPDV VH DJUXSDQ HQ ORV SRORV RSXHVWRV OD PHPEUDQD QXFOHDU VH YXHOYH D IRUPDU DOUHGHGRU GH FDGD MXHJR OD FLWRFLQHVLV GLYLVLyQ GHO FLWRSODVPD
- 1455. VLJXH JHQHUDOPHQWH • /RV MXHJRV GH FURPRVRPDV VH DJUXSDQ HQ ORV GRV SRORV • /RV FURPRVRPDV HPSLH]DQ D GHVHQUROODUVH HYHQWXDOPHQWH DVXPHQ HO DVSHFWR H[WHQGLGR FDUDFWHUtVWLFR GH OD LQWHUIDVH • 8QD PHPEUDQD QXFOHDU VH YXHOYH D IRUPDU DOUHGHGRU GH FDGD MXHJR GH FURPRVRPDV HO KXVR GHVDSDUHFH VH IRUPD HO QXFOpROR /D GLYLVLyQ QXFOHDU SRU PLWRVLV HVWD FRPSOHWD HQ HVWH SXQWR • (Q OD FLWRFLQHVLV OD GLYLVLyQ GHO FLWRSODVPD XVXDOPHQWH HVWi HQ SURJUHVR DQWHV GH TXH OD GLYLVLyQ QXFOHDU VH FRPSOHWH (Q ODV FpOXODV DQLPDOHV OD FLWRFLQHVLV LQYROXFUD D OD IRUPDFLyQ GH XQD KHQGLGXUD R VXUFR UHVXOWDQWH GH OD GLYLVLyQ GH OD FpOXOD HQ GRV
- 1456. %LRORJtD ž (62 'LYLVLyQ HOXODU 0LWRVLV LWRFLQHVLV HQ FpOXODV YHJHWDOHV /DV FpOXODV YHJHWDOHV WLHQHQ SDUHGHV FHOXODUHV SRU WDO UD]yQ OD FLWRFLQHVLV QR VH OOHYD D FDER FRQ XQD KHQGLGXUD HQ OD SDUWH FHQWUDO GH OD FpOXOD TXH DFDED HQ XQ HVWUDQJXODPLHQWR OR TXH RFXUUH HQ OD FpOXOD DQLPDO
- 1457. (Q VX OXJDU GXUDQWH OD WHORIDVH VH IRUPD XQD SODFD D WUDYpV GH OD FpOXOD HQ HO OXJDU GH OD SODFD GH OD PHWDIDVH • 'XUDQWH OD WHORIDVH YHVtFXODV PHPEUDQRVDV GHULYDGDV GHO DSDUDWR GH *ROJL HPLJUDQ GH HO GHQWUR GH OD FpOXOD GRQGH HVWXYR OD SODFD HFXDWRULDO GH OD PHWDIDVH VH IXVLRQDQ SDUD IRUPDU XQD SODFD FHOXODU • (YHQWXDOPHQWH HO FUHFLPLHQWR GH OD SODFD FHOXODU VH IXVLRQD FRQ OD PHPEUDQD SODVPiWLFD SURGXFLHQGR GRV FpOXODV KLMDV FDGD XQD FRQ VX SURSLD PHPEUDQD • 8QD QXHYD SDUHG FHOXODU VH IRUPD HQWUH ODV GRV PHPEUDQDV GH OD SODFD FHOXODU
- 1458. m e i o s i s n nn nn 2 n2n 22+ Y22 + Y 22 + Y22 + Y 22 + Y22 + Y 44 + XY44 + XY nn nn nn 22 + X22 + X 22 + X22 + X 22 + X22 + X La meiosis es un proceso de división celular por el que a partir de una célula madre diploide (2n) se obtienen cuatro células hijas haploides (n) Durante la meiosis se producen dos divisiones celulares consecutivas conocidas como meiosis I y meiosis II. La primera de las divisiones, que es más compleja que la segunda, es una división reduccional en la cual se pasa de una célula diploide (con 2n cromosomas) a dos células haploides (con n cromosomas) cada una de ellas con 2n cromátidas. La segunda división es mucho más sencilla y similar a una división mitótica, y en ella a partir de las dos células haploides (n) anteriormente formadas se obtienen cuatro células haploides (n) con n cromátidas cada una de ellas. Las únicas células que sufren el proceso meiótico son las de la linea germinal, es decir, aquellas que van a formar los gametos masculinos y femeninos. En la fotografía se pueden ver los conductos seminíferos de los testículos con las células germinales. FASE S Antes de comenzar la meiosis el material genético de la célula sufre un proceso de replicación (duplicación del ADN), con lo que cada cromosoma pasa a tener dos cromátidas hermanas (las cromátidas hermanas son copias exactas entre sí). En esta fase también se produce un rejuvenecimiento del citoplasma y de los orgánulos celulares. Además un pequeño porcentaje de los cromosomas (aproximadamente el 2%) queda sin replicarse. A diferencia de lo que ocurre durante la mitosis, en este caso tras la fase de síntesis de ADN (S) no tiene lugar una fase G2, con lo que una vez concluida la fase S comienza directamente la división meiótica. 2n = 4 cromosomas Cromátidas hermanas PROFASE I Leptoteno Durante toda la profase I la membrana nuclear permanece inalterada. En el leptoteno los cromosomas comienzan a condensarse pero mantienen sus telómeros unidos a la membrana nuclear. A lo largo de los cromosomas van apareciendo unos pequeños engrosamientos denominados cromómeros. En este momento de la profase I sólo es posible visualizar una de las dos cromátidas hermanas de cada cromosoma debido a que ambas se encuentran muy próximas entre sí. No será hasta el final de la profase I cuando se puedan empezar a distinguir las dos cromátidas hermanas de cada cromosoma. En los cromosomas se puede apreciar un eje proteico que posteriormente tendrá una gran importancia en el apareamiento de los cromosomas homólogos. Eje proteico
- 1459. PROFASE I Zigoteno Los cromosomas homólogos comienzan a acercarse hasta quedar apareados en toda su longitud. Los homólogos quedan finalmente apareados cromómero a cromómero. La disposición de los cromómeros a lo largo del cromosoma parece estar determinado genéticamente. Tal es así que incluso se utiliza la disposición de estos cromómeros para poder distinguir cada cromosoma durante la profase I meiótica. Los cromosomas homólogos se reconocen entre sí gracias a que los telómeros de éstos se encuentran anclados en regiones próximas de la membrana nuclear. Además el eje proteico central observado en el leptoteno pasa a jugar un papel importante en el apareamiento de los homólogas al formar los elementos laterales del complejo sinaptonémico, una estructura proteica con forma de escalera formada por dos elementos laterales y uno central que se van cerrando a modo de cremallera y que garantiza el perfecto apareamiento entre homólogos. En el apareamiento entre homólogos también está implicada la secuencia de genes de cada cromosoma, lo cual evita el apareamiento entre cromosomas no homólogos. Además durante el zigoteno concluye la replicación del ADN (2% restante) que recibe el nombre de zig-ADN. PROFASE I Paquiteno Una vez que los cromosomas homólogos están perfectamente apareados formando estructuras que se denominan bivalentes se produce el fenómeno de recombinación genética, esto es, el intercambio de material genético entre los cromosomas homólogas de cada pareja. La recombinación genética está mediada por la aparición entre los dos homólogas de una estructura proteica de 90 nm de diámetro llamada nódulo de recombinación. En él se encuentran las enzimas que median en el proceso de recombinación. Durante esta fase se produce una pequeña síntesis de ADN, que probablemente está relacionada con fenómenos de reparación de ADN ligados al proceso de recombinación. PROFASE I Diploteno Los cromosomas continúan condensándose hasta que se pueden comenzar a observar las dos cromátidas de cada cromosoma, por lo que a los bivalentes del paquiteno los podemos denominar ahora tétradas. Además en este momento se pueden observar los lugares del cromosoma donde se ha producido la recombinación. Estas estructuras en forma de X reciben el nombre quiasmas. En este punto la meiosis puede sufrir una pausa, como ocurre en el caso de la formación de los óvulos humanos. Así, la línea germinal de los óvulos humanos sufre esta pausa hacia el séptimo mes del desarrollo embrionario y su proceso de meiosis no continuará hasta alcanzar la madurez sexual. A este estado de latencia se le denomina dictiotena. Cromosoma Elemento lateral Cromosoma Elemento central Quiasmas
- 1460. PROFASE I Diacinesis Esta etapa apenas se distingue del diploteno. Podemos observar los cromosomas algo más condensados y los quiasmas. El final de la diacinesis y por tanto de la profase I meiótica viene marcado por la rotura de la membrana nuclear. Durante toda la profase I continuó la síntesis de ARN en el núcleo. Al final de la diacinesis cesa la síntesis de ARN y desaparece el nucleolo. METAFASE I Comienza con la rotura de la membrana nuclear. Se forma el huso acromático a partir de los centrosomas que se colocan en los polos de la célula. Las parejas de cromosomas homólogos se unen al huso en el centro de la célula a través de sus centrómeros. Los quiasmas son todavía visibles ANAFASE I Los cromosomas homólogos se separan y se mueven hacia polos opuestos guiados por las fibras del huso. Como consecuencia desaparecen los quiasmas. (Obsérvese que los cromosomas resultantes son cromosomas recombinantes).
- 1461. TELOFASE I Se forman dos nuevas membranas nucleares y se separan las dos nuevas células haploides (n) con 2n cromátidas cada una de ellas. Esta parte del ciclo meiótico varía de unos organismos a otros, así en algunos no se forma membrana nuclear y se pasa directamente a la segunda división meiótica. En cualquier caso lo que nunca se produce entre la primera y la segunda división meiótica es la síntesis de nuevo ADN. PROFASE II En este omento cada célula contiene un número haploide de cromosomas, cada uno de ellos con dos cromátidas. La membrana nuclear se rompe y comienza la síntesis del nuevo huso acromático. METAFASE II Los cromosomas se disponen en el centro de la célula unidos al huso por su centrómero y con cada una de las cromátidas dirigidas a polos opuestos de la célula, formando un estructura llamada placa ecuatorial.
- 1462. ANAFASE II Los centrómeros se separan y las cromátidas hermanas son arrastradas hacia polos opuestos arrastradas por las fibras del huso. TELOFASE II Se vuelven a formar los núcleos alrededor de los cromosomas situados en los polos. En esta fase también desaparece el huso acromático y los cromosomas se recondensan. Con esto se habrán formado cuatro células haploides con n cromátidas cada una de ellas. BIBLIOGRAFÍA David T. Suzuki, Anthony J. F. Griffiths, Jeffrey H. Miller, Richard C. Lewontin Genética INTERAMERICANA-McGRAW-HILL, Madrid, 1992 Anthony J. F. Griffiths, William M. Gelbart, Jeffrey H. Miller, Richard C. Lewontin Genética moderna INTERAMERICANA-McGRAW-HILL, Madrid, 2000 Bruce Alberts, Dennis Bray, Julian Lewis, Martin Raff, Keith Roberts, James D. Watson Biología molecular de le célula EDICIONES OMEGA, Barcelona, 1987 Don W. Fawcett, M.D. Tratado de Histología NTERAMERICANA-McGRAW-HILL, Madrid, 1988 Barbara Young, John W. Heath Wheater's Histología funcional HARCOURT, Madrid, 2000
- 1463. LEYES DE MENDEL Primera ley de Mendel Enunciado de la ley.- A esta ley se le llama también Ley de la uniformidad de los híbridos de la primera generación (F1). , y dice que cuando se cruzan dos variedades individuos de raza pura ambos (homocigotos ) para un determinado carácter, todos los híbridos de la primera generación son iguales. Segunda ley de Mendel Enunciado de la ley.- A la segunda ley de Mendel también se le llama de la separación o disyunción de los alelos. El experimento de Mendel. Mendel tomó plantas procedentes de las semillas de la primera generación (F1) del experimento anterior y las polinizó entre sí. Del cruce obtuvo semillas amarillas y verdes en la proporción que se indica en la . Así pues, aunque el alelo que determina la coloración verde de las semillas parecía haber desaparecido en la primera generación filial, vuelve a manifestarse en esta segunda generación. Tercera ley de Mendel Enunciado de la ley.Se conoce esta ley como la de la herencia independiente de caracteres, y hace referencia al caso de que se contemplen dos caracteres distintos. Cada uno de ellos se transmite siguiendo las leyes anteriores con independencia de la presencia del otro carácter. El experimento de Mendel. Mendel cruzó plantas de guisantes de semilla amarilla y lisa con plantas de semilla verde y rugosa ( Homocigóticas ambas para los dos caracteres). Las semillas obtenidas en este cruzamiento eran todas amarillas y lisas, cumpliéndose así la primera ley para cada uno de los caracteres
- 1464. considerados , y revelándonos también que los alelos dominantes para esos caracteres son los que determinan el color amarillo y la forma lisa. Las plantas obtenidas y que constituyen la F1 son dihíbridas (AaBb). Estas plantas de la F1 se cruzan entre sí, teniendo en cuenta los gametos que formarán cada una de las plantas y que pueden verse en la (figura izq) En el cuadro de la( figura abajo) se ven las semillas que aparecen y en las proporciones que se indica. Se puede apreciar que los alelos de los distintos genes se transmiten con independencia unos de otros, ya que en la segunda generación filial F2 aparecen guisantes amarillos y rugosos y otros que son verdes y lisos, combinaciones que no se habían dado ni en la generación parental (P), ni en la filial primera (F1). Asímismo, los resultados obtenidos para cada uno de los caracteres considerados por separado, responden a la segunda ley.
- 1465. MUTACIONES, CÓDIGO GENÉTICO Y EVOLUCIÓN I. LAS MUTACIONES De Vries en 1902 trabajando sobre la hierba del asno describió en ella fenómenos de herencia mendeliana, sin embargo de tanto en tanto aparecía una característica que no estaba ni en los padres ni en los antecesores de las plantas, dedujo de ello que estas característica surgían por un cambio el factor que determinaba el carácter (gen) y que este cambio se transmitía a la progenie como cualquier otro carácter hereditario. A este cambio lo denominó mutación y a los organismos que la mostraban mutantes, los alelos salvajes son los que están presentes en la mayoría de los individuos y dan el fenotipo esperado. Ni las leyes de Mendel ni el concepto de mutación fueron conocidos por Darwin, pero resulta claro que la combinación de características de los padres da resultados sobre los cuales puede actuar el proceso evolutivo y que las mutaciones (si bien raras) son una fuente constante de variaciones que posibilitan la evolución. Los diversos alelos existen porque cualquier gen está sometido a mutaciones, que ocurren cuando un gen cambia a una nueva forma estable y hereditaria. Las mutaciones son procesos aleatorios. Los alelos mutantes y salvajes residen en el mismo locus y se heredan de acuerdo a la genética mendeliana. Una mutación en una célula somática, puede provocar alteraciones en el organismo en el que se presente; pero desaparece en el momento en que muere el individuo en que se originó. Sin embargo, las mutaciones en las células sexuales, óvulos y espermatozoides, pueden transmitirse como rasgos hereditarios diferenciadores a los descendientes del organismo en los que tuvo lugar la mutación. Se distinguen varios tipos de mutaciones en función de los cambios que sufre el material genético. Un ejemplo clásico de mutación puntual, causante de una enfermedad es el que genera la denominada anemia falciforme. En la misma, un cambio en un solo nucléotido altera un aminoácido de la hemoglobina, proteína encargada de la fijación y transporte del oxígeno en la sangre, produciendo una modificación en la forma de la hemoglobina, que cambia la forma de los glóbulos rojos y genera una enfermedad importante en la especie humana.
- 1466. II. AGENTES MUTAGÉNICOS En la naturaleza las mutaciones se originan al azar y, aunque las causas siguen siendo inciertas, se conocen bastantes agentes externos, mutágenos, que pueden producir mutaciones como las radiaciones ambientales (agentes físicos) y sustancias químicas. Las mutaciones pueden ser causadas por agentes físicos (rayos cósmicos, radiación ultravioleta, rayos X, emisiones de productos radiactivos, etc), por agentes químicos, como muchos productos químicos mutagénicos, generados por la producción industrial, y que se encuentran frecuentemente como contaminantes atmosféricos y del agua dulce que consumimos. Los sistemas de reparación del ADN, principal herramienta de las células para controlar estas alteraciones del material genético, van perdiendo eficiencia con el proceso de envejecimiento, contribuyendo progresivamente con la edad y generando un efecto acumulativo en las células. III. MUTACIONES GÉNICAS Son las verdaderas mutaciones, porque se produce un cambio en la estructura del ADN. A pesar de todos los sistemas destinados a prevenir y corregir los posibles errores, de vez en cuando se produce alguno en la réplica, bien por colocarse una Citosina (C) en lugar de una Timina (T), o una Adenina (A) en lugar de una Guanina (G); o bien porque el mecanismo de replicación se salta algunas bases y aparece una mella en la copia. O se unen dos bases de Timina, formando un dímero.
- 1467. Aunque se trate de un cambio de un nucleótido por otro, supondrá una alteración en la secuencia de un gen, que se traduce posteriormente en una modificación de la secuencia de aminoácidos de una proteína. Al transcribirse la mutación, al menos un triplete del ARNm, se encuentra modificado y su traducción da lugar a que se incorpore un aminoácido distinto del normal en la cadena polipeptídica. Es un cambio que aunque la mayoría de las veces va a ser perjudicial, en contadas ocasiones puede provocar que mejore un gen y gracias a esta característica se sintetice una proteína distinta, que tenga propiedades distintas o participe en la formación de estructuras más eficaces. En estos casos raros, pero esenciales para la evolución de las especies, los individuos portadores de la mutación poseen ventajas adaptativas respecto a sus congéneres, por lo que el gen mutado es posible que con el tiempo, y gracias a la selección natural, sustituya al gen original en la mayoría de los individuos que componen la población. IV. MUTACIONES CROMOSÓMICAS Este tipo de mutaciones provoca cambios en la estructura de los cromosomas. Existen diferentes tipos: - Deleción: Se pierde un fragmento de cromosoma, por lo que se pierde información. - Duplicación: Se duplica un fragmento de cromosoma. No hay pérdida de información. - Adición: Se incorpora al cromosoma un grupo de nucleótidos, con lo que tampoco hay pérdida de información. - Translocación: Un fragmento de un cromosoma se une a otro cromosoma diferente con lo que puede darse el caso de tampoco se vea afectada la información. Algunos casos de síndrome de Down son translocaciones en vez de aneuploidías. - Inversión: Se da cuando un fragmento de un cromosoma invierte su sentido, con lo cual no podrá ser leído en el orden correcto, aunque si en el inverso.
- 1468. V. MUTACIONES GENÓMICAS Este tipo de mutaciones afectan a la dotación cromosómica de un individuo, es decir, los individuos que las presentan tienen en sus células un número distinto de cromosomas al que es propio de su especie. No son mutaciones propiamente dichas, porque no hay cambio de material genético, sino una aberración, la cual suele ser el resultado de una separación anormal de los cromosomas durante la meiosis, con lo que podemos encontrarnos individuos triploides (3n), tetraploides (4n), etc. Estos poliploides así formados son genéticamente muy interesantes en las plantas cultivadas. Ejemplos como formas gigantes de hortalizas (fresones, tomates, trigo, …) o frutas sin semillas (naranjas, plátanos, …) que existen en el mercado tienen este origen. En el hombre, existen varios síndromes provocados por la no separación de una pareja de cromosoma homólogos durante la meiosis, con lo cual permanecen unidos y se desplazan juntos a un mismo gameto provocando lo que se denomina trisomía, es decir un individuo con un cromosoma triplicado. Algunos ejemplos de trisomías más frecuentes, tanto en los autosomas como en los cromosomas sexuales, son las siguientes: ALTERACIONES EN LOS AUTOSOMAS SÍNDROME TIPO DE MUTACIÓN Características y síntomas de la mutación Síndrome de Down Trisomía 21 Retraso mental, ojos oblicuos, piel rugosa, crecimiento retardado Síndrome de Edwars Trisomía 18 Anomalías en la forma de la cabeza, boca pequeña, mentón huido, lesiones cardiacas. Síndrome de Patau Trisomía 13 ó 15 Labio leporino, lesiones cardiacas, polidactilia. ALTERACIONES EN LOS CROMOSOMAS SEXUALES Síndrome de Klinefelter 44 autosomas + XXY Escaso desarrollo de las gónadas, aspecto eunocoide. Síndrome del duplo Y 44 autosomas + XYY Elevada estatura, personalidad infantil, bajo coeficiente intelectual, tendencia a la agresividad y al comportamiento antisocial. Síndrome de Turner 44 autosomas + X Aspecto hombruno, atrofia de ovarios, enanismo. Síndrome de Triple X 44 autosomas + XXX Infantilismo y escaso desarrollo de las mamas y los genitales externos.
- 1469. VI. EL CÓDIGO GENÉTICO El código genético es la regla de correspondencia entre la serie de nucleótidos en que se basan los ácidos nucleicos y las series de aminoácidos (polipéptidos) en que se basan las proteínas. Es como el diccionario que permite traducir la información genética a estructura de proteína. A, T, G, y C son las letras del código genético y representan las bases nitrogenadas adenina, timina, guanina y citosina, respectivamente. Cada una de estas bases forma junto con un glúcido (pentosa: ribosa-ARN o desoxirribosa-ADN) y un grupo fosfato un nucleótidos; el ADN y el ARN son polímeros formados por nucleótidos encadenados. Cada tres nucleótidos de la cadena (cada triplete) forman una unidad funcional llamada codón. Como en cada cadena pueden aparecer cuatro nucleótidos distintos (tantos como bases nitrogenedas, que son el componente diferencial) caben 43 (es decir, 64) combinaciones o codones distintos. A cada codón le corresponde un único “significado”, que será o un aminoácido o una instrucción de “final de traducción”. Durante el proceso de traducción (síntesis de proteína) el mensaje genético es leído de una cadena de ARNm, colocando cada vez el aminoácido indicado por el codón siguiente según la regla que llamamos código genético. El código genético tiene una serie de características: - Es universal, pues lo utilizan casi todos los seres vivos conocidos. Solo existen algunas excepciones en unos pocos tripletes en bacterias. - No es ambiguo, pues cada triplete tiene su propio significado - Todos los tripletes tienen sentido, bien codifican un aminoácido o bien indican terminación de lectura. - Está degenerado, pues hay varios tripletes para un mismo aminoácido, es decir hay codones sinónimos. - Carece de solapamiento, es decir, los tripletes no comparten bases nitrogenadas. - Es unidireccional, pues los tripletes se leen en el sentido 5´ Æ 3´.
- 1470. VII. NEODARWINISMO: MUTACIONES Y DIVERSIDAD BIOLÓGICA Todos los seres vivos están sometidos durante el período de su existencia, a una serie de agentes físicos, químicos o instancias de la vida de sus células, que producen cambios en el material genético del núcleo celular. Estos cambios son: 1) Mutaciones 2) Alteraciones cromosómicas 3) Recombinación meiótica: reordenamientos que se producen regularmente durante las divisiones meióticas en la formación de los gametos. Si los cambios se producen en las células somáticas, se perderán con la muerte de la célula portadora o del individuo. Solo en aquellos casos en que la alteración se hubiera producido en una célula que participara en la formación de un gameto, tendrá posibilidades de que el cambio se transmita a un descendiente, y por tanto pueda incidir primero en la población de esa especie y eventualmente en el futuro de la especie. Según el efecto que producen existen: ƒ Mutaciones LETALES: Las que provocan la muerte de aquél que las padece. ƒ Mutaciones SILENCIOSAS: Aquellas que afectan a partes del DNA que no llevan información para fabricar proteínas. ƒ Mutaciones SIN SENTIDO: Son mutaciones en las que un codón normal se cambia por un codón de terminación, con lo que la proteína no se termina. ƒ Mutaciones RECESIVAS: Sólo se manifiestan si aparecen en homocigosis. Suelen ser la mayoría y sólo se manifiestan a partir de cruces consanguíneos. Si no existieran mutaciones, todos los individuos de la misma especie tendrían siempre los mismos genes en los mismos lugares de sus cromosomas, es decir, los cromosomas homólogos serían idénticos entre sí y a la vez idénticos a los de otros individuos de su especie. Sin embargo, las mutaciones son la principal fuente de variabilidad genética, la que hace que en un mismo lugar de dos cromosomas homólogos, lo que llamamos un locus, puedan existir dos secuencias de DNA ligeramente diferentes que, a lo mejor al expresarse no dan diferencias fenotípicas, pero puede suceder que sí. A estas dos formas moleculares de un mismo gen resultantes de una mutación les damos el nombre de alelos. La aparición de cambios en la información puede ser inocua, puede ser letal o puede ser beneficiosa si aporta al individuo alguna característica que antes no poseía y que le hace estar mejor adaptado a su medio. En este caso, este individuo será capaz de dejar más descendientes a la siguiente generación, es decir, se va a producir una selección de sus alelos para que pasen a la siguiente generación, es a lo que llamamos selección natural.
- 1471. Las mutaciones son la fuente de la variabilidad genética, y la variabilidad es la base de la evolución. Los seres vivos evolucionan porque son capaces de sobrevivir a los cambios en su medio, bien porque sea el medio el que cambie, o porque los seres vivos se desplacen a otros lugares donde el medio sea diferente. Los seres vivos poseen alelos que les posibilitan el desarrollo de determinados caracteres. Son esos caracteres los que harán que un individuo viva mejor y se reproduzca, o viva peor y no deje descendientes. Si deja descendientes está perpetuando sus alelos, si no los deja, sus alelos terminarán por extinguirse. Esta es la base de la selección natural: se seleccionan aquellos individuos cuyos caracteres les permiten estar mejor adaptados a su medio, pero lo que en realidad se está seleccionando son las combinaciones genéticas más favorables que se transmitirán a la siguiente generación a través de sus descendientes.
- 1472. BIOLOGÍA CELULAR Y TISULAR UNIDAD TEMÁTICA III NOTAS DE SISTEMA TEGUMENTARIO Y ANEXOS SISTEMA TEGUMENTARIO 9 El tegumento, compuesto de piel y sus anexos, glándulas sudoríparas y sebáceas, pelo y uñas, es el órgano más grande: constituye 16% del peso corporal. PIEL 9 Además de proporcionar un recubrimiento para la totalidad de los tejidos blandos, la piel desempeña muchas funciones adicionales que incluyen: 1) protección contra lesiones, invasión bacteriana y desecación. 2) regulación de la temperatura corporal. 3) recepción de sensaciones continúas del ambiente (tacto, temperatura y dolor). 4) excreción de las glándulas sudoríparas y 5) absorción de ka radiación UV del sol para la síntesis de vitamina D 9 Consiste en dos capas: una epidermis externa y una capa de tejido conectivo profunda, la epidermis. 9 La epidermis se compone de un epitelio escamoso estratificado con estrato corneo, derivado del ectodermo. 9 Justo abajo se encuentra la dermis, derivada del mesodermo y compuesta de tejido conectivo denso irregular colagenoso. 9 La interfaz entre la epidermis y la dermis está formada por rebordes que se interdigital con invaginaciones de la epidermis llamadas rebordes epidérmicos (papilas), que se conocen en conjunto como aparato reticular. 9 La hipodermis, un tejido conectivo laxo que contiene cantidades variables de grasa, sustenta la piel. La hipodermis no es parte de la piel sino que constituye la fascia superficial de todo el cuerpo; la grasa depositada en la fascia superficial recibe el nombre de panículo adiposo. 9 Las superficies de las yemas de los dedos de las manos y de los pies tienen rebordes y surcos alternados, bien definidos, que forman parte de asas, curvas, arcos o remolinos llamados dermatoglifos. EPIDERMIS 9 Tiene 0.07 a 0.12 mm de grosor en la mayor parte del cuerpo; y 0.8 a 1.4 mm de grosor en plantas de los pies y palmas de las manos. 9 El epitelio escamoso estratificado de la piel está compuesto de cuatro poblaciones de células: x Queratinocitos. x Melanocitos x Células de Langerhans. x Células de Merkel. QUERATINOCITOS DE LA EPIDERMIS 9 Los queratinocitos forman la población más grande de células, están dispuestas en cinco capas identificables, las células restantes están entremezclados con queratinocitos. 9 Los queratinocitos se dividen por mitosis durante la noche y conforme las nuevas células se forman, las que se sitúan arriba se empujan hacia la superficie. 9 Las células a lo largo de su diferenciación van acumulando filamentos de queratina.
- 1473. 9 La citomorfosis de los queratinocitos durante la migración de la capa basal de la epidermis a su superficie permite identificar cinco zonas de epidermis con morfologías distintas. De la capa más interna a la externa, son: 1) estrato basal (germinativo) 2) estrato espinoso 3) estrato granuloso 4) estrato lúcido y 5) estrato córneo 9 Existen dos tipos de piel de acuerdo al grosor de la epidermis. 1) La piel gruesa recubre las palmas de las manos y las plantas de los pies, se caracteriza por la presencia de las cinco capas; carece de folículos pilosos, músculos erectores del pelo y glándulas sebáceas, pero posee glándulas sudoríparas. 2) La piel delgada recubre la mayor parte del cuerpo, tiene un estrato córneo delgado y carece de estrato lúcido y estrato granuloso definidos; tiene folículos pilosos, músculos erectores del pelo, glándulas sebáceas y glándulas sudoríparas. Estrato basal (germinativo). 9 La capa más profunda de la epidermis, el estrato basal, se apoya en una lámina basal. 9 Consiste en una capa de células cuboidales a cilíndricas bajas con actividad mitótica que contienen un citoplasma basófilo y un núcleo grande. Se unen por desmosomas entre sí. 9 En el estrato basal deben ser comunes las figuras mitóticas porque esta capa es la que se encarga en parte de la renovación de células en el epitelio. La mitosis ocurre sobre todo por la noche. Estrato espinoso. 9 La capa más gruesa de la epidermis es el estrato espinoso, compuesto de células poliédricas a aplanadas. 9 Los queratinocitos localizados basalmente en el estrato espinoso también tienen actividad mitótica y los dos estratos en conjunto, suelen denominarse capa malpighiana o de Malpighi 9 Las células del estrato espinoso son más ricas en haces de filamentos intermedios (tonofilamentos), que representan citoqueratina, que las del estrato basal. 9 Conforme los queratinocitos se mueven a la superficie a través del estrato espinoso, continúan produciendo tonofilamentos, que se agrupan en haces llamados tonofibrillas; también contienen gránulos secretores citoplásmicos denominados gránulos de recubrimiento de membrana (gránulos laminares) Estrato granuloso. 9 Consiste en tres a cinco capas de queratinocitos apalnados, es la capa más superficial de la epidermis en la que las células aún tienen núcleo. 9 El citoplasma de estos queratinocitos contiene gránulos de queratohialina grandes. 9 Los gránulos de recubrimiento de membrana se liberan por exocitosis al espacio extracelular y forma láminas de sustancia rica en lípidos que actúan como una barrera impermeable. Estrato lúcido. 9 La capa delgada, clara, homogénea, de tinción ligera de células justo superficial al estrato granuloso es el estrato lúcido. 9 Sólo se encuentra en la piel gruesa. 9 Sus células carecen de organelos y núcleos, contienen filamentos de queratina agrupados y paralelos a la superficie de la piel y eleidina, un producto de transformación de la queratohialina.
- 1474. Estrato córneo. 9 La capa más superficial de la piel, se compone de numerosas capas de células queratinizadas aplanadas con un plasmalema engrosado. 9 Sus células carecen de núcleos y organelos, pero están llenas con filamentos de queratina incluidos en la sustancia amorfa. 9 Las células que se encuentran cerca de la superficie de la piel, llamadas células escamosas o córneas, pierden sus desmosomas y se descaman. NO QUERATINOCITOS EN LA PIEL x Melanocitos x Células de Langerhans. x Células de Merkel. CÉLULAS DE LANGERHANS 9 También llamadas células dendríticas por sus múltiples prolongaciones largas, representan del 2 al 4% de la población total, se localizan sobre todo en el estrato espinoso. 9 La característica más singular de las células de Langerhans son los gránulos de Birbeck (gránulos vermiformes) unidos a la membrana. 9 Las células de Langerhans se originan en la médula ósea y son parte del sistema fagocítico mononuclear, se reemplazan de manera continua por células precursoras que salen del torrente sanguíneo. 9 Las células de Langerhans funcionan en la respuesta inmunitaria. Tienen receptores de superficie celular Fc (anticuerpo) y C3 (complemento), y fagocitan y procesan antígenos extraños. 9 Las células de Langerhans migran a los ganglios linfáticos en la cercanía, donde presentan epitopos de antígenos extraños a linfocitos T; por tanto son células presentadoras de antígeno. CÉLULAS DE MERKEL 9 Las células de Merkel aparecen entre queratinocitos del estrato basal, son en especial abundantes en las yemas de los dedos y la mucosa bucal y en la base de los folículos pilosos. 9 La característica distintiva de las células de Merkel son gránulos de contenido denso que se localizan en la zona perinuclear y en las prolongaciones y cuya función aún no se aclara. 9 Nervios sensoriales amielínicos que se aproximan a las células de Merkel atraviesan la lámina basal y en consecuencia forman complejos de axones y célula de Merkel. Estos complejos pueden funcionar como mecanorreceptores. MELANOCITOS 9 Derivan de la cresta neural, se localizan entre las células del estrato basal. 9 Son células redondas o cilíndricas cuyas prolongaciones largas, ondulantes se extienden desde las áreas superficiales de las células y penetran en los espacios intercelulares del estrato espinoso. 9 La tirosinasa que el RER del melanocito elabora es empaquetada por su aparato de Golgi en gránulos ovoides, conocidos como melanosomas. 9 La enzima tirosinasa se transporta de manera preferencial a los melanosomas, donde la tirosinasa la convierte en melanina a través de una serie de reacciones que progresan por la 3,4-dihidroxifenilalanina (dopa, metildopa) y la dopaquinona. 9 La enzima tirosinasa se activa por la luz UV. 9 Los melanosomas salen de el cuerpo de la célula de los melanocitos y viajan a las puntas de sus prolongaciones dendríticas y se eliminan por pellizcamiento mediante un proceso secretor especial denominado secreción citocrina.
- 1475. 9 Un melanocito particular sirve a varios queratinocitos con los cuales se relaciona, y constituye una unidad de melanina epidérmica. 9 La diferencia en la pigmentación de la piel se relaciona más con la localización de la melanina que con el número total de melanocitos en la piel. 9 La razón de la pigmentación más oscura no se debe al número efectivo de melanocitos sino a un incremento en su actividad de tirosinasa. DERMIS O CORION 9 Es la región de la piel que se sitúa justo debajo de la epidermis, deriva del mesodermo y se divide en dos capas: superficial o capa papilar (más laxa) y la profunda, capa reticular (más densa). 9 La dermis está compuesta de tejido conectivo colagenoso denso irregular, contiene fibras de colágena I y redes de fibras elásticas, que apoyan la epidermis y unen la piel con la hipodermis subyacente. Capa papilar de la dermis. 9 La capa papilar de la dermis es donde se interdigita con la epidermis y forma los rebordes dérmicos (papilas). 9 Está compuesta de tejido conectivo laxo, con fibras de colágena tipo III y fibras elásticas. Se extiende desde la lámina basal con fibrillas de fijación, colágena tipo VII, que unen la capa papilar y la epidermis. 9 La capa papilar contiene fibroblastos, macrófagos, células plasmáticas y células cebadas, y otras células comunes del tejido conectivo. 9 En algunas papilas dérmicas se encuentran corpúsculos de Meissner encapsulados que son los mecanorreceptores especializados para responder a la deformación leve de la epidermis (son muy comunes en labios, genitales externos y pezones). 9 Otro mecanorreceptor encapsulado que se halla en la capa papilar es el bulbo terminal de Krause. (frío) Capa reticular de la dermis. 9 Se compone de tejido conectivo colagenoso denso irregular, que muestra fibras de colágena I gruesas y fibras elásticas gruesas. 9 Los intersticios de la capa reticular están llenos de proteoglucanos, con abundancia de sulfato de dermatán. 9 Contiene escasas células como: fibroblastos, células cebadas, linfocitos, macrófagos y células adiposas en superficies más profundas. 9 Las glándulas sudoríparas, las glándulas sebáceas y los folículos pilosos derivados de la epidermis invaden la dermis y la hipodermis durante la embriogénesis, donde quedan de manera permanente. 9 Asimismo en la fascia superficial se origina un grupo particular de músculos estriados localizados en la cara, partes del cuello anterior y el cuero cabelludo (músculos de la expresión facial) que se insertan en la dermis. 9 En las porciones más profundas de la dermis se hallan dos tipos de mecanorreceptrores encapsulados: x Los corpúsculos de PACCINI, que responden a la presión y las vibraciones. x Los corpúsculos de RUFFINI, que responden a fuerzas de tensión (se encuentran principalmente en las plantas de los pies).
- 1476. HISTOFISIOLOGÍA DE LA PIEL 9 La proteína estructural que los queratinocitos elaboran es queratina. 9 Las células del estrato espinosos producen y depositan la proteína involucrina, y forman los gránulos de recubrimiento de membrana, que después liberan su contenido rico en lípidos a los espacios intercelulares para formar una barrera contra la permeabilidad. 9 En el estrato granuloso las células de esta capa producen filagrina, una proteína que ayuda al ensamble de filamentos de queratina en haces aún más gruesos. 9 Las células del estrato córneo, son cáscaras duras sin vida, que carecen de organelos con haces de filamentos de queratina. 9 El factor de crecimiento epidérmico (EGF) y la interleucina (IL-1α) influyen en el crecimiento y el desarrollo de queratinocitos. 9 El factor de transformación del crecimiento (TGF) suprime la proliferación y la diferenciación de queratinocitos. GLÁNDULAS DE LA PIEL 9 Las glándulas de la piel comprenden las glándulas sudoríparas ecrinas, glándulas sudoríparas apocrinas y las glándulas sebáceas. Glándulas sudoríparas ecrinas. 9 Se localizan en la piel de la mayor parte del cuerpo. 9 Se desarrollan como invaginaciones del epitelio del reborde dérmico, crecen hacia abajo a la dermis y constituyen la superficie profunda en la porción glandular de la glándula sudorípara. 9 Excretan sudor y pueden producir hasta 10L del mismo al día bajo condiciones extremas. 9 Las glándulas sudoríparas ecrinas son glándulas tubulares espirales simples que se localizan en la profundidad de la dermis o en la hipodermis subyacente. 9 Después de la porción secretora se encuentra un conducto delgado en espiral que se abre en la superficie de la piel en un poro sudoríparo. 9 Las glándulas sudoríparas ecrinas son merocrinas (secreción por exocitosis) en cuanto al método de liberación de su producto secretor. Unidad secretoria. 9 La porción secretora de la glándula es un epitelio cilíndrico bajo simple compuesto de células claras y oscuras. Células oscuras (células mucoides). 9 Semejan un cono invertido, con su extremo ancho viendo hacia la luz. Rara vez llegan a la lámina basal 9 En el citoplasma apical de las células oscuras se localizan gránulos secretores moderadamente densos que contienen glucoproteína y la secreción que estas células liberan es de naturaleza mucoide. Células claras. 9 Tienen un área apical estrecha y una base más ancha que se extiende hasta la lámina basal. 9 No contienen gránulos secretores pero sí acumulaciones de glucógeno. 9 La secreción acuosa de estas células penetra en los canalículos intercelulares interpuestos entre las células claras adyacentes, donde se mezcla con la secreción acuosa de las células oscuras. Células mioepiteliales. 9 Rodean la porción secretora de las glándulas sudoríparas ecrinas.
- 1477. 9 El citoplasma de estas células tiene filamentos de miosina así como muchos filamentos de actina, que confieren a la célula capacidad contráctil. 9 Las contracciones de las células mioepiteliales ayudan a secretar el líquido de la glándula. Conducto. 9 El conducto de una glándula sudorípara ecrina se continúa con la unidad secretora en su base, pero se estrecha a medida que pasa a través de la dermis con rumbo a la superficie epidérmica. 9 El conducto se compone de un epitelio estratificado constituido de dos capas: o Las células de la capa basal. o Las células de la capa luminal. 9 El líquido que la porción secretora de la glándula secreta es similar al plasma sanguíneo en lo que se refiere al equilibrio electrolítico. 9 La mayor parte de los iones de sodio, potasio y cloro se resorbe por las células del conducto, pero también secretan a la luz otros iones, urea, ácido láctico y algunos fármacos. Glándulas sudoríparas apocrinas 9 Se hallan sólo en ciertos sitios: las axilas, la areola del pezón y la región anal. 9 Las glándulas sudoríparas apocrinas modificadas constituyen las glándulas ceruminosas (cera) del conducto auditivo externo y las glándulas de Moll en los párpados. 9 Los conductos de las glándulas sudoríparas apocrinas desembocan en los conductos de los folículos pilosos justo superficiales a la entrada de los conductos de la glándula sebácea. 9 Las células de las glándulas apocrinas son de perfil cuboide a cilíndrico bajo simple. 9 El producto secretor viscoso de las glándulas apocrinas es inoloro cuando se secreta, pero al metabolizarse por bacterias presenta un olor característico. 9 Una glándula sudorípara apocrina surge del epitelio de los folículos pilosos como una evaginación epitelial que se desarrolla en una glándula. 9 Las glándulas sudoríparas apocrinas en mujeres tienen cambios cíclicos que al parecer se relacionan con el ciclo menstrual, de tal manera que las células secretoras y las luces aumentan antes del periodo premenstrual y disminuyen durante la menstruación. 9 Las glándulas sudoríparas apocrinas liberan su producto secretor a través de la modalidad de secreción merocrina (exocitosis). Glándulas sebáceas 9 Con excepción de las palmas de las manos, las plantas de los pies y los lados de los pies inferiores a la línea de vellos, las glándulas sebáceas se encuentran en la totalidad del cuerpo, incrustadas en la dermis y la hipodermis. 9 Abundan más en la cara, el cuero cabelludo y la frente. 9 El producto secretor de las glándulas sebáceas, el sebo, es una combinación oleosa semejante a cera, de colesterol, triglicéridos y desechos celulares. 9 Se piensa que el sebo facilita la conservación de la textura de la piel y la flexibilidad del pelo apropiados. 9 Las glándulas sebáceas son apéndices de los folículos pilosos, las glándulas sebáceas se abren en el tercio superior del conducto folicular, donde vierten su producto secretor. 9 Las glándulas sebáceas son lobulillares con grupos de acinos que se abren a conductos cortos únicos. Cada acino está compuesto de células basales pequeñas localizadas en la periferia, que rodean células redondas más grandes que llenan el resto del acino. 9 Las células comienzan a sintetizar lípidos con la subsiguiente muerte de la célula. 9 Por lo tanto su secreción es holocrina (la célula es parte del producto secretorio).
- 1478. PELO 9 Los pelos son estructuras filamentosas, queratinizadas, que se proyectan de la superficie epidérmica de la piel. 9 En el cuerpo humano se encuentran dos tipos de pelo: o Los pelos vellosos: blandos, finos, cortos y pálidos o Los pelos terminales: duros, grandes, gruesos, largos y oscuros. 9 En el feto se encuentra un pelo muy fina llamado lanugo. 9 Los pelos tienen sensación táctil de manera que cualquier estímulo que deforma un pelo se traslada pro el tallo a los nervios sensoriales que rodean el folículo piloso. Folículos pilosos. 9 Son los órganos a partir de los cuales se desarrollan los pelos, surgen de invaginaciones de la epidermis que invaden la dermis, la hipodermis, o ambas. 9 La membrana vítrea, membrana basal, separa la dermis del epitelio del folículo piloso. 9 Las terminales expandidas del folículo piloso, la raíz del pelo, están indentadas y la concavidad se ajusta a la forma de la papila dérmica que la ocupa. 9 La raíz del pelo y la papila dérmica en conjunto se conocen como el bulbo piloso. 9 La gran mayoría de las células que componen la raíz del pelo se denomina matriz, estas células son homólogas al estrato basal de la epidermis. Las capas externas del epitelio folicular forman la vaina externa de la raíz. 9 La vaina externa de la raíz rodea varias capas de células derivadas de la epidermis, la vaina interna de la raíz, que consiste en tres componentes: o La capa de Henle, una hilera de células cúbicas, que está en contacto con la capa más interna de las células de la vaina externa de la raíz o La capa de Huxley, una o dos capas de células aplanadas. o La cutícula de la vaina de la raíz, células semejantes a escamas. 9 La vaina interna de la raíz termina en el sitio en que el conducto de la glándula sebácea se fija al folículo piloso. 9 El tallo del pelo está constituido por tres regiones: médula, corteza y cutícula del pelo. Conforme las células de la matriz dentro de la raíz del pelo proliferan y se diferencian, se mueven a la superficie de la piel y por último desarrollan el tallo del pelo. 9 Las capas distintivas del folículo piloso se desarrollan a partir de diferentes células de la matriz como sigue: 1) Las células de la matriz más centrales originan células vacuolazas grandes que forman el centro del tallo del pelo (la médula). 2) Las células de la matriz ligeramente periféricas al centro se convierten en la corteza del tallo del pelo. 3) Las células de la matriz más periféricas se transforman en la cutícula del pelo 4) Las células de la matriz más periféricas aún se desarrollaron en células de la vaina interna de la raíz. 9 A medida que las células de la corteza se desplazan a la superficie, sintetizan en abundancia filamentos de queratina y gránulos de tricohialina. 9 Dispersos entre las células de la matriz más cerca de las papilas dérmicas se encuentran melanocitos grandes que transfieren melanososmas a las células de la corteza. Los melanosomas imparten el color al pelo basado en la cantidad de melanina presente. 9 El pelo crece en ciclos que consisten en tres fases sucesivas: 1) fase anágena; periodo de crecimiento. 2) fase catágena, un lapso breve de involución. 3) fase telógena, en la cual se elimina el pelo viejo.
- 1479. UÑAS 9 Se componen de placas de células epiteliales muy compactadas, altamente queratinizadas que forman la placa de la uña, situada en la epidermis y que se conoce como el lecho ungueal. 9 Las uñas se desarrollan a partir de células de la matriz de la uña que prolifera y se queratiniza. 9 La matriz de la uña, una región de la raíz de la uña, está localizada abajo del pliegue proximal de la uña, este último forma el eponiquio (cutícula). 9 A los lados, la piel se voltea como pliegues laterales de la uña para formar los surcos laterales de la uña, la epidermis se continúa debajo de la placa de la uña como el lecho de la uña. 9 La lúnula, la semiluna blanca, se observa en el extremo proximal de la uña. 9 El extremo distal de la uña no está unido al lecho de la misma, que se continúa con la piel de la punta del dedo de la mano (o del pie). Cerca de esta unión se encuentra una acumulación de estrato córneo llamada hiponiquio. BIBLIOGRAFÍA: Gartner L, Hiatt J, Texto Atlas de Histología, 3ª Ed, México, Mc. Graw Hill – Interamericana, 2008.
- 1480. V.Viñals Aparato respiratorio 1 $3$5$72 5(63,5$725,2 )XQFLRQHV RPSRQHQWHV )LVLRORJtD GH OD UHVSLUDFLyQ 7UDVWRUQRV UHVSLUDWRULRV UHFLPLHQWR GH ORV SXOPRQHV $GDSWDFLRQHV UHJXODWRULDV $GDSWDFLRQHV IXQFLRQDOHV /D UHVSLUDFLyQ HV HO SURFHVR SRU HO TXH VH KDFH OOHJDU KDVWD WRGDV QXHVWUDV FpOXODV R[tJHQR D OD YH] TXH VH OLEHUD HO 2 SURGXFWR GH GHVHFKR GH OD UHVSLUDFLyQ 6H GLVWLQJXHQ GRV WLSRV GH UHVSLUDFLyQ $ /D UHVSLUDFLyQ H[WHUQD R LQWHUFDPELR GH JDVHV HQWUH ORV DOYpRORV ORV FDSLODUHV SXOPRQDUHV % /D UHVSLUDFLyQ LQWHUQD R LQWHUFDPELR GH JDVHV HQWUH OD VDQJUH ODV FpOXODV /RV VLVWHPDV UHVSLUDWRULRV FDUGLRYDVFXODUHV SDUWLFLSDQ SRU LJXDO HQ OD UHVSLUDFLyQ /D LQVXILFLHQFLD GH XQR GH HOORV WLHQH HO PLVPR HIHFWR HQ HO FXHUSR DOWHUDFLyQ GH OD KRPHRVWDVLV PXHUWH UiSLGD GH ODV FpOXODV GHELGR D OD DXVHQFLD GH R[LJHQR D OD DFXPXODFLyQ GH SURGXFWRV GH GHVHFKR )XQFLRQHV /D IXQFLyQ SULQFLSDO GHO DSDUDWR UHVSLUDWRULR HV FRQGXFLU HO R[tJHQR DO LQWHULRU GH ORV SXOPRQHV WUDQVIHULUOR D OD VDQJUH H[SXOVDU ODV VXVWDQFLDV GH GHVHFKR HQ IRUPD GH DQKtGULGR FDUEyQLFR (O R[tJHQR LQVSLUDGR SHQHWUD HQ ORV SXOPRQHV DOFDQ]D ORV DOYpRORV /DV SDUHGHV GH ORV DOYpRORV HVWiQ tQWLPDPHQWH HQ FRQWDFWR FRQ ORV FDSLODUHV TXH ODV URGHDQ WLHQHQ WDQ VyOR HO HVSHVRU GH XQD FpOXOD (O R[tJHQR SDVD IiFLOPHQWH D OD VDQJUH GH ORV FDSLODUHV D WUDYpV GH ODV SDUHGHV DOYHRODUHV PLHQWUDV TXH HO DQKtGULGR FDUEyQLFR SDVD GHVGH OD VDQJUH DO LQWHULRU GH ORV DOYpRORV VLHQGR HVSLUDGR SRU ODV IRVDV QDVDOHV OD ERFD RPSRQHQWHV /RV ÏUJDQRV 5HVSLUDWRULRV SXHGHQ GLYLGLUVH HQ YtDV UHVSLUDWRULDV VXSHULRUHV YtDV UHVSLUDWRULDV LQIHULRUHV SXOPRQHV /DV YtDV UHVSLUDWRULDV VXSHULRUHV FRPSUHQGHQ OD FDYLGDG QDVDO OD IDULQJH PLHQWUDV TXH ODV YtDV UHVSLUDWRULDV LQIHULRUHV FRPSUHQGHQ OD ODULQJH OD WUiTXHD HO iUERO EURQTXLDO (O iUERO EURQTXLDO VH UDPLILFD HQ ORV SXOPRQHV ORV FXDOHV VH GLYLGHQ HQ OyEXORV
- 1481. V.Viñals Aparato respiratorio 2 1DUL] $GHPiV GH SRVHHU OD IXQFLyQ GH yUJDQR GHO ROIDWR OD QDUL] WLHQH ODV LPSRUWDQWHV IXQFLRQHV GH OLPSLDU GHWUiV GH ODV YHQWDQDV QDVDOHV H[LVWHQ XQRV SHORV TXH OLPSLDQ DO DLUH GH SDUWtFXODV JUDQGHV
- 1482. FDOHQWDU HQ OD FDYLGDG QDVDO H[LVWH XQ JUDQ Q~PHUR GH YDVRV VDQJXtQHRV GH SDUHGHV GHOJDGDV VLWXDGDV PX SUy[LPRV D OD VXSHUILFLH TXH LUUDGLDQ FDORU SRU FRQVLJXLHQWH FDOLHQWDQ HO DLUH LQKDODGR
- 1483. KXPHGHFHU HO DLUH LQKDODGR OD FDYLGDG QDVDO VH PDQWLHQH K~PHGD SRU VHFUHFLRQHV JODQGXODUHV TXH KXPHGHFHQ HO DLUH
- 1484. (O DLUH LQVSLUDGR TXH DWUDYLHVD OD QDUL] VH KXPLGLILFD GH HVWD PDQHUD WRWDOPHQWH DOFDQ]D XQD WHPSHUDWXUD GH ƒ LQGHSHQGLHQWHPHQWH GH OD WHPSHUDWXUD UHLQDQWH HQ HO H[WHULRU )DULQJH (V OD SRUFLyQ VXSHULRU GH ODV YtDV UHVSLUDWRULDV GHO WUDFWR GLJHVWLYR RQHFWD FRQ OD FDYLGDG EXFDO HQ OD SDUWH WUDVHUD GH OD OHQJXD
- 1485. OD FDYLGDG QDVDO OD ODULQJH TXH VH GLULJH KDFLD OD WUiTXHD
- 1486. HO HVyIDJR 'XUDQWH HO SURFHVR GH WUDJDGR OD SDUWH QDVDO GH OD IDULQJH OD ODULQJH OD FDYLGDG EXFDO FRRSHUDQ SDUD FHUUDU HO FRQGXFWR UHVSLUDWRULR GH IRUPD TXH DO WUDJDU OD FRPLGD QR HQWUH HQ OD WUiTXHD /DULQJH 'HVSXpV GH FLUFXODU SRU OD FDYLGDG QDVDO OD IDULQJH HO DLUH LQKDODGR OOHJD D OD ODULQJH (VWD ~OWLPD HVWi SDUFLDOPHQWH FXELHUWD SRU OD HSLJORWLV TXH FLHUUD OD DEHUWXUD VXSHULRU GH OD ODULQJH GXUDQWH OD GHJOXFLyQ /DV FXHUGDV YRFDOHV WDPELpQ FLHUUDQ DO GHJOXWLU 7UiTXHD (V XQD YtD DpUHD WXEXODU TXH SHUPLWH HO SDVR GHO DLUH TXH PLGH FHUFD GH FP GH ORQJLWXG FP GH GLiPHWUR 6H ORFDOL]D SRU GHODQWH GHO HVyIDJR VH H[WLHQGH GHVGH OD ODULQJH KDVWD OD TXLQWD YpUWHEUD WRUiFLFD GRQGH VH GLYLGH GDQGR OXJDU D GRV EURQTXLRV (VWi UHYHVWLGD SRU XQD FDSD PXFRVD FLOLRV TXH DXGDQ D ILOWUDU H[SXOVDU HO SROYR /D DFFLyQ FRQVWDQWH GH HVWRV FLOLRV WUDQVSRUWD HO SROYR RWUDV VXVWDQFLDV KDFLD OD IDULQJH 7DQWR WUDTXHD FRPR EURQTXLRV EURQTXLRORV VH FDUDFWHUL]DQ SRU HVWDU IRUPDGRV SRU XQRV DQLOORV FDUWLODJLQRVRV TXH OHV GDQ UHVLVWHQFLD D OD REWXUDFLyQ FXDQGR LQVSLUDPRV %URQTXLRV EURQTXLRORV /RV EURQTXLRV VRQ ORV WXERV TXH WUDQVSRUWDQ DLUH GHVGH OD WUiTXHD D ORV OXJDUHV PiV DSDUWDGRV GH ORV SXOPRQHV GRQGH SXHGHQ WUDQVIHULU R[tJHQR D OD VDQJUH HQ SHTXHxRV VDFRV GH DLUH GHQRPLQDGRV DOYpRORV
- 1487. V.Viñals Aparato respiratorio 3 /RV EURQTXLRV FRQWLQ~DQ GLYLGLpQGRVH HQ FRQGXFWRV PHQRUHV GHQRPLQDGRV EURQTXLRORV IRUPDQGR UDPLILFDFLRQHV FRPR HQ XQ iUERO TXH VH H[WLHQGHQ SRU WRGR HO HVSRQMRVR WHMLGR SXOPRQDU (O H[WHULRU GH ORV EURQTXLRV VH FRPSRQH GH ILEUDV HO HOiVWLFDV FDUWLODJLQRVDV SUHVHQWD UHIXHU]RV DQXODUHV GH WHMLGR PXVFXODU OLVR (Q HO H[WUHPR GH FDGD EURQTXLROR VH HQFXHQWUDQ GRFHQDV DOYpRORV VHPHMDQWHV D UDFLPRV GH XYDV DGD XQR GH ORV SXOPRQHV FRQWLHQH PLOORQHV GH DOYpRORV FDGD DOYpROR HVWi URGHDGR SRU XQD GHQVD PDOOD GH FDSLODUHV VDQJXtQHRV (O WDSL]DGR GH ODV SDUHGHV DOYHRODUHV HV H[WUHPDGDPHQWH ILQR SHUPLWH HO LQWHUFDPELR HQWUH HO R[tJHQR TXH SDVD GH ORV DOYpRORV D OD VDQJUH GH ORV FDSLODUHV GHO DQKtGULGR FDUEyQLFR TXH SDVD GH OD VDQJUH GH ORV FDSLODUHV DO LQWHULRU GH ORV DOYpRORV /RV SXOPRQHV KXPDQRV WLHQH FHUFD GH PLOORQHV GH DOYpRORV TXH UHSUHVHQWDQ XQD VXSHUILFLH UHVSLUDWRULD GH XQRV P 3XOPRQHV 6RQ ORV GRV yUJDQRV PiV JUDQGHV GHO DSDUDWR UHVSLUDWRULR VX IRUPD HV VHPHMDQWH D GRV JUDQGHV HVSRQMDV TXH RFXSDQ OD PDRU SDUWH GH OD FDYLGDG WRUiFLFD (O SXOPyQ L]TXLHUGR HV OLJHUDPHQWH PHQRU TXH HO GHUHFKR SRUTXH FRPSDUWH HO HVSDFLR FRQ HO FRUD]yQ HQ HO ODGR L]TXLHUGR GHO WyUD[ DGD SXOPyQ HVWi GLYLGLGR HQ VHFFLRQHV OyEXORV
- 1488. (O SXOPyQ GHUHFKR HVWi FRPSXHVWR SRU WUHV OyEXORV HO L]TXLHUGR SRU GRV /D SOHXUD (V XQD GREOH FDSD GH PHPEUDQD TXH IDFLOLWD HO PRYLPLHQWR GH ORV SXOPRQHV HQ FDGD LQVSLUDFLyQ HVSLUDFLyQ (QYXHOYH ORV GRV SXOPRQHV WDSL]D OD VXSHUILFLH LQWHUQD GH OD SDUHG WRUiFLFD 1RUPDOPHQWH HO HVSDFLR HQWUH ODV GRV FDSDV OXEULFDGDV GH OD SOHXUD HV PtQLPR GXUDQWH ORV PRYLPLHQWRV UHVSLUDWRULRV VH GHVSOD]DQ IiFLOPHQWH OD XQD VREUH OD RWUD HYLWDQGR TXH VH LUULWHQ GXUDQWH OD UHVSLUDFLyQ
- 1489. V.Viñals Aparato respiratorio 4 DMD yVHD /RV SXOPRQHV GHPiV yUJDQRV GHO WyUD[ HVWiQ DORMDGRV HQ XQD FDMD yVHD SURWHFWRUD FRQVWLWXLGD SRU HO HVWHUQyQ ODV FRVWLOODV OD FROXPQD YHUWHEUDO /RV SDUHV GH FRVWLOODV VH FXUYDQ DOUHGHGRU GHO WyUD[ (Q OD SDUWH GRUVDO GHO FXHUSR FDGD SDU VH FRQHFWD FRQ XQD YpUWHEUD (Q OD SDUWH DQWHULRU ORV VLHWH SDUHV VXSHULRUHV GH FRVWLOODV VH XQHQ GLUHFWDPHQWH DO HVWHUQyQ SRU PHGLR GH ORV FDUWtODJRV FRVWDOHV (O RFWDYR QRYHQR GpFLPR SDU GH FRVWLOODV VH XQHQ DO FDUWtODJR GHO SDU LQPHGLDWDPHQWH VXSHULRU ORV GRV ~OWLPRV SDUHV VRQ PiV FRUWRV QR VH XQHQ D OD SDUWH DQWHULRU FRVWLOODV IORWDQWHV
- 1490. 0~VFXORV /RV P~VFXORV LQWHUFRVWDOHV VLWXDGRV HQWUH ODV FRVWLOODV FRODERUDQ FRQ HO PRYLPLHQWR GH OD FDMD WRUiFLFD SDUWLFLSDQGR GH HVH PRGR HQ OD UHVSLUDFLyQ /RV H[WHUQRV SDUWLFLSDQ HQ OD LQVSLUDFLyQ ORV LQWHUQRV HQ ODV H[SLUDFLRQHV SURIXQGDV (O GLDIUDJPD HV XQ P~VFXOR JUDQGH GHOJDGR VLWXDGR GHEDMR GH ORV SXOPRQHV WLHQH IRUPD GH FDPSDQD VHSDUD ORV SXOPRQHV GHO DEGRPHQ (O GLDIUDJPD HVWi DGKHULGR D OD EDVH GHO HVWHUQyQ D OD SDUWH LQIHULRU GH OD FDMD WRUiFLFD D OD FROXPQD YHUWHEUDO XDQGR VH FRQWUDH DXPHQWD HO WDPDxR GH OD FDYLGDG WRUiFLFD SRU OR WDQWR ORV SXOPRQHV VH H[SDQGHQ )XQFLyQ TXH GHVHPSHxD HO GLDIUDJPD HQ OD UHVSLUDFLyQ XDQGR HO GLDIUDJPD VH FRQWUDH OD FDYLGDG WRUiFLFD VH HQVDQFKD UHGXFLHQGR OD SUHVLyQ LQWHULRU 3DUD LJXDODU OD SUHVLyQ HO DLUH HQWUD HQ ORV SXOPRQHV XDQGR HO GLDIUDJPD VH UHODMD OD FDYLGDG WRUiFLFD VH FRQWUDH DXPHQWDQGR GH HVWH PRGR OD SUHVLyQ H[SXOVDQGR HO DLUH GH ORV SXOPRQHV 2WURV 'XUDQWH OD UHVSLUDFLyQ IRU]DGD R ODERULRVD SDUWLFLSDQ RWURV P~VFXORV TXH YDQ GHVGH P~VFXORV GHO FXHOOR D P~VFXORV GHO D DEGRPHQ )LVLRORJtD GH OD UHVSLUDFLyQ (O DLUH HQWUD HQ ORV SXOPRQHV VDOH GH HOORV PHGLDQWH ORV PRYLPLHQWRV UHVSLUDWRULRV TXH VRQ GRV
- 1491. V.Viñals Aparato respiratorio 5 /D ,QVSLUDFLyQ HO DLUH SHQHWUD HQ ORV SXOPRQHV SRUTXH HVWRV DXPHQWDQ VX YROXPHQ SRU OD DFFLyQ GH ORV P~VFXORV LQVSLUDGRUHV VREUH OD FDMD WRUiFLFD (O GLDIUDJPD HV HO SULQFLSDO P~VFXOR LQVSLUDWRULR HV XQ P~VFXOR HVTXHOpWLFR FRQ IRUPD GH F~SXOD TXH IRUPD HO SLVR GH OD FDYLGDG WRUiFLFD HVWi LQHUYDGR SRU HO QHUYLR IUpQLFR /D FRQWUDFFLyQ GHO GLDIUDJPD SURYRFD TXH VH KDJD SODQR GLVPLQXHQGR VX FXUYDWXUD /D GLVWDQFLD TXH UHFRUUH HO GLDIUDJPD GXUDQWH OD LQVSLUDFLyQ YD GHVGH FHQWtPHWUR GXUDQWH OD UHVSLUDFLyQ QRUPDO HQ UHSRVR KDVWD PDV GH FHQWtPHWURV GXUDQWH OD UHVSLUDFLyQ LQWHQVD /RV P~VFXORV ,QWHUFRVWDOHV ([WHUQRV VH XELFDQ HQ IRUPD REOLFXD KDFLD DEDMR DGHODQWH HQWUH ODV FRVWLOODV DGDFHQWHV FXDQGR VH FRQWUDHQ ODV FRVWLOODV VH UHWUDHQ MXQWR FRQ HO HVWHUQyQ KDFLD GHODQWH (VWR DXPHQWD HO GLiPHWUR DQWHURSRVWHULRU GH OD FDYLGDG WRUiFLFD 2WUR P~VFXOR TXH SXHGH SDUWLFLSDU HV HO VHUUDWR PHQRU SRVWHULRU VXSHULRU OD (VSLUDFLyQ HO DLUH HV DUURMDGR DO H[WHULRU D TXH ORV SXOPRQHV VH FRPSULPHQ DO GLVPLQXLU GH WDPDxR OD FDMD WRUiFLFD SXHV HO GLDIUDJPD ODV FRVWLOODV YXHOYHQ D VX SRVLFLyQ QRUPDO /D (VSLUDFLyQ VH SURGXFH GH IRUPD SDVLYD D TXH QR LQWHUYLHQHQ FRQWUDFFLRQHV PXVFXODUHV (VWH IHQyPHQR GHSHQGH GH OD HODVWLFLGDG GH ORV SXOPRQHV VH LQLFLD FXDQGR VH UHODMDQ ORV P~VFXORV LQVSLUDWRULRV (Q OD YHQWLODFLyQ LQWHQVD R FXDQGR HVWi LPSHGLGR HO PRYLPLHQWR GHO DLUH VL LQWHUYLHQHQ HQ OD HVSLUDFLyQ ORV P~VFXORV DEGRPLQDOHV ORV P~VFXORV LQWHUFRVWDOHV LQWHUQRV HO VHUUDWR PHQRU SRVWHULRU H LQIHULRU 5LWPR UHVSLUDWRULR (O ULWPR UHVSLUDWRULR HV GH XQRV FLFORV UHVSLUDWRULRV SRU PLQXWR FDGD YH] LQWURGXFLPRV DSUR[LPDGDPHQWH ò OLWUR GH DLUH (O Q~PHUR GH FLFORV GHSHQGHUi GH IDFWRUHV FRPR OD LQWHQVLGDG GHO HMHUFLFLR OD HGDG HWF /D FDSDFLGDG SXOPRQDU Pi[LPD GH DOJXQRV GHSRUWLVWDV SXHGH OOHJDU D ORV VHLV OLWURV (O VLVWHPD UHVSLUDWRULR SHUPLWH OD FLUFXODFLyQ GH FHUFD GH OLWURV GLDULRV /RV PRYLPLHQWRV UHVSLUDWRULRV WDPELpQ VH XVDQ SDUD H[SUHVDU HPRFLRQHV SDUD OLPSLDU ODV YtDV DpUHDV $OJXQRV WLSRV GH PRYLPLHQWRV UHVSLUDWRULRV LQFOXHQ WRV HVWRUQXGRV ERVWH]RV VXVSLURV OODQWRV KLSR VRQULVDV
- 1492. V.Viñals Aparato respiratorio 6 RQWURO GH OD UHVSLUDFLyQ /D IXQFLyQ UHVSLUDWRULD HVWi FRQWURODGD SRU ORV FHQWURV UHVSLUDWRULRV GHO VLVWHPD QHUYLRVR FHQWUDO VLWXDGRV HQ OD SDUWH LQIHULRU GHO FHUHEUR (VWRV FHQWURV SXHGHQ PRGLILFDUVH YROXQWDULDPHQWH SHUR VXV IXQFLRQHV UHIOHMDV QR HV SRVLEOH VXSULPLUODV FRPSOHWDPHQWH (O FHQWUR UHVSLUDWRULR FRQWUROD VXEFRQVFLHQWHPHQWH OD UHVSLUDFLyQ TXH HQ JHQHUDO HV DXWRPiWLFD (O FHUHEUR XQRV SHTXHxRV yUJDQRV VHQVRULDOHV VLWXDGRV HQ ODV DUWHULDV DRUWD FDUyWLGD VRQ FDSDFHV GH SHUFLELU XQD FRQFHQWUDFLyQ GH R[tJHQR LQIHULRU D OD QRUPDO R XQ LQFUHPHQWR DQRUPDO GHO DQKtGULGR FDUEyQLFR (QWRQFHV HO FHUHEUR SURYRFD XQ DXPHQWR GH OD IUHFXHQFLD UHVSLUDWRULD 3RU HO FRQWUDULR FXDQGR ORV YDORUHV GH DQKtGULGR FDUEyQLFR EDMDQ H[FHVLYDPHQWH OD IUHFXHQFLD UHVSLUDWRULD GLPLQXH /D IUHFXHQFLD UHVSLUDWRULD GHO DGXOWR HQ UHSRVR HV GH XQRV FLFORV UHVSLUDWRULRV SRU PLQXWR )DFWRUHV TXH ,QIOXHQ HQ OD 5HVSLUDFLyQ ([WHUQD /D DOWLWXG RQ OD DOWLWXG OD SUHVLyQ SDUFLDO GHO R[tJHQR DWPRVIpULFR GLVPLQXH GLVPLQXHQGR DO PLVPR WLHPSR OD SUHVLyQ SDUFLDO GH R[tJHQR DOYHRODU SRU OR TXH XQD FDQWLGDG PHQRU GH R[tJHQR VH GLIXQGH KDFLD OD VDQJUH /RV VtQWRPDV PDV FRPXQHV FRQ OD DOWLWXG LQFOXHQ HO DFRUWDPLHQWR GH OD UHVSLUDFLyQ IDWLJD QiXVHD HQWUH RWURV /D 6XSHUILFLH 7RWDO GH ,QWHUFDPELR GH *DVHV XDOTXLHUD DOWHUDFLyQ SXOPRQDU TXH GLVPLQXD OD VXSHUILFLH IXQFLRQDO IRUPDGD SRU OD PHPEUDQD DOYHRORFDSLODU GLVPLQXH OD HILFDFLD GH OD UHVSLUDFLyQ H[WHUQD 9ROXPHQ SRU 0LQXWR GH OD 5HVSLUDFLyQ ([LVWHQ GURJDV FRPR OD PRUILQD TXH GLVPLQXH OD FDQWLGDG GH R[tJHQR ELy[LGR GH FDUERQR TXH VH SXHGD LQWHUFDPELDU HQWUH HO DOYpROR OD VDQJUH SXGLHQGR FDXVDU OD PXHUWH HQ FDVR GH VREUHGRVLV 7UDVWRUQRV UHVSLUDWRULRV (QWUH ORV WUDVWRUQRV UHVSLUDWRULRV VH GHVWDFDQ OD WRV HO DKRJR GLVQHD
- 1493. HO GRORU WRUiFLFR OD UHVSLUDFLyQ VLELODQWH HO HVWULGRU OD KHPRSWLVLV HVSXWR FRQ VDQJUH
- 1494. OD FLDQRVLV FRORUDFLyQ D]XODGD GH OD SLHO
- 1495. ORV GHGRV HQ SDOLOOR GH WDPERU OD LQVXILFLHQFLD UHVSLUDWRULD $OJXQRV GH HVWRV VtQWRPDV QR VLHPSUH LQGLFDQ XQ SUREOHPD UHVSLUDWRULR (O GRORU GH SHFKR WDPELpQ SXHGH VHU FRQVHFXHQFLD GH XQ SUREOHPD FDUGtDFR
- 1496. V.Viñals Aparato respiratorio 7 7RV /D WRV HV XQ PRYLPLHQWR GH DLUH V~ELWR UXLGRVR YLROHQWR TXH WLHQGH D GHVSHMDU ODV YtDV UHVSLUDWRULDV 7RVHU HV XQD IRUPD GH SURWHFFLyQ GH ORV SXOPRQHV GH ODV YtDV DpUHDV -XQWR FRQ RWURV PHFDQLVPRV OD WRV DXGD D ORV SXOPRQHV D GHVSUHQGHUVH GH ODV SDUWtFXODV DVSLUDGDV /D WRV D YHFHV VH DFRPSDxD GH HVSXWR XQD PH]FOD GH PXFRVLGDG GHVHFKRV FpOXODV TXH HV H[SXOVDGD SRU ORV SXOPRQHV $KRJR (O DKRJR GLVQHD
- 1497. HV XQD VHQVDFLyQ PROHVWD GH GLILFXOWDG UHVSLUDWRULD $XQTXH OD UHVSLUDFLyQ UiSLGD UDUD YH] FDXVD PROHVWLDV SXHGH OLPLWDU OD FDQWLGDG GH HMHUFLFLRV TXH VH SUDFWLTXH /D UHVSLUDFLyQ DFHOHUDGD HQ XQD SHUVRQD FRQ GLVQHD VXHOH DFRPSDxDUVH GH XQD VHQVDFLyQ GH DKRJR GLILFXOWDG SDUD UHVSLUDU FRQ VXILFLHQWH UDSLGH] R SURIXQGLGDG /D GLVQHD WDPELpQ OLPLWD OD FDQWLGDG GH HMHUFLFLR TXH VH SXHGD UHDOL]DU 6LELODQFLDV /D UHVSLUDFLyQ VLELODQWH HV XQ VRQLGR PXVLFDO FRPR XQ VLOELGR TXH VH SURGXFH GXUDQWH OD UHVSLUDFLyQ D FRQVHFXHQFLD GH OD REVWUXFFLyQ SDUFLDO GH ODV YtDV UHVSLUDWRULDV (VWULGRU (O HVWULGRU HV XQ VRQLGR VHPHMDQWH D XQ JUD]QLGR HV SUHGRPLQDQWHPHQWH LQVSLUDWRULR HV FRQVHFXHQFLD GH XQD REVWUXFFLyQ SDUFLDO GH OD JDUJDQWD IDULQJH
- 1498. GH OD FDMD GH ORV yUJDQRV GH OD IRQDFLyQ ODULQJH
- 1499. R GH OD WUiTXHD +HPRSWLVLV /D KHPRSWLVLV HV XQD H[SHFWRUDFLyQ GH VDQJUH SURYHQLHQWH GHO WUDFWR UHVSLUDWRULR LDQRVLV /D FLDQRVLV HV XQD FRORUDFLyQ D]XODGD GH OD SLHO FDXVDGD SRU XQD R[LJHQDFLyQ LQVXILFLHQWH GH OD VDQJUH /D FLDQRVLV VH SURGXFH FXDQGR OD VDQJUH GHVSURYLVWD GH R[tJHQR TXH HV PiV D]XODGD TXH URMD FLUFXOD SRU ORV YDVRV GH OD SLHO +DELWXDOPHQWH OD FLDQRVLV TXH HVWi UHVWULQJLGD D ORV GHGRV GH ODV PDQRV GH ORV SLHV VH SURGXFH SRUTXH OD VDQJUH IOXH PX OHQWDPHQWH D WUDYpV GH ORV PLHPEURV 3XHGH DSDUHFHU FXDQGR ORV ODWLGRV GHO FRUD]yQ VH GHELOLWDQ R ELHQ FXDQGR VH HVWi H[SXHVWR DO IUtR
- 1500. V.Viñals Aparato respiratorio 8 ,QVXILFLHQFLD UHVSLUDWRULD /D LQVXILFLHQFLD UHVSLUDWRULD HV XQD HQIHUPHGDG HQ OD FXDO GLVPLQXHQ ORV YDORUHV GH R[tJHQR HQ VDQJUH R DXPHQWDQ ORV GH DQKtGULGR FDUEyQLFR GH IRUPD SHOLJURVD /D LQVXILFLHQFLD UHVSLUDWRULD VH GHEH DO LQWHUFDPELR LQDGHFXDGR GH R[tJHQR DQKtGULGR FDUEyQLFR HQWUH ORV SXOPRQHV OD VDQJUH R D XQD DOWHUDFLyQ GH OD YHQWLODFLyQ DVL WRGDV ODV HQIHUPHGDGHV TXH DIHFWDQ D OD UHVSLUDFLyQ R ORV SXOPRQHV SXHGHQ FDXVDU LQVXILFLHQFLD UHVSLUDWRULD 8QD VREUHGRVLV GH QDUFyWLFRV R GH DOFRKRO SXHGH FDXVDU XQ VRSRU WDQ SURIXQGR TXH OD SHUVRQD GHMD GH UHVSLUDU SURGXFLpQGRVH LQVXILFLHQFLD UHVSLUDWRULD 2WUDV FDXVDV IUHFXHQWHV VRQ OD REVWUXFFLyQ GH ODV YtDV DpUHDV ODV OHVLRQHV GHO WHMLGR SXOPRQDU HO GDxR GH ORV KXHVRV GH ORV WHMLGRV TXH UHYLVWHQ ORV SXOPRQHV OD GHELOLGDG GH ORV P~VFXORV TXH VH HQFDUJDQ GH OD HQWUDGD GH DLUH D ORV SXOPRQHV /D LQVXILFLHQFLD UHVSLUDWRULD SXHGH SURGXFLUVH FXDQGR VH DOWHUD OD FLUFXODFLyQ VDQJXtQHD D WUDYpV GH ORV SXOPRQHV FRPR VXFHGH HQ OD HPEROLD SXOPRQDU (VWH WUDVWRUQR QR LQWHUUXPSH HO PRYLPLHQWR GH VDOLGD OOHJDGD GH DLUH D ORV SXOPRQHV 6LQ HPEDUJR VLQ HO IOXMR GH VDQJUH HQ XQD SDUWH GHO SXOPyQ HO R[tJHQR QR VH H[WUDH DGHFXDGDPHQWH GHO DLUH HO DQKtGULGR FDUEyQLFR QR VH WUDQVILHUH D OD VDQJUH 2WUDV FDXVDV TXH SXHGHQ RFDVLRQDU LQVXILFLHQFLD UHVSLUDWRULD VRQ FLHUWDV DOWHUDFLRQHV FRQJpQLWDV GH OD FLUFXODFLyQ TXH HQYtDQ OD VDQJUH GLUHFWDPHQWH DO UHVWR GHO FXHUSR VLQ SDVDU SULPHUR SRU ORV SXOPRQHV UHFLPLHQWR GH ORV SXOPRQHV (O FUHFLPLHQWR GH ORV SXOPRQHV HQ HO SHULRGR SRVWQDWDO REHGHFH SULQFLSDOPHQWH DO LQFUHPHQWR GHO QXPHUR GH EURQTXtRORV UHVSLUDWRULRV DOYpRORV 6H FDOFXOD TXH HQ HO PRPHQWR GHO QDFLPLHQWR VROR H[LVWH XQD VH[WD SDUWH GH ORV DOYpRORV TXH FRUUHVSRQGHQ D XQD SHUVRQD DGXOWD /RV UHVWDQWHV VH IRUPDQ GXUDQWH ORV SULPHURV DxRV GH YLGD SRVWQDWDO SRU HO SURFHVR GH DSDULFLyQ FRQWLQXD GH DOYpRORV SULPLWLYRV $GDSWDFLRQHV UHJXODWRULDV 6H SURGXFHQ GXUDQWH OD UHDOL]DFLyQ GH HMHUFLFLR FRPR PRGR GH DMXVWDU QXHVWUR RUJDQLVPR D ODV QXHYDV QHFHVLGDGHV (O HMHUFLFLR UHTXLHUH XQ DSRUWH VXSOHPHQWDULR GH HQHUJtD HVWR LPSOLFD XQ PDRU FRQVXPR GH R[tJHQR 9HDPRV DOJXQDV DGDSWDFLRQHV $XPHQWD HO YROXPHQ UHVSLUDWRULRPLQXWR (Q UHSRVR HO YROXPHQ UHVSLUDWRULR HV GH DSUR[LPDGDPHQWH R /LWURVPLQXWR FLFORV UHVSLUDWRULRV
- 1501. (Q HMHUFLFLRV GH JUDQ LQWHQVLGDG SXHGH OOHJDU D VHU GH OP R FLFORV
- 1502. V.Viñals Aparato respiratorio 9 $GDSWDFLRQHV IXQFLRQDOHV 6RQ ODV TXH VH SURGXFHQ VL VH UHDOL]D HMHUFLFLR GH IRUPD FRQWLQXDGD (O HMHUFLFLR FRQWLQXDGR SURYRFD XQ DXPHQWR GHO YROXPHQ GH ORV SXOPRQHV SRU WDQWR GHO Q~PHUR GH DOYpRORV XQ IRUWDOHFLPLHQWR GH OD PXVFXODWXUD TXH LQWHUYLHQH HQ OD UHVSLUDFLyQ XQ DXPHQWR GH OD FDYLGDG GHOLPLWDGD SRU ODV FRVWLOODV
- 1503. $3$5$72,58/$725,2 ,QWURGXFFLyQ /D0HGLFLQDVHGHILQHFRPR³ODFLHQFLDDUWHGHSUHYHQLUFXUDUODVHQIHUPHGDGHVGHO KRPEUH´'LVFLSOLQDHVWDFDVLWDQDQWLJXDFRPRHOKRPEUH /DPDJLDODVSUiFWLFDVVXSHUVWLFLRVDVKDQVLGRVLHPSUHHQORVSXHEORVSULPLWLYRVVXV PLVWHULRVRV DX[LOLDUHV (Q HO PXQGRRFFLGHQWDOHOFRPLHQ]RGHODPHGLFLQDVHDWULEXyDORV 'LRVHV (VFXODSLR6HUDSLV
- 1504. KDVWDTXHVXUJLyHOJUDQ +LSyFUDWHVDTXLHQVHGHEHXQD YHUGDGHUD FLHQFLD GH FXUDU /D WUDGLFLyQ GH +LSyFUDWHV VLJXH GRPLQDQGR KDVWD TXH DSDUHFH *DOHQR VLJOR,,G
- 1505. ODDXWRULGDGPi[LPDGHODPHGLFLQDSRUGRFHVLJORV 'XUDQWH OD (GDG 0HGLD ORV iUDEHV VRQ ORV PRQRSROL]DGRUHV GH HVWH DUWH KDVWD TXH DSDUHFHQODVSULPHUDVXQLYHUVLGDGHV3DUtV%RORQLD0RQWHSHOOLHU
- 1508. FXRSUHFXUVRUHV6HUYHW
- 1509. GHVFXEUHODFLUFXODFLyQGHODVDQJUH FRQILUPDGDSRU 0DOSLJKL HQFRQVXV HVWXGLRVVREUHORVFDSLODUHVVDQJXtQHRVDOYpROR SXOPRQDU6LJOR;9,,,ORVGHVFXEULPLHQWRVGH /DYRLVLHU DEUHQHOFDPLQRDODTXtPLFDELROyJLFD DODILVLRORJtD (GZDUG-HQQHU LQWURGXFHHQODSUiFWLFDGHODYDFXQDFLyQDQWLYDULyOLFD 6LJOR;,;OD PHGLFLQDHQWUDSRUILQHQORVFDPLQRVGHODFLHQFLDSRVLWLYDGHWLSRDQDWRPRFOtQLFR /DDQDWRPtDPLFURVFySLFDRKLVWRORJtDVHHVWDEOHFHFRQODVLQYHVWLJDFLRQHVGH5RELQ5DQYLHU RUQLO 6RXEHUDQ (Q VH GHVFXEUH HO FORURIRUPR VH LQLFLD VX DSOLFDFLyQ HQ ODV DQHVWHVLDV ODXGH%HUQDUG ±
- 1511. DEUH QXHYRV FDXFHV DO DUULQFRQDU HO GRJPD GH OD JHQHUDFLyQ HVSRQWiQHDGHVFXEULUHOSDSHOFDSLWDOGHORVPLFURELRV1DFHODEDFWHULRORJtDVHYDORUDHO FRQFHSWR GH OD DVHSVLD QDFLGD GHO JHQLR GH LQYHVWLJDGRU GH /LVWHU ±
- 1512. HOOR SHUPLWHHOUiSLGRHLQLQWHUUXPSLGRDYDQFHGHODFLUXJtD 'HOFRQFHSWRGHODVEDFWHULDVQDFHHOHVWXGLRGHORVYLUXV3UHVHQWLGRVDSRU3DVWHXU )ULHGULFN/RHIIHUHQGHPXHVWUDVXSDVRDWUDYpVGHODVEXMtDVGHKDPEHUODQGVX SRGHU WUDQVPLVRU $SRDGR SRU PRGHUQRV PHGLRV WpFQLFRV HO DPHULFDQR : 6WDQOH GHPXHVWUD HQ TXH ORV YLUXV QR VRQ PiV TXH QXFOHRSURWHtQDV SXUDV GH XQD VROD PROpFXOD (VWRV GHVFXEULPLHQWRV SHUPLWHQ GHVDUUROODU HO WUDWDPLHQWR SUHYHQWLYR GH ODV HQIHUPHGDGHV LQIHFFLRVDV $SDUHFHQ FRPR FRQVHFXHQFLD OD YDFXQRWHUDSLD VHURWHUDSLD TXLPLRWHUDSLDHOWUDWDPLHQWRFRQDQWLELyWLFRV
- 1513. (Q HO DX[LOLR TXH SUHVWDQ ODV GHPiV FLHQFLDV D OD PHGLFLQD VREUHVDOH HO XVR GH OD HOHFWULFLGDG 5|HQWJHQ HQ GHVFXEULy ORV 5DRV ; DGHPiV VXUJLHURQ HO HOHFWURGLDJQyVWLFRODHOHFWURWHUDSLDODGLDWHUPLDODHOHFWURFRDJXODFLyQHWF(OGHVFXEULPLHQWR FRQRFLPLHQWR GH GLYHUVRV DVSHFWRV GHO FXHUSR KXPDQR XQLGR D ODV GLYHUVDV GLVFLSOLQDV DSOLFDGDV DEUHQ D OD PHGLFLQD KRUL]RQWHV SRVLELOLGDGHV GH JUDQ DOFDQFHV HO HTXLOLEULR GHO FXHUSRKXPDQRHQHVSHFLDOHQVXVIXQFLRQHVPiVGHOLFDGDVFRPRODFLUFXODWRULDODQHUYLRVD SXHGH VHU REWHQLGR FRQ SUHFLVLyQ /D SURORQJDFLyQ JHQHUDO GH OD YLGD KXPDQD HV XQD GHPRVWUDFLyQGHODHILFDFLDGHODVFLHQFLDVPpGLFDVDFWXDOHV (QHODIiQGHFRQRFLPLHQWRSHUIHFFLyQORVyUJDQRVIXQFLRQHVGHOFXHUSRKXPDQR IXHURQVHSDUDGDVSDUDVXHVWXGLRGDQGRRULJHQDODVGLYHUVDVHVSHFLDOLGDGHVPpGLFDVFRPR KR ODV FRQRFHPRV ORJUiQGRVH DVt ORV PiV tQWLPRV FRQRFLPLHQWRV GH FDGD XQR GH ORV VLVWHPDVWDOORVTXHDERUGDUHPRVDSDUWLUGHDTXt $SDUDWRLUFXODWRULR RPSUHQGHHOVLVWHPDSRUHOTXH GLVFXUUHODVDQJUHDWUDYpVGHODVDUWHULDVORV FDSLODUHVODVYHQDVHVWHUHFRUULGRWLHQHVXSXQWRGHSDUWLGDVXILQDOHQHOFRUD]yQ (Q ORV KXPDQRV HQ ORV YHUWHEUDGRV VXSHULRUHV HO FRUD]yQ HVWi IRUPDGR SRU FXDWUR FDYLGDGHV E DXUtFXODGHUHFKD E DXUtFXODL]TXLHUGD E YHQWUtFXORGHUHFKR E YHQWUtFXORL]TXLHUGR (O ODGR GHUHFKR GHO FRUD]yQ ERPEHD VDQJUH FDUHQWHGHR[tJHQRSURFHGHQWHGHORVWHMLGRV KDFLDORV SXOPRQHVGRQGHVHR[LJHQDHOODGRL]TXLHUGR GHO FRUD]yQ UHFLEH OD VDQJUH R[LJHQDGD GH ORV SXOPRQHVODLPSXOVDDWUDYpVGHODVDUWHULDV D WRGRV ORVWHMLGRVGHORUJDQLVPR
- 1514. /D FLUFXODFLyQ VH LQLFLD DO SULQFLSLR GH OD YLGD IHWDO 6H FDOFXOD TXH XQD SRUFLyQ GHWHUPLQDGDGHVDQJUHFRPSOHWDVXUHFRUULGRHQXQSHULRGRDSUR[LPDGRGHXQPLQXWR LUFXODFLyQSXOPRQDU /DVDQJUHSURFHGHQWHGHWRGRHORUJDQLVPROOHJDDODDXUtFXODGHUHFKDDWUDYpVGHGRV YHQDVSULQFLSDOHVODYHQDFDYDVXSHULRUODYHQDFDYDLQIHULRU XDQGRODDXUtFXODGHUHFKDVHFRQWUDHLPSXOVDOD VDQJUH DWUDYpVGHXQRULILFLRKDFLDHOYHQWUtFXORGHUHFKR /DFRQWUDFFLyQGHHVWHYHQWUtFXORFRQGXFHODVDQJUHKDFLD ORV SXOPRQHV /D YiOYXOD WULF~VSLGH HYLWD HO UHIOXMR GH VDQJUH KDFLD OD DXUtFXOD D TXH VH FLHUUD SRU FRPSOHWR GXUDQWHODFRQWUDFFLyQGHOYHQWUtFXORGHUHFKR (Q VX UHFRUULGR D WUDYpV GH ORV SXOPRQHV OD VDQJUH VH R[LJHQD HV GHFLU VH VDWXUD GH R[tJHQR 'HVSXpV UHJUHVD DO FRUD]yQ SRU PHGLR GH ODV FXDWUR YHQDVSXOPRQDUHVTXHGHVHPERFDQHQODDXUtFXODL]TXLHUGD
- 1515. XDQGRHVWDFDYLGDGVHFRQWUDHODVDQJUHSDVDDOYHQWUtFXORL]TXLHUGRGHVGHDOOtD ODDRUWDJUDFLDVDODFRQWUDFFLyQYHQWULFXODU/DYiOYXODELF~VSLGHRPLWUDOHYLWDHOUHIOXMRGH VDQJUHKDFLDODDXUtFXODODVYiOYXODVVHPLOXQDUHVRVLJPRLGHDVTXHVHORFDOL]DQHQODUDt] GH OD DRUWD HO UHIOXMR KDFLD HO YHQWUtFXOR (Q OD DUWHULD SXOPRQDU WDPELpQ KD YiOYXODV VHPLOXQDUHVRVLJPRLGHDV 5DPLILFDFLRQHV /DDRUWDVHGLYLGHHQXQDVHULHGHUDPDVSULQFLSDOHVTXHDVXYH]VHUDPLILFDQHQ RWUDVPiVSHTXHxDVGHPRGRTXHWRGRHORUJDQLVPRUHFLEHODVDQJUHDWUDYpVGHXQSURFHVR FRPSOLFDGRGHP~OWLSOHVGHULYDFLRQHV /DV DUWHULDV PHQRUHV VH GLYLGHQ HQ XQD ILQDUHG GH YDVRV D~Q PiV SHTXHxRV ORV OODPDGRVFDSLODUHVTXHWLHQHQSDUHGHVPXGHOJDGDV'HHVWDPDQHUDODVDQJUHHQWUDHQ HVWUHFKRFRQWDFWRFRQORVOtTXLGRVORVWHMLGRVGHORUJDQLVPR (QORVYDVRVFDSLODUHVODVDQJUHGHVHPSHxDWUHVIXQFLRQHVOLEHUDHOR[tJHQRKDFLDORV WHMLGRVSURSRUFLRQDDODVFpOXODVGHORUJDQLVPRGHQXWULHQWHVRWUDVVXVWDQFLDVHVHQFLDOHV TXHWUDQVSRUWDFDSWDORVSURGXFWRVGHGHVKHFKRGHORVWHMLGRV'HVSXpVORVFDSLODUHVVH XQHQSDUDIRUPDUYHQDVSHTXHxDV$VXYH]ODVYHQDVVHXQHQSDUDIRUPDUYHQDVPDRUHV KDVWDTXHSRU~OWLPRODVDQJUHVHUH~QHHQODYHQDFDYDVXSHULRUHLQIHULRUFRQIOXHHQ HOFRUD]yQFRPSOHWDQGRHOFLUFXLWR LUFXODFLyQSRUWDO $GHPiVGHODFLUFXODFLyQSXOPRQDUVLVWpPLFDGHVFULSWDVKDXQVLVWHPDDX[LOLDUGHO VLVWHPDYHQRVRTXHUHFLEHHOQRPEUHGHFLUFXODFLyQSRUWDO 8QFLHUWRYROXPHQGHVDQJUHSURFHGHQWHGHOLQWHVWLQRFRQIOXHHQODYHQDSRUWDHV WUDQVSRUWDGR KDFLD HO KtJDGR $TXt SHQHWUD HQ XQRV FDSLODUHV DELHUWRV GHQRPLQDGRV VLQXVRLGHVGRQGHHQWUDHQFRQWDFWRGLUHFWRFRQODVFpOXODVKHSiWLFDV
- 1516. (Q HO KtJDGR VH SURGXFHQ FDPELRV LPSRUWDQWHV HQ OD VDQJUH YHKtFXOR GH ORV SURGXFWRVGHODGLJHVWLyQTXHDFDEDQGHDEVRUEHUVH DWUDYpVGHORVFDSLODUHVLQWHVWLQDOHV /DV YHQDV UHFRJHQ OD VDQJUH GH QXHYR OD LQFRUSRUDQ D OD FLUFXODFLyQ JHQHUDO KDFLD OD DXUtFXODGHUHFKD $PHGLGDTXHDYDQ]DDWUDYpVGHRWURVyUJDQRVODVDQJUHVXIUHPiVPRGLILFDFLRQHV LUFXODFLyQFRURQDULD /DFLUFXODFLyQFRURQDULDLUULJDORVWHMLGRVGHOFRUD]yQDSRUWDQGRQXWULHQWHVR[tJHQR UHWLUDQGR ORV SURGXFWRV GH GHJUDGDFLyQ (Q OD SDUWH VXSHULRU GH ODV YiOYXODV VHPLOXQDUHV QDFHQGHODDRUWDGRVDUWHULDVFRURQDULDV'HVSXpVpVWDVVHGLYLGHQHQXQDFRPSOLFDGDUHG FDSLODUHQHOWHMLGRPXVFXODUFDUGLDFRODVYiOYXODV /DVDQJUHSURFHGHQWHGHODFLUFXODFLyQFDSLODUFRURQDULDVHUH~QHHQGLYHUVDVYHQDV SHTXHxDVTXHGHVSXpVGHVHPERFDQGLUHFWDPHQWHHQODDXUtFXODGHUHFKDVLQSDVDUSRUOD YHQDFDYD )XQFLyQFDUGLDFD /D DFWLYLGDG GHO FRUD]yQ FRQVLVWH HQ OD DOWHUQDQFLDVXFHVLYDGHFRQWUDFFLyQVtVWROH
- 1517. UHODMDFLyQ GLiVWROH
- 1518. GHODVSDUHGHVPXVFXODUHVGHODVDXUtFXODV ORVYHQWUtFXORV 'XUDQWHHOSHULRGRGHUHODMDFLyQODVDQJUHIOXH GHVGHODVYHQDVKDFLDODVGRVDXUtFXODVODVGLODWDGH IRUPDJUDGXDO $O ILQDOGH HVWH SHULRGROD GLODWDFLyQ GH ODV DXUtFXODV HV FRPSOHWD 6XV SDUHGHV PXVFXODUHV VH FRQWUDHQ HLPSXOVDQWRGRVXFRQWHQLGRDWUDYpVGHORV RULILFLRVDXULFXORYHQWULFXODUHVKDFLDORVYHQWUtFXORV (VWH SURFHVR HV UiSLGR VH SURGXFH FDVL GH IRUPDVLPXOWiQHDHQDPEDVDXUtFXODV/DPDVDGHVDQJUHHQODVYHQDVKDFHLPSRVLEOHHO UHIOXMR/DIXHU]DGHOIOXMRGHODVDQJUHHQORVYHQWUtFXORVQRHVOREDVWDQWHSRGHURVDSDUD DEULUODVYiOYXODVVHPLOXQDUHVSHURGLVWLHQGHORVYHQWUtFXORVTXHVHHQFXHQWUDQD~QHQXQ HVWDGRGHUHODMDFLyQ/DVYiOYXODVPLWUDOWULF~VSLGHVHDEUHQFRQODFRUULHQWHGHVDQJUHVH FLHUUDQDFRQWLQXDFLyQDOLQLFLRGHODFRQWUDFFLyQYHQWULFXODU
- 1519. /DVtVWROHYHQWULFXODUVLJXHGHLQPHGLDWRD OD VtVWROH DXULFXODU /D FRQWUDFFLyQ YHQWULFXODU HV PiV OHQWD SHUR PiV HQpUJLFD /DV FDYLGDGHV YHQWULFXODUHV VH YDFtDQ FDVL SRU FRPSOHWR FRQ FDGD VtVWROH /D SXQWD FDUGLDFD VH GHVSOD]D KDFLD GHODQWH KDFLD DUULED FRQ XQ OLJHUR PRYLPLHQWR GH URWDFLyQ(VWHLPSXOVRGHQRPLQDGRHOFKRTXHGH OD SXQWDVHSXHGHHVFXFKDUDOSDOSDUHQHOHVSDFLR HQWUH ODTXLQWDODVH[WDFRVWLOOD 'HVSXpV GH TXH VH SURGXFH OD VtVWROH YHQWULFXODU HO FRUD]yQ TXHGD HQ FRPSOHWR UHSRVR GXUDQWH XQ EUHYH HVSDFLR GH WLHPSR (O FLFOR FRPSOHWR VH SXHGH GLYLGLU HQ WUHV SHULRGRV ODVDXUtFXODVVHFRQWUDHQ VHSURGXFHODFRQWUDFFLyQGHORVYHQWUtFXORV DXUtFXODVYHQWUtFXORVSHUPDQHFHQHQUHSRVR (QORVVHUHVKXPDQRVODIUHFXHQFLDFDUGLDFDQRUPDOHVGHODWLGRVSRUPLQXWRHO FLFOR FDUGLDFR WLHQH XQD GXUDFLyQ DSUR[LPDGD GH VHJXQGRV /D VtVWROH DXULFXODU GXUD DOUHGHGRUGHVHJXQGRVODYHQWULFXODUVHJXQGRV3RUORWDQWRHOFRUD]yQVHHQFXHQWUD UHODMDGRGXUDQWHXQ HVSDFLRGHVHJXQGRVFDVLODPLWDGGHFDGDFLFORFDUGLDFR (QFDGDODWLGRHOFRUD]yQHPLWHGRVVRQLGRVTXHVHFRQWLQ~DQGHVSXpVGHXQDEUHYH SDXVD(OSULPHUWRQRTXHFRLQFLGHFRQHOFLHUUHGHODVYiOYXODVWULF~VSLGHPLWUDOHOLQLFLR GHODVtVWROHYHQWULFXODUHVVRUGRSURORQJDGR(OVHJXQGRWRQRTXHVHGHEHDOFLHUUHEUXVFR GH ODV YiOYXODV VHPLOXQDUHV HV PiV FRUWR DJXGR /DV HQIHUPHGDGHV TXH DIHFWDQ D ODV YiOYXODVFDUGLDFDVSXHGHQPRGLILFDUHVWRVUXLGRVPXFKRVIDFWRUHVHQWUHHOORVHOHMHUFLFLR SURYRFDQJUDQGHVYDULDFLRQHVHQHOODWLGRFDUGLDFRLQFOXVRHQODJHQWHVDQD /DIUHFXHQFLDFDUGLDFDQRUPDOGHORVDQLPDOHVYDUtDPXFKRGHXQDHVSHFLHDRWUD(Q XQ H[WUHPR VH HQFXHQWUD HO FRUD]yQ GH ORV PDPtIHURV TXH KLEHUQDQ TXH SXHGH ODWLU VyOR
- 1520. DOJXQDVYHFHVSRUPLQXWRPLHQWUDVTXHHQHORWUR ODIUHFXHQFLDFDUGLDFDGHOFROLEUtHVGH ODWLGRVSRUPLQXWR 3XOVR XDQGR OD VDQJUH HV LPSXOVDGD KDFLD ODV DUWHULDV SRUODFRQWUDFFLyQYHQWULFXODUVX SDUHGVHGLVWLHQGH'XUDQWHODGLiVWROH ODVDUWHULDVUHFXSHUDQVXGLiPHWURQRUPDOGHELGRHQ JUDQPHGLGDDODHODVWLFLGDGGHOWHMLGRFRQMXQWLYRDODFRQWUDFFLyQGHODVILEUDVPXVFXODUHV GHODVSDUHGHVGHODVDUWHULDV (VWDUHFXSHUDFLyQGHOWDPDxRQRUPDOHVLPSRUWDQWHSDUDPDQWHQHUHOIOXMRFRQWLQXRGH VDQJUHDWUDYpVGHORVFDSLODUHVGXUDQWHHOSHULRGRGHUHSRVRGHOFRUD]yQ/DGLODWDFLyQ FRQWUDFFLyQGHODVSDUHGHVDUWHULDOHVTXHVHSXHGHSHUFLELUFHUFDGHODVXSHUILFLHFXWiQHDHQ WRGDVODVDUWHULDVUHFLEHHOQRPEUHGHSXOVR /RVODWLGRVFDUGLDFRV /DIUHFXHQFLDHLQWHQVLGDGGHORVODWLGRVFDUGLDFRVHVWiQVXMHWRVDXQFRQWUROQHUYLRVR DWUDYpVGHXQDVHULHGHUHIOHMRVTXHORVDFHOHUDQRGLVPLQXHQ6LQHPEDUJRHOLPSXOVRGH ODFRQWUDFFLyQQRGHSHQGHGHHVWtPXORVQHUYLRVRVH[WHUQRVVLQRTXHVHRULJLQDHQHOSURSLR P~VFXORFDUGLDFR (O UHVSRQVDEOH GH LQLFLDU HO ODWLGR FDUGLDFR HV XQD SHTXHxD IUDFFLyQ GH WHMLGR HVSHFLDOL]DGR LQPHUVR HQ OD SDUHG GH OD DXUtFXOD GHUHFKD HO QRGR R QyGXOR VLQXVDO 'HVSXpVODFRQWUDFFLyQVHSURSDJDDODSDUWH LQIHULRUGHODDXUtFXODGHUHFKDSRUORVOODPDGRV IDVFtFXORV LQWHUQRGDOHV HV HO QRGR OODPDGR DXULFXORYHQWULFXODU /RV KDFHV DXULFXORYHQWULFXODUHVDJUXSDGRVHQHOOODPDGRIDVFtFXORRKD]GH+LVFRQGXFHQHOLPSXOVR GHVGHHVWHQRGRDORVP~VFXORVGHORVYHQWUtFXORVGHHVWDIRUPDVHFRRUGLQDODFRQWUDFFLyQ UHODMDFLyQGHOFRUD]yQ DGD IDVH GHO FLFOR FDUGLDFR HVWi DVRFLDGD FRQ OD SURGXFFLyQ GH XQ SRWHQFLDO HQHUJpWLFR GHWHFWDEOH FRQ LQVWUXPHQWRV HOpFWULFRV FRQILJXUDQGR XQ UHJLVWUR GHQRPLQDGR HOHFWURFDUGLRJUDPD
- 1521. 5HGFDSLODU 8QDUHGGHPLQ~VFXORVYDVRVVDQJXtQHRVVHUDPLILFDGHVGHODVDUWHULRODVSDUDOOHYDUVDQJUHDWRGRVORV WHMLGRV (VWRV SHTXHxRV FDSLODUHV FRQYHUJHQ HQ YDVRV FDGD YH] PiV JUDQGHV TXH OOHYDQ OD VDQJUH GHVR[LJHQDGDD]XO
- 1522. GHYXHOWDDOFRUD]yQ DSLODUHV /DFLUFXODFLyQGHODVDQJUHHQORVFDSLODUHVVXSHUILFLDOHVVHSXHGHREVHUYDUPHGLDQWH HOPLFURVFRSLR6HSXHGHYHUDYDQ]DUORVJOyEXORVURMRVFRQUDSLGH]HQOD]RQDPHGLDGHOD FRUULHQWHVDQJXtQHDPLHQWUDVTXHORVJOyEXORVEODQFRVVHGHVSOD]DQFRQPiVOHQWLWXGVH HQFXHQWUDQSUy[LPRVDODVSDUHGHVGHORVFDSLODUHV /DVXSHUILFLHTXHHQWUDHQFRQWDFWRFRQODVDQJUHHVPXFKRPDRUHQORVFDSLODUHV TXH HQ HO UHVWR GH ORV YDVRV VDQJXtQHRV SRU OR WDQWR RIUHFH XQD PDRU UHVLVWHQFLD DO PRYLPLHQWR GH OD VDQJUH SRU OR TXH HMHUFHQ XQD JUDQ LQIOXHQFLD VREUH OD FLUFXODFLyQ /RV FDSLODUHVVHGLODWDQFXDQGRODWHPSHUDWXUDVHHOHYDHQIULDQGRGHHVWDIRUPDODVDQJUHVH FRQWUDHQFRQHOIUtRFRQORTXHSUHVHUYDQHOFDORUGHORUJDQLVPR 7DPELpQGHVHPSHxDQXQSDSHOPXLPSRUWDQWHHQHOLQWHUFDPELRGHVXVWDQFLDVHQWUH ODVDQJUHORVWHMLGRVGHELGRDODSHUPHDELOLGDGGHODVSDUHGHVGHORVFDSLODUHVpVWRVOOHYDQ R[tJHQRKDVWDORVWHMLGRVWRPDQGHHOORVVXVWDQFLDVGHGHVHFKRGLy[LGRGHDUERQR2
- 1523. TXH WUDQVSRUWDQ KDVWD ORV yUJDQRV H[FUHWRUHV ORV SXOPRQHV UHVSHFWLYDPHQWH $OOt VH SURGXFHGHQXHYRXQLQWHUFDPELRGHVXVWDQFLDVGHIRUPDTXHODVDQJUHTXHGDR[LJHQDGD OLEUHGHLPSXUH]DV
- 1524. 7HQVLyQDUWHULDO (VODUHVXOWDQWHGHODSUHVLyQHMHUFLGDSRUODVDQJUHVREUHODVSDUHGHVGHODVDUWHULDV /D WHQVLyQ DUWHULDO HV XQ tQGLFH GH GLDJQyVWLFR LPSRUWDQWH HQ HVSHFLDO GH OD IXQFLyQ FLUFXODWRULD 'HELGR DTXHHOFRUD]yQSXHGHLPSXOVDUKDFLDODVJUDQGHVDUWHULDVXQYROXPHQGH VDQJUH PDRU TXH HO TXH ODV SHTXHxDV DUWHULRODV FDSLODUHV SXHGHQ DEVRUEHU OD SUHVLyQ UHWUyJUDGDUHVXOWDQWHVHHMHUFHFRQWUDODVDUWHULDVXDOTXLHUWUDVWRUQRTXHGLODWHRFRQWUDLJD ORV YDVRV VDQJXtQHRV R DIHFWH D VX HODVWLFLGDG R FXDOTXLHU HQIHUPHGDG FDUGLDFD TXH LQWHUILHUDFRQODIXQFLyQGHERPEHRGHOFRUD]yQDIHFWDDODSUHVLyQVDQJXtQHD (Q ODV SHUVRQDV VDQDV OD WHQVLyQ DUWHULDO QRUPDO VH VXHOH PDQWHQHU GHQWUR GH XQ PDUJHQGHWHUPLQDGR(OFRPSOHMRPHFDQLVPRQHUYLRVRTXHHTXLOLEUDFRRUGLQDODDFWLYLGDG GHOFRUD]yQGHODVILEUDVPXVFXODUHVGHODVDUWHULDVFRQWURODGRSRUORVFHQWURVQHUYLRVRV FHUHEURHVSLQDOVLPSiWLFRSHUPLWHXQDDPSOLDYDULDFLyQORFDOGHODWDVDGHIOXMRVDQJXtQHR VLQDOWHUDUODWHQVLyQDUWHULDOVLVWpPLFD 3DUDPHGLUODWHQVLyQDUWHULDOVHWLHQHQHQFXHQWDGRVYDORUHVHOSXQWRDOWRRPi[LPR HQHOTXHHOFRUD]yQVHFRQWUDHSDUDYDFLDUVXVDQJUHHQODFLUFXODFLyQOODPDGRVtVWROHHO SXQWREDMRRPtQLPRHQHOTXHHOFRUD]yQVHUHODMDSDUDOOHQDUVHFRQODVDQJUHTXHUHJUHVD GHODFLUFXODFLyQOODPDGRGLiVWROH /DSUHVLyQVHPLGHHQPLOtPHWURVGHPHUFXULRPP+J
- 1525. FRQODDXGDGHXQLQVWUXPHQWR GHQRPLQDGRHVILJPRPDQyPHWURRQVWDGHXQ PDQJXLWR GH JRPDLQIODEOHFRQHFWDGRDXQ GLVSRVLWLYR TXH GHWHFWD OD SUHVLyQ FRQ XQ PDUFDGRU RQ HO PDQJXLWR VH URGHD HO EUD]R L]TXLHUGRVHLQVXIODDSUHWDQGRXQDSHUDGHJRPDFRQHFWDGDDpVWHSRUXQWXER 0LHQWUDVHOPpGLFRUHDOL]DODH[SORUDFLyQDXVFXOWDFRQXQHVWHWRVFRSLRDSOLFDGRVREUH XQDDUWHULDHQHODQWHEUD]R$PHGLGDTXHHOPDQJXLWRVHH[SDQGHVH FRPSULPHODDUWHULDGH IRUPDJUDGXDO(OSXQWRHQHOTXHHOPDQJXLWRLQWHUUXPSHODFLUFXODFLyQODVSXOVDFLRQHVQR VRQ DXGLEOHV GHWHUPLQD OD SUHVLyQ VLVWyOLFD R SUHVLyQ Pi[LPD 6LQ HPEDUJR VX OHFWXUD KDELWXDOVHUHDOL]DFXDQGRDOGHVLQIODUOROHQWDPHQWHODFLUFXODFLyQVHUHVWDEOHFH(QWRQFHVHV
- 1526. SRVLEOHHVFXFKDUXQVRQLGRHQpUJLFRDPHGLGDTXHODFRQWUDFFLyQFDUGLDFDLPSXOVDODVDQJUH DWUDYpVGHODVDUWHULDV 'HVSXpVVHSHUPLWHTXHHOPDQJXLWRVHGHVLQIOHJUDGXDOPHQWHKDVWDTXHGHQXHYRHO VRQLGR GHO IOXMR VDQJXtQHR GHVDSDUHFH /D OHFWXUD HQ HVWH SXQWR GHWHUPLQD OD SUHVLyQ GLDVWyOLFD RSUHVLyQPtQLPD TXHVHSURGXFHGXUDQWHODUHODMDFLyQGHOFRUD]yQ'XUDQWHXQ FLFOR FDUGLDFR R ODWLGR OD WHQVLyQ DUWHULDO YDUtD GHVGH XQ Pi[LPR GXUDQWH OD VtVWROH D XQ PtQLPRGXUDQWHODGLiVWROH 3RUORJHQHUDODPEDVGHWHUPLQDFLRQHVVHGHVFULEHQFRPRXQDH[SUHVLyQSURSRUFLRQDO GHOPiVHOHYDGRVREUHHOLQIHULRUSRUHMHPSORXDQGRVHDSRUWDXQDVRODFLIUDpVWD VXHOH FRUUHVSRQGHU DO SXQWR Pi[LPR R SUHVLyQ VLVWyOLFD 6LQ HPEDUJR RWUD FLIUD VLPSOH GHQRPLQDGDFRPRSUHVLyQGHSXOVRHVHOLQWHUYDORRGLIHUHQFLDHQWUHODSUHVLyQPiVHOHYDGD PiVEDMD3RUORWDQWRHQXQDSUHVLyQGHWHUPLQDGDFRPRODSUHVLyQPHGLDVHUi (Q ODV SHUVRQDV VDQDV OD WHQVLyQ DUWHULDO YDUtD GHVGH HQ ODFWDQWHV D XQRV DORVDxRVKDVWDDORVRPiV(VWHDXPHQWRVHSURGXFHFXDQGRODV DUWHULDV SLHUGHQ VX HODVWLFLGDG TXH HQ ODV SHUVRQDV MyYHQHV DEVRUEH HO LPSXOVR GH ODV FRQWUDFFLRQHV FDUGLDFDV /D WHQVLyQ DUWHULDO YDUtD HQWUH ODV SHUVRQDV HQ XQ PLVPR LQGLYLGXR HQ PRPHQWRV GLIHUHQWHV 6XHOH VHU PiV HOHYDGD HQ ORV KRPEUHV TXH HQ ODV PXMHUHV ORV QLxRV HV PHQRU GXUDQWH HO VXHxR HVWi LQIOXLGD SRU XQD JUDQ YDULHGDG GH IDFWRUHV 0XFKDVSHUVRQDVVDQDVWLHQHQXQDSUHVLyQVLVWyOLFDKDELWXDOGHDTXHQRHVWi DVRFLDGDFRQVtQWRPDVRHQIHUPHGDG/DWHQVLyQDUWHULDOHOHYDGDVLQPRWLYRVDSDUHQWHVR KLSHUWHQVLyQ HVHQFLDO VH FRQVLGHUD XQD FDXVD TXH FRQWULEXH D OD DUWHULRVFOHURVLV /DV WR[LQDV JHQHUDGDV GHQWUR GHO RUJDQLVPR SURYRFDQ XQD KLSHUWHQVLyQ H[WUHPD HQ GLYHUVDV HQIHUPHGDGHV /D SUHVLyQ EDMD GH IRUPD DQRUPDO R KLSRWHQVLyQ VH REVHUYD HQ HQIHUPHGDGHV LQIHFFLRVDVGHELOLWDQWHVKHPRUUDJLDFRODSVR8QDSUHVLyQVLVWyOLFDLQIHULRUDVHVXHOH DVRFLDUFRQXQHVWDGRGHVKRFN
- 1527. 1 LA TEORÍA DE LA EVOLUCIÓN 1.- PERSPECTIVA HISTÓRICA Aunque en casi todas las épocas históricas encontramos pensadores que defendieron ciertas posiciones evolucionistas, hasta hace poco más de un siglo se creía, casi universalmente, que todas las especies vivientes habían sido creadas independientemente unas de otras. Esta opinión era sustentada por casi todas las concepciones religiosas y por la mayoría de los filósofos y científicos. 1.1.- EL FIJISMO La admisión generalizada de la teoría de la evolución es un hecho relativamente reciente. La teoría que ha prevalecido hasta el siglo XIX ha sido la inversa: el fijismo, según la cual las distintas especies -vegetales o animales- son invariables o «fijas», lo que implica aceptar su aparición única y espontánea, la total independencia de las especies entre sí y la ausencia de evolución. Las especies habrían sido creadas por Dios tal y como son desde el principio (creacionismo); los restos fósiles no deben interpretarse como «antecesores» de los seres vivos actuales, sino como especies desaparecidas. En el siglo XVIII dos ilustres representantes del fijismo fueron el sueco Linneo, autor de la primera taxonomía importante, y el francés George Cuvier, auténtico fundador de la Paleontología, gracias a sus hallazgos de animales fósiles. 1.2.- LA TEORÍA DE LA EVOLUCIÓN En el año 1809, el mismo en que nace Darwin, publica Lamarck su obra “Filosofía zoológica”, en la que expone su teoría de la evolución por medio de la adaptación de las especies al medio, y la creación, desarrollo o atrofia de los órganos necesarios para esta adaptación. Sin embargo, hasta mediado el siglo XIX, las teorías evolucionistas no van a abrirse paso de modo definitivo. Se debe al inglés Charles Darwin la formulación más precisa y rigurosa del evolucionismo, en la obra de 1859 “El origen de las especies por medio de la selección natural”. Junto a Darwin, y como descubridor simultáneo de la teoría, hay que registrar siempre el nombre de Alfred Russel Wallace. Después de Darwin, el evolucionismo ha seguido un curso ascendente, hacién- dose cada vez más firme como teoría científica. Podemos citar como más destacados continuadores a Thomas Huxley -amigo y continuador de Darwin- y su nieto Julian Huxley creador de una teoría sintética de la evolución; el naturalista alemán Haeckel, el ruso Oparin, el francés Teilhard de Chardin, etc. 2.- EL PROCESO EVOLUTIVO SEGÚN LAMARCK En 1809, Lamarck publicó su obra fundamental, “Filosofía zoológica”, y en ella afirma que los seres vivientes poseen una tendencia a desarrollarse y a multiplicar sus órganos y sus formas, dando lugar a que éstos sean cada vez más perfectos. Todas las especies vegetales y animales procederían de otras especies anteriores menos desarrolladas y más imperfectas. Su teoría podría sintetizarse así: 1. La vida se desarrolla y desenvuelve siempre en un medio determinado, en el que pueden producirse cambios.
- 1528. 2 2. Estos cambios en el medio originan una serie de necesidades en el viviente para adaptarse a las nuevas circunstancias. 3. Estas necesidades determinan el desarrollo o atrofia de órganos ya exis- tentes, o, incluso, la aparición de órganos nuevos. El principio fundamental de esta teoría sería: la función crea el órgano y la necesidad la función. Si un órgano se usa con frecuencia, tiende a desarrollarse y a aumentar su capacidad; en cambio, si un órgano no se utiliza, se debilita, se reduce y termina por desaparecer. El órgano que se utiliza se hipertrofia, el órgano que no se utiliza se atrofia. El cambio del medio o del clima provocaría la modificación de las actividades, convirtiéndose tal modificación en un hábito heredable. Algunos de los cambios o variaciones efectuadas por determinados especimenes se transmiten por herencia a sus descendientes, pudiendo, de esta manera, dar lugar a nuevas especies. Para ilustrar su teoría, el propio Lamarck propuso algunos ejemplos de variaciones animales, por ej., los topos, que pasan casi toda su vida bajo tierra y sin luz, apenas utilizan el sentido de la vista y, en consecuencia, casi la han perdido debido a que sus ojos son diminutos y están profundamente hundidos. La jirafa se alimenta del follaje de los árboles, todo su cuerpo tiende hacia arriba, por lo que se le han alargado el cuello y las patas delanteras. Los patos, las ocas y los animales palmípedos, que tienden a vivir en lugares con abundancia de agua, han desarrollado en las patas una membrana interdigital que les facilita la natación. El concepto de herencia constituye la clave de la teoría lamarckiana. No basta con que surjan variaciones en los individuos para que se produzcan modificaciones en las especies; es necesario, además, que estas variaciones individuales sean heredadas por sus descendientes. En este sentido, la evolución para este científico posee un carácter finalista, es decir, según él, en el proceso evolutivo van surgiendo cada vez especies mejor dotadas, más desarrolladas, más perfectas. 3.- EL DARWINISMO. El británico Ch. Darwin fue el primer científico que de una manera explícita defendió la evolución de todas las especies de seres vivos. Con anterioridad, Lamarck había formulado una teoría evolucionista, pero parecía excluir de la evolución a la especie humana. Para Darwin, en cambio, no cabía la menor duda de que el ser humano se encuentra inmerso en el mismo proceso evolutivo que el resto de los seres naturales. Darwin publicó en 1859 “El origen de las especies...” y, más tarde, en 1871, “El origen del hombre”. En estas obras presentó una teoría completa sobre la evolución, según la cual el conjunto de las especies animales y vegetales actuales procede de otras especies anteriores. La teoría de Darwin no va del medio al viviente, sino del viviente al medio. No se trata de un proceso de adaptación, sino de selección natural. En “El origen de las especies...” se desarrollaban cuatro tesis fundamentales, las dos primeras en concordancia con Lamark, no así las dos segundas: 1. El mundo no es estático, sino que evoluciona; las especies cambian constantemente, se origina unas y se extinguen otras. 2. El proceso de evolución, en general, es gradual y continuo; no consiste en saltos discontinuos o súbitos. 3. Los organismos semejantes están emparentados y descienden de un antepasado común. Lamark, por el contrario, pensaba que cada grupo de organismos representaba una línea evolutiva independiente originada por generación espontánea.
- 1529. 3 4. LA SELECCIÓN NATURAL: El cambio evolutivo no es el resultado de un impulso misterioso, ni una simple cuestión de azar, sino el resultado de la selección natural, la cual tiene dos fases: a. PRODUCCIÓN DE LA VARIABILIDAD: Cada generación posee cantidad de variaciones. b. SELECCIÓN A TRAVÉS DE LA SUPERVIVENCIA EN LA LUCHA POR LA EXISTENCIA. En una población compuesta por millones de individuos, algunos tendrán dotaciones genéticas mejor adaptadas para hacer frente al conjunto de presiones ecológicas dominantes en su entorno, poseyendo una probabilidad de supervivencia y de procreación mayor que el resto de los miembros. De esta manera se determina la dirección del proceso evolutivo. Darwin entiende que las especies -y, claro está, los individuos que las constituyen- tienen que sostener una auténtica lucha por la existencia. Esta lucha contra el medio, en sus rasgos generales, puede considerarse de tres modos distintos: a) Como lucha de unos animales contra otros - vg., la de los congéneres machos en época de celo. b) Como lucha por la supervivencia entre animales cazadores y presas. c) Como lucha de los animales en el medio en el que se desarrolla su vida. Según Darwin, sobreviven siempre los más aptos. En la lucha entre congéneres machos vencerá el más fuerte, que es el que se emparejará y dejará descendencia; en la lucha entre cazadores y presas vencerá también el mejor dotado para huir o para atacar; si una manada de lobos persigue a unos ciervos, serán cazados los ciervos menos veloces y resistentes por los lobos más fuertes, y los ciervos más ágiles huirán, quedándose sin sustento los lobos viejos, lentos, etc. En cualquier caso, sobreviven siempre los más aptos. Esta mayor aptitud no es algo que los animales se puedan proponer para adaptarse al medio, tal y como pretendía Lamark; se trata más bien de lo contrario, los animales que se adaptan son considerados por ello los más aptos. A esto es a lo que Darwin llamó selección natural. Si el medio es adverso, el ser vivo no puede hacer que sus órganos se adapten a ese medio, simplemente perece. Según Darwin, ocurre exactamente al contrario: hay animales que nacen con variaciones morfológicas y funcionales; si estas variaciones son inútiles, si no sirven al ser vivo para adaptarse al medio, el viviente perece; pero si son útiles, permitiéndole adaptarse al medio, entonces sobrevive, produciéndose una selección natural, la cual no actúa de modo consciente o predeterminado, no persigue ningún fin; no es ella la causa, sino el resultado de las variaciones. Las variaciones útiles son hereditarias por ser variaciones de nacimiento. Aunque Darwin no tenía este punto muy claro, opinaba que tales variaciones estaban relacionadas con las condiciones de vida a las que ha estado sometida la especie durante varias generaciones 1 . Si bien hoy es aceptada en general la idea de evolución con toda su base científica, tal idea no cierra la cuestión sobre qué es el ser humano, sino que por el contrario nos sumerge en nuevas incógnitas: ¿Es el ser humano mera materia, aunque altamente organizada? ¿Puede hablarse de principio espiritual diferente a esa materia? ¿Es incompatible el evolucionismo con cualquier credo religioso de corte creacionista? ¿Es la evolución un proceso ciego y azaroso o responde a alguna finalidad? ¿Somos mero fruto de una combinación genética azarosa? ¿Somos el 1 La teoría de Darwin vino a ser confirmada por los resultados de la genética. Los primeros descubrimientos sobre las leyes de la herencia fueron los de Mendel (1866), que encontró las unidades de la herencia: los genes, aportando con ello luz sobre el problema de la transmisión de las variaciones heredables. Los estudios posteriores de De Vries, Johannsen y de Morgan en torno a las mutaciones de la drodophila melanogaster (1910), que mostró que los genes estaban en los cromosomas, fueron decisivos. Posteriores estudios como los de Watson y Crick (1953) en torno a la estructura del ADN y de español Severo Ochoa sobre el ARN, han ido aclarando la complejidad del código genético.
- 1530. 4 resultado del azar y/o de la necesidad? ¿Podemos utilizar la genética para transformar el destino o para crear nuevas especies?... 4.- POSICIÓN ACTUAL En la actualidad, los datos suministrados por las diversas ciencias geológicas y paleontológicas ponen en evidencia que unas especies proceden de otras y que la vida se encuentra siempre evolucionando. La vida se manifiesta según una sucesión de formas escalonadas en las que unas estructuras vitales provienen de otras anteriores, y todas las especies animales y vegetales actualmente conocidas son fruto de la evolución de otras especies precedentes. Según esta concepción, la mayor parte de los grupos de seres vivos se deriva, en última instancia, de las formas elementales de vida aparecidas hace dos o tres mil millones de años. Las teorías actuales defienden que el mundo de los seres vivos es un entramado complejo de especies sometido a una lenta pero constante evolución en la que, de acuerdo con Darwin, interviene un proceso de selección natural, pero también, como decía H. de Vries, se encuentra sometida a la acción de las mutaciones. Las alteraciones en la ordenación o en la estructura del ADN del núcleo de las células germinales originan cromosomas distintos (mutaciones) y, si estas alteraciones son ventajosas, pueden ocasionar cambios evolutivos. Ahora bien, para que dichos cambios se produzcan es necesario que las variaciones cromosómicas se transmitan mediante la herencia, y en ésta desempeña un papel destacado la selección natural, ya que ella determina qué clase de seres se reproducirán y, por tanto, qué clase de mutaciones se transmitirán y qué especies pueden surgir. A este respecto, se piensa que en el proceso, dirección, velocidad, etc., de la evolución intervienen una gran cantidad de factores, a saber, las influencias del medio o cambios ambientales, la longevidad de los individuos de la especie, el número de especimenes afectados por la variación, la amplitud y las características del proceso mutacional, la relación de unos especimenes con otros, etc. En este sentido, la Paleontología presenta especies fósiles que prácticamente no han sufrido alteraciones desde épocas muy remotas; así, algunas especies de seres vivos adaptadas a ciertos medios aislados, y protegidas de la competencia de otros seres, evolucionan más lentamente que aquellas especies que viven en espacios abiertos, en proximidad y competencia con otras especies semejantes. Por ejemplo, la ausencia en Australia de animales depredadores ha permitido la persistencia de una fauna arcaica, formada por numerosas especies de mamíferos inferiores y auténticos fósiles vivientes extintos en el resto de los continentes. Pero la introducción en tiempos recientes de ciertos animales (perros, ovejas, ratones y conejos), y el comportamiento de los seres humanos, están alterando el equilibrio y varias especies se encuentran en peligro de extinción.
- 1531. Derechos reservados © 2001 Lillian Bird y José Molinelli LA BIODIVERSIDAD La biodiversidad se refiere a la variedad de especies de plantas, animales y otras formas de vida presentes en el Planeta. Esta biodiversidad comprende no tan solo los diferentes biomas y ecosistemas que se dan en el Planeta, sino también la variedad de especies presentes en los mismos y la diversidad genética que existe entre los miembros de cada especie. La preservación de esta biodiversidad depende en gran medida de la conservación de los hábitats en que cada una de estas especies lleva a cabo sus procesos vitales. El hábitat provee alimento y protección a las distintas especies. Cada especie, a su vez, aporta al hábitat ya sea esparciendo semillas, abonando el suelo con sus desechos, evitando el crecimiento desmedido de otras especies, y protegiéndolo de la entrada de depredadores que podrían eliminar alguna especie esencial para el balance ecológico. Las especies de plantas y animales se adaptan a su hábitat a tal grado que les sería prácticamente imposible sobrevivir bajo condiciones diferentes de temperatura, humedad, disponibilidad de alimentos, especies depredadoras, y otras. Diferentes tipos de biodiversidad Podemos referirnos a tres tipos de biodiversidad: la diversidad genética, la diversidad de especies y la diversidad de ecosistemas. A continuación se explica cada una de ellas. Diversidad genética - La diversidad genética se refiere a la variación en expresión genética que existe para cada especie. Si tomamos el caso del ser humano, veremos que el color de los ojos (una expresión genética) tiene varias posibilidades entre las que se encuentran distintas tonalidades de negro, marrón, verde, azul y gris. Si solo permitimos que se reproduzcan aquellas personas con ojos de color marrón, al cabo de algunas generaciones habríamos perdido la diversidad genética que da lugar a los demás colores de ojos. La diversidad genética es lo que hace que algunas especies de plantas y animales sean más resistentes que otras a temperaturas extremas, eventos de sequía, cambios en la disponibilidad de alimentos, enfermedades y otros.
- 1532. -2- Derechos reservados © 2001 Lillian Bird y José Molinelli Mientras mayor diversidad genética posea una especie, mayor será su capacidad de adaptación a distintas condiciones. Por esto, una especie que exhibe poca diversidad genética es más vulnerable a la extinción. La domesticación de especies trae consigo una disminución en la diversidad genética, ya que la selección sistemática a través de los años de unas características sobre otras hace que se pierdan variantes genéticas. Medir la diversidad genética es un proceso muy costoso. Por esto, los científicos prefieren medir la biodiversidad en términos del número de especies. Diversidad de especies - La diversidad de especies se refiere a la variación en el número de especies presentes en una región. Un concepto importante asociado al de la diversidad de especies es el de diversidad taxonómica. La diversidad taxonómica considera no sólo el número de especies distintas en una región, sino la variedad de categorías taxonómicas representadas en estas especies. Una región con tres especies distintas de árboles tendrá una diversidad taxonómica menor que una región con una especie de árbol, una especie de ave y una especie de insecto. Esto es así porque las diferencias genéticas entre un árbol, un ave y un insecto son mucho mayores que entre tres árboles por distintos que sean. Por otra parte, si bien hay más especies de animales terrestres que acuáticos, las especies terrestres están más relacionadas entre sí que las especies acuáticas. Por esto, la diversidad de vida en los ecosistemas marinos es mucho mayor que la diversidad de vida en los ecosistemas terrestres. Diversidad de ecosistemas - La diversidad de ecosistemas se refiere a la variación en los tipos de hábitats de especies. La diversidad de ecosistemas es difícil de medir, ya que los mismos no tienen fronteras específicas que dividan unos de otros. El término ecosistema se refiere a una comunidad de organismos que interactúan entre sí y con los componentes físicos y químicos del ambiente en el que habitan. Estos componentes físicos y químicos incluyen la luz solar, la precipitación, los nutrientes presentes en el suelo, el clima, la salinidad, y otros. Los ecosistemas son sistemas abiertos que intercambian energía, nutrientes e incluso organismos individuales (aves, insectos, semillas) con los alrededores. Por esto, es muy difícil definir los límites físicos de un ecosistema.
- 1533. -3- Derechos reservados © 2001 Lillian Bird y José Molinelli ¿Cuántas especies existen? Se estima que existe un total de 10 millones de especies en el Planeta. Estas especies incluyen animales, plantas y una gran variedad de microorganismos. De estas 10 millones de especies, 1.4 millones ya han sido han debidamente identificados por los científicos, y los restantes 8.6 millones permanecen aún sin identificar. Al destruir un hábitat, por lo tanto, el ser humano no solo está eliminando especies conocidas, sino que también destruye especies que aún no han sido identificadas y que podrían ser la solución a muchos de los males que aquejan a la humanidad. ¿Dónde se encuentran esas especies? Las especies se encuentran diseminadas a través de los distintos biomas terrestres y acuáticos del Planeta. Los biomas son regiones de la Tierra que se caracterizan por presentar condiciones ambientales particulares en cuanto a su clima, topografía y suelo, y donde las especies de plantas y animales presentan características muy similares entre sí. Algunos de los biomas terrestres son el bosque tropical, el bosque deciduo, el bosque boreal o taiga, el desierto, la sabana y la tundra. Cada bioma terrestre se desarrolla bajo condiciones distintas de latitud, altura, temperatura, luz solar, humedad y promedio de precipitación anual. También existen biomas acuáticos, entre los que se encuentran los sistemas ribereños (ríos) y lacustres (lagos), los arrecifes de coral, los manglares, los estuarios, la zona pelágica y la zona abisal (el fondo del mar). Las especies que habitan en un bioma son diferentes a las de los demás, ya que están adaptadas a las condiciones específicas de ese ambiente en particular. Los biomas que muestran mayor biodiversidad son los manglares y arrecifes coralinos, y los bosques tropicales. Todos ellos se encuentran en latitudes cercanas al ecuador, y sirven de hábitat para decenas de miles de especies distintas. ¿Cuántas especies puede sostener un hábitat? La relación entre las especies y el ambiente de un hábitat es una sumamente estrecha. La extensión territorial de un hábitat, así como la diversidad y cantidad relativa de especies que en él habita, determinan la capacidad de
- 1534. -4- Derechos reservados © 2001 Lillian Bird y José Molinelli acarreo del mismo. La capacidad de acarreo se refiere al tamaño de la población que puede subsistir de forma indefinida en un hábitat dado sin agotar o dañar los recursos del mismo. De excederse la capacidad de acarreo de un hábitat, algunas de las especies que en él habitan comenzarán a morir por falta de recursos. ¿Qué hacen las especies para no exceder la capacidad de acarreo de su hábitat? En la naturaleza, las especies se ajustan a la capacidad de acarreo de su hábitat mediante diversos mecanismos. Estos mecanismos incluyen la territorialidad, las estrategias de reproducción y la jerarquía de dominación. A continuación se explica cada una de ellas. La territorialidad - Los individuos y grupos de una especie defienden su territorio porque su vida y la de sus crías depende de la disponibilidad de los recursos que hay en el mismo. La extensión territorial del área defendida será aquélla que provea la cantidad adecuada de alimentos necesarios para la subsistencia del grupo. En lugares donde la densidad y el valor nutricional de las especies que sirven de alimento son altos, los territorios tienen una extensión más reducida. Este es el caso de los arrecifes de coral, que proveen los nutrientes para decenas de miles de especies en un área bastante reducida. Por el contrario, en aquellos lugares donde la densidad y el valor nutricional de las especies que sirven de alimento son bajos, como es el caso de las sabana africana, el área territorial a ser defendida por las especies que de ella dependen es sumamente extensa. Por lo general, son los machos de la especie los que se dedican a la defensa del territorio, ya que las hembras deben dedicar toda su energía al proceso de reproducción, alimentación y crianza de los más pequeños. La territorialidad, o defensa del territorio, limita el que se exceda la capacidad de acarreo de un hábitat mediante dos mecanismos: 1) evita que individuos de otros grupos invadan el hábitat y compitan por los recursos presentes en el mismo; 2) mantiene a los machos alejados de las hembras durante gran parte del tiempo, limitando así la frecuencia y el número de nacimientos de nuevos individuos y, por lo tanto, la presión sobre los recursos alimentarios disponibles.
- 1535. -5- Derechos reservados © 2001 Lillian Bird y José Molinelli Las estrategias de reproducción - Los científicos han identificado dos estrategias distintas para la reproducción de especies. Algunos organismos utilizan lo que se define como la estrategia r, y otros la estrategia K, donde las letras r y K provienen de los símbolos utilizados para representar la rapidez de reproducción (r), y la capacidad de acarreo (K). Los organismos que se reproducen mediante la estrategia r son organismos pequeños que alcanzan la madurez en poco tiempo, tienen períodos de vida cortos, tienen crías numerosas (muchas de los cuales no logran llegar a la adultez), dedican poca o ninguna energía a la crianza de los más jóvenes de la especie, no cuentan con mecanismos para limitar su reproducción a la capacidad de acarreo de su hábitat, y tienden a ser oportunistas invadiendo nuevas áreas y adaptándose a las mismas con facilidad. En este grupo se encuentran la mayoría de los insectos, las plantas que se reproducen por esporas, las tortugas, los sapos y los conejos. La población de estas especies consideradas estrategas r depende mayormente de la rapidez con que se reproducen, y no de la capacidad de acarreo del hábitat. Las mismas sirven por lo general de fuente de alimento para las especies consideradas como estrategas K. Los estrategas K, por otra parte, son más grandes, maduran muy lentamente, tienden a vivir por un período de tiempo mayor, sus crías son más resistentes a enfermedades, tienen crías poco numerosas, dedican tiempo y energía a la crianza de los más pequeños, poseen mecanismos para limitar su reproducción y ajustarla a la capacidad de acarreo de su hábitat, y se mantienen en un hábitat en particular sin invadir los de otras especies. Por su estrecha dependencia en el hábitat, y su poca facilidad para adaptarse a nuevas situaciones, las especies en peligro de extinción son por lo general estrategas K. Por el número bajo de especies y la lentitud de su reproducción, los estrategas K rara vez sirven de fuente principal de alimento para otras especies bajo condiciones naturales. Entre los estrategas K se encuentra la mayor parte de los mamíferos, como los elefantes, el ganado y los seres humanos. Ambos tipos de especies tienen controles que limitan el número de individuos presentes en un hábitat. Los estrategas K se reproducen lentamente, lo que de por sí limita el número de individuos en el hábitat. Los estrategas r se reproducen con rapidez, pero pocos llegan a la adultez y muchos de los que llegan son depredados por los estrategas K, lo que también limita su número.
- 1536. -6- Derechos reservados © 2001 Lillian Bird y José Molinelli La jerarquía de dominación - Un gran número de especies establece una jerarquía de dominación como un método efectivo para reducir los conflictos en grupos sociales de una misma especie. Esta jerarquía es evidente en las abejas, las aves, los perros, los caballos, los lobos, e incluso en los seres humanos. Luego de competir por el poder y de definirse la jerarquía de liderato dentro del grupo, los individuos de una especie acatan las órdenes del más fuerte y ceden su espacio a aquéllos de mayor jerarquía. Esto hace que de reducirse la capacidad de acarreo de un hábitat en un momento dado, los líderes del grupo sean los que subsistan y se reproduzcan, asegurando así que la especie y la diversidad genética del más fuerte pase de generación en generación. ¿Qué actividades humanas atentan contra la diversidad de especies y ecosistemas? Varias actividades humanas atentan contra la diversidad de especies en la Tierra ya sea por su acción directa contra alguna especie en particular, o por su efecto sobre el hábitat de dichas especies. Entre las actividades humanas que amenazan la diversidad genética, de especies y de ecosistemas se encuentran las siguientes: La sobreexplotación de especies de plantas y animales - Los humanos ocasionamos la pérdida directa de individuos de muchas especies para propósitos comerciales, de alimentación o de entretenimiento. La matanza de elefantes para extraer el marfil de sus colmillos, la sobrepesca de peces y mariscos, y la sobrecaza de especies para fines deportivos son causa de la eliminación progresiva de muchas especies y de la diversidad genética que hay en ellas. En el caso de las plantas, el sobrepastoreo de ganado en una misma área elimina totalmente el pasto que en ella crece, afecta la sobrevivencia de los microorganismos que crecen en el suelo asociados a este pasto, y afecta la fuente de alimento del ganado.
- 1537. -7- Derechos reservados © 2001 Lillian Bird y José Molinelli La alteración y fragmentación de hábitats - Como vimos anteriormente, cada especie requiere un área territorial que provea los alimentos suficientes para garantizar la subsistencia del grupo. Al fragmentar un hábitat por la construcción de carreteras, urbanizaciones, centros comerciales y otros, se reduce el área necesaria para sostener al grupo de individuos de una especie dada. Esto ocasiona una merma en el número de individuos de dicha especie y la eliminación de la diversidad genética presente en dichos individuos. La contaminación del agua, el suelo y el aire - La contaminación de cuerpos de agua reduce la concentración de oxígeno disuelto presente en los mismos y los hace menos viables para sostener una mayor diversidad de vida. Puede hacerla también no apta para consumo por parte de las especies que de ella dependen, limitando así la disponibilidad de este recurso esencial. La contaminación del suelo afecta su capacidad para sostener la vida y limita la diversidad de plantas y de microorganismos que puedan desarrollarse y subsistir en el mismo. Esto, a su vez, afecta a las especies de animales que se alimentan de estas especies de plantas y microorganismos. La contaminación del aire, por su parte, afecta tanto la calidad del agua como la del suelo, ya que los contaminantes presentes en el aire son arrastrados por la lluvia hacia la superficie del suelo y los cuerpos de agua, afectando su calidad. La introducción de especies exóticas - La introducción de especies nuevas causa un desbalance en el equilibrio del hábitat. La nueva especie puede competir por alimentos y por territorio con las especies nativas, causando que se exceda la capacidad de acarreo del hábitat y que se pierda parte o la totalidad de la población adaptada a él. Las especies exóticas pueden también destruir o alimentarse de las crías de alguna de las especies ya presentes, afectando significativamente las posibilidades de supervivencia de estas especies.
- 1538. -8- Derechos reservados © 2001 Lillian Bird y José Molinelli La domesticación de especies de animales y plantas - El proceso de domesticación de especies de animales y plantas comenzó hace decenas de miles de años en la región de Etiopía en Africa, cuando los seres humanos comenzaron a cultivar plantas y criar animales para su subsistencia. La selección de algunas especies sobre otras, y la selección de aquellos individuos de cada especie que fueran más resistentes a sequías y depredadores, o más mansos, hizo que se redujera tanto el número de especies como la diversidad genética de las mismas. Las especies descartadas en aquella época bien podrían haber tenido la configuración genética que se requiere para resistir las enfermedades y condiciones del presente. Este potencial genético, sin embargo, se perdió como resultado de la domesticación. Otro resultado de la domesticación y de la manipulación de especies por el ser humano es el desarrollo de nuevas enfermedades o de variantes de enfermedades existentes. Este es el caso de la enfermedad de las vacas locas que afecta a algunos países de Europa y Sur América, y que se cree que proviene del contenido animal presente en el alimento que se ha venido administrando al ganado para aumentar su contenido protéico. Las consecuencias de la sociedad de consumo - Como consecuencia de la industrialización y de las actividades típicas de la sociedad de consumo, como son el uso del automóvil y la producción de bienes haciendo uso de energía proveniente de combustibles fósiles, los seres humanos hemos aumentado la producción de gases de invernadero. Estos gases (bióxido de carbono, metano y óxido nitroso, entre otros) aumentan la capacidad de la atmósfera para retener calor, y son la causa del calentamiento global. Los cambios climáticos que se anticipan a nivel global como consecuencia del aumento en la emisión de estos gases de invernadero también tendrán un efecto sobre la biodiversidad de vida en el Planeta, ya que se cree que muchas especies de plantas y animales en ecosistemas acuáticos y terrestres no podrán resistir los cambios que se anticipan debido al alza en la temperatura de sus hábitats.
- 1539. -9- Derechos reservados © 2001 Lillian Bird y José Molinelli ¿Qué se puede hacer para evitar la pérdida de biodiversidad? Para preservar la diversidad genética, de especies y de ecosistemas en la Tierra, es necesario que se tomen medidas efectivas para: Reconstruir las ciudades, preservando los campos y áreas verdes, para proteger el hábitat de las especies existentes Controlar la entrada de especies de plantas y animales exóticos Evitar la contaminación de los cuerpos de agua, del suelo y del aire Controlar la sobrepesca y la caza mediante la implantación efectiva de las leyes Preservar la diversidad genética de aquellas plantas y animales que son domesticados por los humanos Limitar el consumerismo y las acciones que producen gases de invernadero
- 1540. 1 LOS VIRUS La palabra virus significa veneno. Antiguamente se utilizaba para designar a todo aquello que producía enfermedad. Actualmente, se utiliza para referirse a estructuras microscópicas que no son retenidas por filtros para bacterias y que son patógenos para todo tipo de seres vivos. La observación de los virus sólo puede hacerse mediante el uso del microscopio electrónico, debido a su pequeño tamaño. Los virus son estructuras acelulares que no son activos fuera de las células. Si se encuentran en el exterior celular reciben el nombre de viriones. En el interior celular son capaces de controlar la maquinaria metabólica, utilizándola para su replicación. Por ello, los virus no se consideran seres vivos I. ESTRUCTURA DE LOS VIRUS Un virus, fuera de una célula, presenta las siguientes partes: ¾ Ácido nucleico enrollado: puede ser ADN o ARN. Cualquiera de estos ácidos puede presentarse en forma monocatenaria o bicatenaria. ¾ Cápsida: cubierta proteica que protege y aísla el ácido nucleico. Recibe también el nombre de cápsula vírica y presenta distintas formas. Esta estructura está formada por una única proteína que se repite. Cada una de estas unidades proteicas se denomina capsómero. ¾ Otras proteínas: Además de los capsómeros (proteínas estructurales) algunos virus puede llevar proteínas enzimáticas como las implicadas en la transcripción de su material genético, y proteínas aglutinantes, que interactúan con los receptores celulares y capacitan al virión para infectar a la célula hospedadora. Algunos virus presentan una envoltura membranosa, (Figura pag. 338) perteneciente a la célula que ha infectado. Dicha capa posee una serie de glucoproteínas integrales de membrana propias del virus. Esta envoltura facilita la infección de otras células de la misma estirpe celular que la célula infectada. A menudo estas Estructura del VIH
- 1541. 2 proteínas presentan nuevas variantes indetectables para el sistema inmunológico del huésped, como las hemaglutininas (Hn) y neuraminidadas (Nn) del virus de la gripe. El ejemplo de la figura muestra la estructura del virus del SIDA. II. CLASIFICACIÓN DE LOS VIRUS Los virus se pueden clasificar, atendiendo a distintos criterios: A. Atendiendo al tipo de ácido nucleico: ¾ Tipo I: ADN bicatenario, es decir, de dos hebras de ADN. (Adenovirus, Herpesvirus, bacteriófagos T4 y λ. ¾ Tipo II: ADN monocatenario, es decir, de una hebra de ADN. Muchos bacteriófagos presentan este tipo de material genético. ¾ Tipo III: ARN binatenario. Se transcribe de ARN a ARN mensajero. Ejemplo Reovirus ¾ Tipo IV: ARN monocatenario (+). No es necesaria su transcripción. Se lee directamente como ARN mensajero. Ejemplo: Poliovirus. ¾ Tipo V: ARN monocatenario (-). Se transcribe a ARN mensajero. Ejemplo: Rhabdovirus, Influenzavirus (gripe etc.) ¾ Tipo VI: ARN monocatenario (+). El ARN es transcrito a ADN utilizando una enzima llamada transcriptasa inversa. Posteriormente, el ADN sintetizado es transcrito a ARN. Se denominan retrovirus. Ejemplo VIH. B. Atendiendo a la forma de la cápsida del virus: (Figura pag: 331) ¾ Virus helicoidales: cápsidas alargadas, donde los capsómeros se disponen de forma helicoidal en torno al ácido nucleico. Estos virus infectan células vegetales. ¾ Virus (poliédricos) icosaédricos: cápsidas redondeadas con capsómeros triangulares. Estos virus infectan células animales. ¾ Virus mixtos, o complejos: cápsidas con una zona icosaédrica, seguida de vaina contráctil helicoidal que acaba en una base hexagonal, de la que emergen cortas espinas de anclaje. C. Atendiendo a la célula que infectan: ¾ Virus vegetales: atacan células vegetales. Cápsidas de forma helicoidal. ¾ Virus animales: atacan células animales. Cápsidas de forma icosaédrica. ¾ Virus bacterianos, bacteriófagos o fagos: atacan bacterias. Cápsidas de forma mixta. D. Atendiendo a la envoltura lipídica: ¾ Virus desnudos: sin envoltura ¾ Virus con envoltura: La mayoría de los virus animales poseen una doble capa lipídica recubriendo a la cápsida. Ejemplos característicos son el VIH y El virus de la gripe.
- 1542. 3 III. CICLOS DE INFECCIÓN DE VIRUS Los viriones o partículas víricas (virus en fase extracelular) no realizan ninguna actividad fisiológica, por lo que no requieren sintetizar proteínas ni utilizan energía; son estructuras inertes. Así, el ácido nucleico viral se replica a expensas de la maquinaria y la energía de la célula infectada. Existen dos sistemas de replicación de virus, el ciclo lítico y el ciclo lisogénico. La explicación de estos ciclos viene referida a la que se da en virus bacteriófagos como el fago λ cuyo genoma es una molécula de ADN de cadena doble. A. Ciclo lítico Se denomina así porque la célula infectada muere por rotura al liberarse las nuevas copias virales. Consta de las siguientes fases: 1. Fase de adsorción o fijación: El virus se une a la célula hospedadora de forma estable. La unión es específica ya que el virus reconoce complejos moleculares de tipo proteico, lipoproteico o glucoproteico, presentes en las membranas celulares. 2. Fase de penetración o inyección: el ácido nucleico viral entra en la célula mediante una perforación que el virus realiza en la pared bacteriana. 3. Fase de eclipse: en esta fase no se observan copias del virus en la célula, pero se está produciendo la síntesis de ARN, necesario para generar las copias de proteínas de la cápsida. También se produce la continua formación de ácidos nucleicos virales y enzimas destructoras del ADN bacteriano. 4. Fase de ensamblaje: en esta fase se produce la unión de los capsómeros para formar la cápsida y el empaquetamiento del ácido nucleico viral dentro de ella. 5. Fase de lisis o ruptura: conlleva la muerte celular. Los viriones salen de la célula, mediante la rotura enzimática de la pared bacteriana. Estos nuevos virus se encuentran en situación de infectar una nueva célula. Este ciclo se da también en virus animales con envoltura. En este caso las glucoproteínas víricas de la envoltura son sintetizadas en los ribosomas del RER y se integran en la membrana plasmática celular. Quedarán incorporadas a la envuelta lipídica cuando se produce la exocitosis de los nuevos virus. (Figura pag. 334) B. Ciclo lisogénico Las dos primeras fases de este ciclo son iguales a las descritas en el ciclo anterior. En la fase de eclipse el ácido nucleico viral en forma de ADN bicatenario recombina con el ADN bacteriano, introduciéndose en éste como un gen más. Esta forma viral se denomina profago, o virus atenuado, mientras que la célula infectada se denomina célula lisogénica. En este estado el profago puede mantenerse durante un tiempo indeterminado, pudiendo incluso, reproducirse la célula, generando nuevas células hijas lisogénicas. El profago se mantendrá latente hasta producirse un cambio en el medio ambiente celular que provoque un cambio celular, por ejemplo, por variaciones bruscas de temperatura, o desecación, o disminución en la concentración de oxígeno. Este cambio induce a la liberación del profago,
- 1543. 4 transformándose en un virus activo que continúa el ciclo de infección hasta producir la muerte celular y la liberación de nuevos virus. Cromosoma hospedador Célula bacteriana Ciclo lisogénico Unión a la célula hospedadora e inyección del ADN El ADN de Lambda se circulariza Síntesis de las proteínas víricas necesaria para la fabricación de nuevos viriones Replicación del ADN de Lambda ensamblaje de las proteínas víricas empaquetamiento para formar de nuevos viriones La lisis celular libera un gran número De virus El profago integrado se replica junto con el cromosoma del hospedador Integración de Lambda en el cromosoma hospedador Profago División celular con replicación del cromosoma Inducción del ciclo lítico Virus Lamba Ciclo lítico Ciclo de replicación del VIH
- 1544. 5 IV. Virus y cancer Algunos virus tienen la capacidad de producir transformaciones tumorales (benignas o malignas) en las células: son los virus oncogénicos. Varias familias de virus ADN son cancerígenos, pero entre los virus ARN solo los retrovirus presentan esta capacidad. Existen dos mecanismos: -Inserción del ADN del virus en el genoma de la célula huésped si se inactiva un gen represor tumoral. En otras ocasiones se ve involucrado un gen regulador del ciclo celular. - La transformación oncogénica puede deberse también a una proteína codificada por un gen propio del virus (oncogen).
- 1545. TEMA 8 : CLASIFICACIÓN 7.1. Reino Monera. Reino protista. Reino Hongos. Reino Plantas. Reino Animales. El término TAXONOMÍA deriva del griego, taxis: significa orden y nomos: ley u norma. Es la parte de la ciencia que se ocupa de la ordenación y clasificación, como así también de las bases, principios y leyes que regulan dicha clasificación. Categorías taxonómicas: son los distintos niveles de jerarquías en un sistema de clasificación. La especie es considerada por el Código Internacional de Nomenclatura como la categoría taxonómica básica Concepto de especie biológica Conjunto de poblaciones formadas por individuos que tienen el potencial para cruzarse entre ellos y producir descendencia fértil, y que se encuentran aislados de otros grupos próximos; Esta definición también es conocida como especie sexual. El problema aparece cuando se consideran organismos que dependen casi exclusivamente de la reproducción asexual, como los procariotas y protistas, o cuando existen poblaciones que se solapan entre si y presentan cierto grado de reproducción entre ellas. Para esto se desarrolló el concepto evolutivo de especie, que incluye, además de las actuales, a todas las poblaciones anteriores que sucesivamente dieron origen a una especie determinada actual. El botánico sueco Linneus intentó clasificar todas las especies conocidas en su tiempo (1753) en categorías inmutables. Muchas de esas categorías todavía se usan en biología actual. La clasificación jerárquica Linneana se basaba en la premisa que las especies eran la menor unidad, y que cada especie (o taxón) estaba comprendida dentro de una categoría superior o género. Los nombres científicos de plantas y animales se escriben con estas dos palabras: género y especie, Linneus también denominó a este concepto nomenclatura binomial, y eligió el latín, en ese entonces el lenguaje de los hombres cultos en todo el mundo, para escribirla, con el objeto de asegurar que todos los científicos entendieran la nomenclatura. Actualmente se sigue utilizando el latín por ser una lengua muerta. Ejemplo de la clasificación taxonómica del ser humano:
- 1546. Reino Animal | Phylum Cordados | Clase Mamíferos | Orden Primates Familia Hominidae Genero Homo especie sapiens Reinos y Dominios Desde la época de Aristóteles los organismos vivos se reunían en solo dos reinos: Animal y Plantas. Dada la ambigüedad de algunos organismos unicelulares, Ernst Haeckel (S. XIX) creó el tercer reino Protista, para incluir aquellos organismos unicelulares con aspectos intermedios entre plantas y animales. El cuarto reino establecido es Monera, que abarca bacterias y algas verde-azuladas, la característica principal de este reino es la presencia de células procariotas: sin núcleo celular definido ni orgánulos. Los organismos de los reinos Animal, Planta y Protistas están formados por células eucariotas, es decir con núcleo rodeado por membranas y orgánulos celulares. R. H. Whittaker en 1969 separó a todos los hongos de las plantas en el quinto reino: Fungi, poseen células eucarióticas, tienen núcleos y paredes celulares pero carecen de pigmentos fotosintéticos. La mayoría de los biólogos actuales reconocen estos cinco reinos: Moneras, Protistas, Hongos, Plantas y Animales, que se basan en la organización celular, complejidad estructural y modo de nutrición.
- 1547. Reino Monera En este reino se incluyen organismos muy pequeños, que sólo pueden ser observados con microscopios muy potentes. Todos los individuos de este Reino se caracterizan por ser: x Procariotas: en el interior de la célula no existen compartimentos y no se aprecia núcleo. x Unicelulares: son individuos compuestos de una sola célula. x Pueden vivir solos o asociarse unos individuos con otros, formando colonias. x Ocupan todos los ecosistemas de La Tierra, desde los hielos polares hasta el interior de los pulmones de un rinoceronte. Estructura de las células procariotas Las células procariotas tienen una estructura muy sencilla. Desde el exterior hacia el interior encontramos: x Una pared celular rígida y dura. Su función es proteger a la célula. Sobre esta pared actúan los antibióticos que son medicamentos que destruyen a las bacterias. x Una membrana plasmática, que actúa como paso fronterizo entre el exterior y el interior celular. x El citoplasma, que se encuentra en el interior y es donde se realizan todas las funciones celulares. x El ADN, que contiene la información genética de la bacteria y que se encuentra libre por el citoplasma. x Los ribosomas, que son pequeñas fábricas de proteínas. Están representados a través de las bacterias y de las algas verdes azuladas o cianoficeas. BACTERIAS Todas las bacterias pertenecen a este reino. Son organismos microscópicos formados por una sola célula que no tiene núcleo ni organelos delimitados por membranas. Fueron, probablemente, los únicos habitantes de la Tierra durante cerca de 3000 millones de años. Las bacterias son el grupo más abundante de organismos dentro del Reino Moneras. Las bacterias presentan distintos tipos de formas: x Cocos: bacterias esféricas x Bacilos: bacterias alargadas x Vibriones: bacterias con forma de coma ortográfica x Espirilos: bacterias en forma de muelle, o helicoidales. Con relación a la nutrición que presentan, las bacterias pueden ser:
- 1548. x Autótrofas: crean la materia orgánica que necesitan para vivir, a partir de la materia inorgánica. x Heterótrofas: crean la materia orgánica que necesitan a partir de materia orgánica que captan del medio donde viven. Con relación al tipo de ambiente donde viven, las bacterias pueden ser: x Aerobias: necesitan vivir en ambientes con oxígeno. x Anaerobias: necesitan vivir en ambientes con CO2. Hay un grupo de bacterias que sólo pueden desarrollarse en ambientes sin nada de oxígeno. A este tipo de bacterias se las conoce como anaerobias estrictas. Las bacterias perjudiciales producen enfermedades, ya que muchas de ellas son parásitas. Otras bacterias son beneficiosas. Las utilizamos para la producción de alimentos, tales como el yogur o el vino. Otro grupo, llamado descomponedoras, actúan sobre la materia orgánica, transformándola en materia inorgánica. Este tipo de bacterias son saprófitas. También hay bacterias que viven en simbiosis con nosotros. Viven en nuestro intestino y forman la flora intestinal. Algunas se encargan de producir vitaminas para nosotros. Otras evitan que tengamos infecciones intestinales. Son indispensables para nuestra supervivencia. CIANOFICEAS En este grupo se ubica a las algas verde azules, las cuales carecen de núcleos definidos, de cloroplastos u otras estructuras celulares especializadas. Son capaces de producir la misma clase de clorofila que poseen las plantas superiores. Las Cianofíceas, cumplen una función de vital importancia para todos los ecosistemas de La Tierra. Producen grandes cantidades de oxígeno, más que todos los árboles de la Selva Amazónica. La cantidad de oxígeno en la atmósfera es regulada por este tipo de seres. Además, son fuente de alimento de gran cantidad de microorganismos que se alimentan de ellas. Las algas verde azuladas pueden ser encontradas en los hábitats más diversos de todo el mundo.
- 1549. Reino Protista Los individuos del reino de los protistas son los que presentan las estructuras biológicas más sencillas entre los eucariotas (ya que su ADN está incluido en el núcleo de la célula), y pueden presentar una estructura unicelular (siendo esta la más común), multicelular o colonial (pero sin llegar a formar tejidos). Los protistas son autótrofos (en su mayoría) y producen un alto porcentaje del oxígeno de la tierra. Sin embargo, es complicado establecer un cuadro de características generales para los organismos del reino protista. Con todo, procuraremos presentar las características más comunes en la mayoría (no están presentes en todos los protistas) de estos organismos a continuación: 1. Son Eucariotas 2. No forman tejidos 3. Son autótrofos (por fotosíntesis), heterótrofos (por absorción) o una combinación de ambos. 4. Generalmente son aerobios pero existen algunas excepciones. 5. Se reproducen sexual (meiosis) o asexualmente (mitosis). 6. Son acuáticos o se desarrollan en ambientes terrestres húmedos. Se agrupan aquí individuos muy heterogéneos, por lo que se les divide en : x Protozoos: son seres unicelulares, generalmente móviles y heterótrofos. x Algas: son seres unicelulares o pluricelulares, a veces móviles, y autótrofos. PROTOZOOS Los protozoos son seres eucariotas (con núcleo celular definido), unicelulares y heterótrofos (se alimentan de materia orgánica). Suelen ser de vida libre, aunque existen grupos que son parásitos. Podemos distinguir distintos tipos de protozoos si observamos su estructura. Estos grupos son: Flagelados Son protozoos que para moverse utilizan flagelos. Son los protozoos más primitivos. La mayoría de los flagelados tienen vida libre, pero hay algunos que son parásitos. Uno famoso es el Tripanosoma gambiense. Probablemente el nombre no te suena de nada, pero seguro que has oído hablar de la enfermedad del sueño. La transmite la mosca tse- tse, ya que el Trypanosoma vive en su boca. Ciliados Son protozoos que utilizan cilios para moverse. Los cilios son pequeñas estructuras que la célula mueve a modo de remos. Son seres que viven libres en el agua dulce. Rizópodos Son protozoos que se mueven emitiendo prolongaciones de su cuerpo y deslizándose sobre la superficie sobre la que viven. Estas prolongaciones se llaman pseudópodos, y funcionan como falsos pies. Pueden vivir en aguas dulces o ser parásitos.
- 1550. Esporozoos Son protozoos inmóviles. Todos los individuos de este grupo son parásitos. Uno famoso es el Plasmodium falciparum. Produce la enfermedad llamada malaria, o paludismo. Esta enfermedad es la principal causa de muerte en algunos países africanos, del Sudeste asiático y Sudamérica. LAS ALGAS Están formadas por células eucariotas y podemos encontrar individuos unicelulares o pluricelulares. Todas son autótrofas, esto es, forman materia orgánica a partir de materia inorgánica, utilizando la luz como fuente de energía. Este proceso se llama fotosíntesis. Las algas se utilizan en la industria alimentaria como espesantes de mermeladas y salsas. En medicina se utilizan para hacer los medios de cultivo de las bacterias. También se extraen de ellas sustancias para producir medicamentos. El grupo de las algas lo vamos a dividir en subgrupos: Algas unicelulares . Son seres formados por una sola célula. Son individuos que pueden vivir libres, como es el caso de la Euglena. También pueden asociarse y formar colonias, como es el caso de Volvox Algas Pluricelulares. Son seres formados por muchas células, que no se agrupan formando tejidos, como en seres vivos más complejos., por lo que las células no se reparten el trabajo, sino que todas deben realizar todas las funciones. Si observamos su color, podemos clasificarlas en tres tipos: x Algas verdes: su color es debido a que tienen clorofila, que es una molécula que sirve para realizar la fotosíntesis. La clorofila es de color verde. Viven en aguas dulces y saladas a poca profundidad. x Algas pardas: el pigmento que utilizan para realizar la fotosíntesis es de color marrón amarillento. Esta molécula es más sensible a la luz que la clorofila. Por eso, las algas pardas pueden vivir a mayor profundidad. x Algas rojas: El pigmento que utilizan para hacer la fotosíntesis es de color rojo. Es el pigmento más sensible a la luz, por lo que estas algas pueden vivir a profundidades donde la luz que llega es muy tenue.
- 1551. Reino Plantas El Reino Plantas viene a representar el más importante eslabón dentro de toda cadena alimenticia, la mayor parte de ellos tienen clorofila y pueden almacenar la energía que proviene del sol y sintetizar sustancias alimenticias. El reino Plantae incluye los musgos, helechos, coníferas y plantas con flores, en una variedad que supera las 250.000 especies. La principal característica del reino es la presencia de clorofila, por esta característica son autótrofos. Otras características de este reino: - Todos son eucariotas multicelulares - Poseen paredes celulares constituidas principalmente por celulosa. - Nutrición: mediante la fotosíntesis que se realiza por medio de la clorofila de los cloroplastos, existen algunos ejemplos de plantas parcial o totalmente heterótrofas. - Reproducción sexual con alternancia de generaciones: esporofito diploide y gametofito haploide. Este reino está formado por cuatro grupos principales: Briófitos, Pteridofitas (helechos), Gimnospermas y Angiospermas. PLANTAS NO VASCULARES Plantas sin tejidos vasculares. Con una generación gametofítica dominante División BRIÓFITAS: BRIOFITAS Son plantas relativamente pequeñas, en general no superan los 20 cm de altura. Son abundantes en lugares húmedos donde se encuentran gran variedad de especies. Son vegetales autótrofos, con clorofila a, b y carotenoides, paredes celulares de celulosa, carecen de lignina. Dos características los diferencian de las restantes plantas: Carecen de tejidos vasculares especializados: xilema y floema. Por lo tanto, estrictamente hablando, carecen de hojas, tallo y raíces (términos que se definen, en parte, por la presencia de tejidos vasculares). Esta característica es lo que limita la altura de la planta. Presentan clara alternancia de generaciones: el gametofito haploide es la generación dominante mientras que el esporofito está reducido y es dependiente (desde el punto de vista nutricional) del gametofito, al revés de lo que sucede en las restantes grupos de plantas, donde el esporofito es la planta verde y dominante.
- 1552. Distribución y modo de vida A excepción del mar y los desiertos extremos, el resto de la tierra está colonizada por Briófitos. Son los únicos habitantes vegetales de regiones boreales y australes, pueden vivir en lugares de temperaturas muy extremas como rocas expuestas al sol o en lugares muy secos durante años, siendo capaces de recuperarse rápidamente al ser mojados. Su mayor desarrollo se da en lugares húmedos, la absorción y pérdida de agua se produce por TODA la planta, y son capaces de retener grandes cantidades de agua. Los briófitos de ambientes xerofíticos (secos) poseen gran resistencia a la desecación. En Turtula muralis se comprobó que mantiene la capacidad de revivir luego de 14 años sin agua. También son capaces de resistir temperaturas extremas: crecen tanto sobre rocas del nivel de nieve permanente del Ártico y Antártida, como en lugares donde la roca alcanza 70º al sol. Requieren menor intensidad lumínica que las restantes plantas, por lo que son los habitantes del interior de las cuevas, viviendo con solo 0,1 % de intensidad lumínica. Toleran un amplio rango de pH: los Sphagnum de las turberas viven a pH 3 - 4, los musgos de la toba caliza están a pH 7- 8,5. PLANTAS VASCULARES Plantas con tejidos vasculares diferenciados en xilema y floema, con una generación esporofítica dominante. Dentro podemos distinguir: A- Plantas sin semillas: plantas con tejidos vasculares, pero sin semillas PTERIDOPHYTAS. Helechos y afines. B- Plantas con semillas: SPERMATOPHYTA 1. Gimnospermas. Plantas con óvulos desnudos, tanto los óvulos como las semillas están desprotegidos. Las gimnospermas no tienen frutos para proteger la semilla. Sus flores son muy simples y suelen pasar inadvertidas a nuestra vista. Son gimnospermas, por ejemplo, los pinos, los abetos y los cipreses. Son las plantas con semillas más antiguas. 2. Angiospermas. Son las plantas más recientes y más evolucionadas. Tienen flores complejas que suelen ser llamativas a nuestra vista. Las semillas están recubiertas por un fruto que las protege. Son la fuente de alimentación del ser humano y de muchos mamíferos. De ellas también se obtiene gran número de materias primas y productos naturales. Los jazmines, los rosales, el trigo y la encina son angiospermas. Se diferencian dos clases: 2. a- Monocotiledóneas: embrión con un un solo cotiledón, hojas de nerviación paralela, piezas florales en múltiplo de 3, haces vasculares dispersos en el tallo, sin crecimiento secundario típico. Algunos ejemplos son el arroz, la cebada, el trigo, el maiz, el tulipán…
- 1553. Los cotiledones son las hojas primordiales constitutivas de la semilla y se encuentran en el germen o embrión. 2.b- Dicotiledóneas: embrión con dos cotiledones, hojas de nerviación reticulada, piezas florales en múltiplo de 4 o 5, haces vasculares se disponen en el tallo en forma de anillo, muchas especies presentan cambiun vascular y crecimiento secundario. Algunos ejemplos son: el nogal, los claveles, el tomate
- 1554. Reino Hongos En este Reino se incluyen individuos como son las levaduras, los mohos y las setas. Todos los individuos de este grupo se caracterizan por estar formados por células eucariotas, que son aquellas que tienen el núcleo diferenciado. Todos estos seres tienen nutrición heterótrofa, es decir que forman materia orgánica a partir de otra materia orgánica. No pueden realizar la fotosíntesis. Dependiendo de dónde cojan la materia orgánica, se habla de hongos parásitos, si el alimento lo extraen de un ser vivo al que causan un perjuicio, o saprófitos, si es materia orgánica que no pertenece a un ser vivo. Los individuos de este reino pueden ser: Unicelulares, como en el caso de las levaduras. Se utilizan en industria para producir bebidas alcohólicas, pan, bizcochos... Pluricelulares, formados por células asociadas que no organizan tejidos. Esta asociación celular se llama hifa. Las hifas se ramifican formando una red llamada micelio. El micelio se encuentra generalmente en el suelo y si no se arranca, se mantiene de una temporada a la siguiente Mucha gente tiende a confundir hongo y seta, no obstante, desde el punto de vista científico las diferencias son claras: los hongos son unos organismos peculiares, fascinantes y muy diversos; las setas son las fructificaciones o cuerpos fructíferos de ciertos hongos. Los hongos pueden vivir en cualquier medio donde exista sustancias orgánicas, agua, aire y una adecuada temperatura. También pueden vivir como parásitos facultativos; es decir que el micelio destruye las células de las que se alimentarán más tarde. De forma parecida, pueden vivir como parásitos obligatorios cuando se alimentan de la materia viva o muerta del hospedador, viviendo en la superficie (extoparásito) o muy profundamente (endoparásitos). Por último, se les encuentra viviendo en simbiosis formando líquenes. Los hongos son de gran utilidad en la naturaleza, debido a que desintegran las sustancias orgánicas y de modo este modo preparan el medio para otros organismos como lo son las plantas autótrofas. Existen hongos perjudiciales, ya que atacan los alimentos, por otro lado también hay hongos de gran utilidad como lo son las levaduras, las cuales son usadas en la fabricación del pan, del vino y de la cerveza entre otros licores. También hay hongos comestibles (champignon). Igualmente, hay hongos utilizados en la medicina como el Penicillium y de otros hongos se extrae la penicilina y otros antibióticos, como también existen hongos que son extremadamente venenosos. Principales características de los hongos: x Son eucariotas. poseen núcleos verdaderos x Normalmente son multinucleados suelen presentar muchos núcleos, aunque también hay especies microscópicas, con un solo núcleo, como las levaduras. x Se reproducen por medio de esporas. En los hongos las esporas son tremendamente variadas, móviles o inmóviles, sexuales o asexuales. Muchos hongos producen sus esporas en estructuras microscópicas, mientras que otros
- 1555. forman cuerpos fructíferos para liberarlas. Las setas son las plataformas lanzadoras de esporas de algunos grupos fúngicos x Son heterótrofos, sin clorofila, y se alimentan por absorción. Los hongos siguen una estrategia alimentaria muy simple: pudren cosas y absorben los productos resultantes de la descomposición. x El talo (soma o cuerpo vegetativo) puede ser unicelular, como en las levaduras o filamentoso, en este último caso recibe el nombre de micelio. El talo está recubierto de una pared de quitina (en los hongos típicos) o de celulosa. En algunos casos, el talo no presenta pared (desnudo). Los hongos se dividen en cuatro grandes clases: Ascomicetos: son de gran utilidad en la industria y la medicina. A los ascomicetos están repartidos por diversos medios: en el agua, en el suelo, en vegetales y animales en descomposición, en sustancias azucaradas, en el que llevan una vida parasitaria causando serias enfermedades a plantas cultivadas. Este tipo de hongos también pueden ser saprofitos, los cuales tienen muchas aplicaciones de gran valor; son utilizados en la fabricación de queso, para ciertas fermentaciones y los del género Penicillium son los utilizados para producir antibióticos. Ficomicetos: Son los hongos llamados moho del pan y de las frutas y en algunos casos es parásito del repollo. Deuteromictos: Son cuando los hongos forman los líquenes, los cuales tienen una gran distribución en la superficie de la tierra, se pueden ver en las selvas, en la corteza de los árboles, en los desiertos y aun sobre las rocas y lugares nevados. Basidiomicetos: Son los populares hongos de sombrerito y oreja de palo (que son los aparecen en los en los trocos de los árboles). Los hongos de sombrerito son de un gran valor económico, ya que son comestibles, pero existen algunas especies que son altamente venenosos. Algunos récords fúngicos curiosos, recogidos aquí y allá en Internet: máxima concentración de esporas (161.037 por m3 ); micelio más extenso (Armillaria, 890 ha en Norteamérica); mayor cuerpo fructífero (Rigidoporus ulmarius, 163 x 140 x 50 cm de alto en febrero de 1995 y sigue creciendo); cuerpo fructífero más pesado (Laetiporus sulphureus, 45,4 kg); mayor hongo comestible (Langermannia gigantea, 2,64 m de circunferencia, 22 kg); más venenoso (Amanita phaloides, 5-7 mg de amanitoxinas son letales); talo más viejo (algunos líquenes en Alaska, más de 3500 años).
- 1556. Reino Animal Se calcula que al Reino Animal pueden pertenecen cerca de un millon de especies. Debido a este enorme número se ha hecho una clasificación muy minuciosa de todos estos especímenes. Se han clasificado en: Esponjas, Celenterados, Cteneforos, Plantelmitos, Nematodos, Rotiferos, Moluscos, Anelidos, Artropodos, Equinodermos y Cordados. Esponjas: Se considera que la evolución de las esponjas ha sido mínima. Por eso se piensa que su apariencia actual bien podría ser la misma que tuvieron hace cientos de miles de años. Estos organismos poseen numerosas cavidades que se comunican a través de redes tubulares que terminan en un gran número de poros. Se han podido contar cerca de 5.000 especies existentes. Uno de los usos que le proporciona el hombre es el de producto de limpieza o artículo de tocador. Celenterados: Esta especie animal presenta organismos con simetría radial. Digieren alimentos gracias a una cavidad que poseen en su interior. Los Celenterados acostumbran asociarse en grandes colonias a las cuales se les denomina corales. A las especies de los celenterados se les ha dividido en tres clases: Hydrozoa, Scyphozoa y Anthozoa. Los Cteneforos: La apariencia externa de los cteneforos es muy parecida a la que presentan las medusas de los celenterados, hoy día sólo existen cerca de 100 especies. Los Platelmitos: La gran mayoría de esta especie son parásitos que habitan ya sea en agua dulce o salada, pero también pueden observarse en tierra húmeda. Una especie de los platelmitos que podemos mencionar son los gusanos planos, también los gusanos parásitos que viven en el hombre y en los animales y las tenias que son parásitos cuyo cuerpo es alargado y con forma de cinta. Los Nematodos: Esta especie presenta cuerpo cilindrico y alargado, y también presentan una cutícula muy resistente que los protege, y además poseen un aparato digestivo que incluye boca y ano. Los Rotiferos: Estos animales son microscópicos y pueden vivir tanto en agua dulce como en agua salada, con mucha frecuencia los encontramos en las aguas estancadas. Los Moluscos: Estos son animales celomados, que presentan un cuerpo blando que aunque tiene cierta simetría bilateral algunas veces presenta una marcada distorsion, generalmente se encuentran protegidos por conchas calcareas en una gran mayoría, pueden vivir en el agua, pero algunas especies son terrestres. Las clases de moluscos que existen son cinco que son: Anphineura, Scaphopoda, Gastropoda, Pelecypoda (calamares, pulpos). Los Anélidos: Estos animales presentan un cuerpo alargado y suelen habitar el agua dulce o habitar en la tierra. Los más populares son: Las sanguijuelas y las lombrices de tierra. La respiración de estos individuos es cutanéa pero en algunos casos también pueden ser bronquial. En lo que se refiere a aparato digestivo es completo. El tamaño puede variar desde un milimetro hasta dos metros.
- 1557. Los Artropodos: Estos animales metazoarios existen en gran cantidad siendo una de sus cracterísticas el presentar patas articuladas. Pueden habitar en la tierra, en el agua salada o en el agua dulce, también pueden vivir como parásitos en el hombre o en los animales. Entre los más conocidos tenemos: Las arañas, ciempiés, milpiés, garrapatas, los cangrejos, las langostas e insectos, zacundos, mariposas, saltamontes, moscas, chipos, cucarachas. Muchos de los artropodos tienen una gran importacia en la economía, otros pueden servir alimento para el hombre y para algunos animales, mientras que otros son perjudiciales, ya que destruyen los sembradios y pueden llegar a transmitir bacterias. Los Equinodermos: Son animales que poseen un endoesqueletos, su piel es se encuentra cubierta con espinas erizadas (Erizos), suelen vivir en el mar por ejemplo: los pepinos de mar, las estrellas de mar, las arañas de mar. Los Cordados: Son animales marinos que viven ya sea en el agua dulce, en el agua salada o en la tierra, su estructura dorsal es flexible, son de sexos separados, en su gran mayoría presentan un organo capaz de bombear la sangre a través de un sistema circulatorio cerrado. Existen aproximadamente por encima de las 45.000 especies distintas. Su división consiste en cuatro subphylum que comprenden a los animales pequeños, y otras siete clases, en donde se encontra la clase Mammalia los cuales son vertebrados ya evolucionados. Este constiye el grupo más util para el hombre ya que existen muchos productos alimenticios que derivan de ellos. Su cuerpo suele estar cubierto de pelos y son mamíferos. Por su parte, los mamiferos pueden ser clasificados en tres subclases y 16 órdenes.
- 1558. Apuntes de Zoología – Ana G. Moreno Platelmintos 1 PLATELMINTOS Triblásticos acelomados con tipo de vida activo y simetría bilateral; inicio de cefalización y de concentración del sistema nervioso (sistema nervioso ortogonal). Grado de organización de órganos y sistemas. Aplanamiento dorsoventral. Tubo digestivo con una abertura única situada en el plano sagital o, por adaptación al parasitismo, sin tubo digestivo. Con aparato excretor protonefridial. Hermafroditas con sistemas reproductores complejos. Prostóstomos. Sistema nervioso ortogonal: Consiste en un par de ganglios situados en la parte anterior del animal que se continúan en unos cordones nerviosos longitudinales conectados entre sí mediante conectivos transversales. Se localiza en el mesénquima. Sistema excretor protonefridial: Consiste en un par de conductos longitudinales ramificados (canales laterales); este sistema de canales está provisto de un tipo especial de células (flamígeras). La gónada femenina está diferenciada en dos estructuras: ovarios propiamente dichos (que producen los óvulos) y las glándulas vitelógenas o vitelarios (que producen las células vitelógenas cargadas de vitelo). CLASIFICACIÓN: TURBELARIOS TREMATODOS MONOGENEA CESTODOS Vida libre Marinas Dulceacuícolas Terrestres Algunos parásitos Parásitos Endoparásitos Parásitos Ectoparásitos Parásitos Endoparásitos Epidermis celular o sincitial Epidermis sincitial Epidermis sincitial Epidermis sincitial Epidermis ciliada Sin cilios externos Sin cilios externos Sin cilios externos Sin cutícula Con cutícula Con cutícula Con cutícula Cuerpo sin dividir Cuerpo sin dividir Cuerpo sin dividir Cuerpo dividido Sin ventosas Con dos ventosas: Oral y ventral Órgano posterior de fijación: ventosas y ganchos Con escólex: ventosas y garfios Con tubo digestivo Con tubo digestivo Con tubo digestivo Sin tubo digestivo Ciclos vitales simples Ciclos vitales simples o complejos Ciclos vitales simples o complejos Ciclos vitales simples o complejos Desarrollo directo Desarrollo indirecto Desarrollo directo Desarrollo indirecto
- 1559. Apuntes de Zoología – Ana G. Moreno Nematodos 1 NEMATODOS Unas 20.000 especies descritas (aunque se supone que existen muchas más), dioicas; marinas, dulceacuícolas y terrestres. Hay formas parásitas. La alimentación es muy variable. 0,5 mm – 1 m de longitud. Carecen de coloración. Con eutelia. No presentan cilios ni flagelos. PARED DEL CUERPO: Cutícula: Es muy compleja, con tres capas: cortical, mediana y basal. Está formada por fibras de colágeno entrecruzadas. Es flexible y funciona como antagónica de la musculatura longitudinal. Epidermis: sincitial; presenta cuatro invaginaciones longitudinales (campos o cordones hipodérmicos): dorsal, ventral y dos laterales en los que se localizan los núcleos del sincitio y los cordones nerviosos longitudinales. Los cordones laterales portan los conductos excretores Musculatura: Presentan cuatro cordones longitudinales. No presentan musculatura circular. Las células musculares emiten prolongaciones hacia los cordones nerviosos ventral y dorsal. Pseudocele: Está relleno de líquido sometido a una alta presión hidrostática; funciona como un órgano hidrostático.
- 1560. Apuntes de Zoología – Ana G. Moreno Nematodos 2 TUBO DIGESTIVO: Estomodeo anterior (revestido de cutícula): Boca (rodeada de labios, dentículos, placas, etc) y faringe muscular con una luz trirradiada. Intestino. Proctodeo (revestido de cutícula): recto y ano (en hembras) y recto y cloaca (en machos). APARATO EXCRETOR: Carecen de protonefridios debido a la ausencia de cilios. Glandular: Con una o dos células glandulares grandes (renetas). Tubular: Con dos túbulos situados en los campos hipodérmicos laterales que se conectan entre sí en la parte anterior del cuerpo mediante una comisura. SISTEMA NERVIOSO: Presentan un anillo nervioso alrededor de la faringe del que parten cordones nerviosos longitudinales. ÓRGANOS SENSORIALES: Papilas sensoriales (mecanorreceptores). Ocelos (fotorreceptores): En especies acuáticas, hay un par a los lados de la faringe. Tienen una lente cuticular y una copa pigmentada. Anfidios: Se presentan en la porción anterior de especies de vida libre. Son excavaciones de la cutícula (presumiblemente quimiorreceptores) provistas de una glándula y de terminaciones nerviosas. Fasmidios: Suelen presentarse en especies parásitas, en su porción posterior. Parecen ser la salida de glándulas subcaudales. Son órganos glandulares sensoriales. REPRODUCCIÓN: Aparato genital tubular. Espermatozoides sin flagelo. Fecundación interna. Desarrollo estrictamente determinado y directo. Presentan cuatro estados juveniles separados por mudas.
- 1561. Apuntes de Zoología – Ana G. Moreno Artrópodos 1 1 ARTRÓPODOS Son más de 1.000.000 de especies dioicas (como excepción hermafroditas) que viven en todos los tipos de hábitats posibles. Longitud entre 0,1 mm y 60 cm; coloración muy variable. Con metamerización y tagmatización: los segmentos se agrupan en unidades funcionales que son los tagmas. Con un par de apéndices articulados en cada segmento en los que existe musculatura extrínseca e intrínseca. Exoesqueleto cuticular con quitina. Cefalización muy marcada. Celoma reducido en el adulto; hemocele: senos o espacios entre los tejidos rellenos de sangre. Sistema circulatorio abierto. CLASIFICACIÓN: Trilobites (†) Quelicerados: Merostomados, Picnogónidos y Arácnidos Mandibulados: Crustáceos Miriápodos: Quilópodos, Diplópodos, Sínfilos y Paurópodos Insectos ORGANIZACIÓN DEL CUERPO: El cuerpo está compuesto por tres partes: Acron: Sin ganglios nerviosos, sacos celómicos, apéndices ni mesodermo. Equivalente al prostomio de los anélidos. Soma: Conjunto de todos los segmentos. Equivalente al metastomio de los anélidos. Telson: Sin ganglios nerviosos, sacos celómicos, apéndices ni mesodermo. Equivalente al pigidio de los anélidos.
- 1562. Apuntes de Zoología – Ana G. Moreno Artrópodos 1 2 Tagma: Unidad funcional a base de unidades segmentarias. Nomeristicos: No varía el número de segmentos ni a lo largo del tiempo ni del grupo. Anomerísticos: Varía el número de segmentos a lo largo del tiempo y del grupo. Existen tres zonas de tagmatización: x Cefálica: Sensorial. Captura e ingestión del alimento. Es la más tagmatizada, se eliminan los límites segmentarios y aumenta la esclerotización para protección del cerebro y para la sujeción de la muscultura. x Torácica: Locomotora; tiende a tener pocos segmentos. x Abdominal: Con las vísceras; genital. Sensorial Alimentación Locomoción Visceral Genital TRILOBITES Cefalón Tronco Pigidio QUELICERADOS Prosoma Opistosoma CRUSTÁCEOS Cefalón Pereión Pleón MIRIÁPODOS Cabeza Tronco HEXÁPODOS Cabeza Tórax Abdomen REGIÓN CEFÁLICA: acron 1o preantenal prosocefalón PROTOCEFALÓN 2o antenal deutocefalón 3o tritocefalón PROCEFALÓN 4o mandibular 5o maxilar 6o labial GNATOCEFALÓN acron arquicerebro 1o preantenal prosocerebro PROTOCEREBRO 2o antenal deutocerebro SINCEREBRO PRIMARIO 3o tritocerebro SINCEREBRO SECUNDARIO 4o mandibular ganglio mandibular 5o maxilar ganglio maxilar 6o labial ganglio labial MASA SUBESOFÁGICA TRILOBITES Acron 4 ó 5 metámeros QUELICERADOS Acron 4 metámeros CRUSTÁCEOS Acron 6 metámeros MIRIÁPODOS Acron 5 metámeros diplópodos, paurópodos 6 metámeros quilópodos, sínfilos HEXÁPODOS Acron 6 metámeros
- 1563. Apuntes de Zoología – Ana G. Moreno Artrópodos 1 3 APÉNDICES CEFÁLICOS Acron 1º 2º 3º 4º 5º 6º TRILOBITES Antenas 1 Apéndices 1 Apéndices 2 Apéndices 3 Apéndices 4 QUELICERADOS Quelíceros Pedipalpos Patas 1 Patas 2 CRUSTÁCEOS Antenas 1 Antenas 2 Mandíbulas Maxílas 1 Maxilas 2 MIRIÁPODOS Antenas Mandíbulas Maxílas 1 Maxílas 2 HEXÁPODOS Antenas Mandíbulas Maxílas 1 Maxílas 2 Labio APÉNDICES: Son salientes del cuerpo, metaméricos, de la zona pleural; un par por segmento. Para conseiderarlos como tal tienen que poseer musculatura extrínseca e intrínseca. Presentan membranas articulares que los dividen en artejos y en podómeros; los podómeros (segmento apendicular) con inserciones musculares y los artejos no presentan inserciones musculares. Funciones de los apéndices: locomotores (marchadores o nadadores), raptores o prensiles, sensorial, para la preparación del alimento y con funciones reproductoras. PARED DEL CUERPO: CUTÍCULA: Es muy compleja; constituye un esqueleto externo. x Epicutícula (externa) o Capa de cemento: Barniz protector; proteínas y lípidos. Falta en las traqueas finas y en los sensilios. o Capa de ceras: Ligada a la vida terrestre; es un aislante hídrico; ceras, ácidos grasos y ésteres. Falta en las tráqueas finas y en los quimiorreceptores. o Capa de cuticulina: Polifenoles y cuticulina (epicuticulina). x Procutícula (interna). Posee quitina (polisacárido: N-acetil-glucosamina) englobado en fibras de esclerotina (proteína esquelética). o Exocutícula: Esclerotizada. Se vierten fenoles que tanifican la esclerotina estableciéndose puentes fenólicos. La quitina queda embebida en empalizadas de proteína. La parte esclerotizada se denomina esclerito y la no esclerotizada, membrana. o Endocutícula: No está esclerotizada. Formada por capas de fibras que se orientan formando ángulos con las adyacentes.
- 1564. Apuntes de Zoología – Ana G. Moreno Artrópodos 1 4 La procutícula puede estar calcificada en lugar de esclerotizada. En este casa se distinguen tres capas: Pigmentaria, calcificada y no calcificada. EPIDERMIS: Monoestratificada; es un sincitio funcional debido a los numerosos micropilos que presentan las membranas celulares. MEMBRANA BASAL. MUSCULATURA: Carecen de capas de musculatura; toda ella es fascicular. MUDA o ECDISIS: 1. Se separa la cutícula vieja de la epidermis (apolisis). 2. Se forma la capa epicuticular de la nueva cutícula. 3. En el espacio apolítico se vierten enzimas proteolíticos que digieren la endocutícula. 4. Se forma una nueva procutícula. Se rasga la muda por las líneas ecdisiales y comienza la salida de la muda (exuvia). Se vierten las capas externas de la epicutícula y se esclerotiza la cutícula nueva. El despliegue total se realiza mediante la ingestión de agua que pasa al sistema circulatorio o de aire. FORMACIONES TEGUMENTARIAS:
- 1584. SENDERO DEL GARABATO INTERACCIONES INTERESPECIFICAS Los individuos de la misma especie, no viven separados de individuos de otras especies. Viven estrechamente relacionados, es decir interaccionan (interactúan). Pueden competir por un recurso compartido, por ejemplo el alimento, el agua, la luz o el espacio. Uno puede depender del otro, por algún beneficio especial o pueden no tener ningún efecto directo el uno sobre el otro. Los individuos de una misma especie que se reproducen entre sí forman lo que en ecología se llaman Poblaciones. A las poblaciones de distintas especies que viven y comparten el mismo espacio se las llama Comunidades. Una interacción interespecífica es una acción recíproca que se realiza entre dos poblaciones de especies diferentes. Cada especie tiene un efecto positivo (+), negativo (-) o nulo (0) sobre las demás. Así, se pueden expresar las diferentes maneras en que pueden interactuar las poblaciones de dos especies. DIAPOSITIVA 1: Clasificación de Interacciones Interespecíficas Se pueden clasificar las interacciones de acuerdo al efecto que produce cada población sobre la otra. a) Neutralismo (0,0): Ninguna población afecta a la otra. Por ej. las hormigas y los felinos; o los roedores y el clavel del aire. Estas especies desarrollan sus actividades dentro de mismo espacio sin producir influencia alguna sobre la otra especie. b) Competencia (-,-): Dos o más especies se perjudican mutuamente al competir por el mismo recurso que es escaso en el ambiente. Estrechamente relacionado con la competencia interespecífica está el concepto de nicho. El nicho es básicamente, la función que cumple un organismo dentro de una comunidad. Puede estar determinado por la competencia ya que ésta ha sido una fuerza evolutiva importante que ha conducido a la separación de nichos en el tiempo, a la especialización y a la diversificación. c) Mutualismo Obligatorio. Simbiosis (+,+): Es una asociación donde ambas especies se benefician y es obligatoria porque ninguna puede sobrevivir sin la presencia de la otra. Un ejemplo de simbiosis son los líquenes, una asociación de hongos y algas. Los primeros proveen la parte estructural o de soporte llamadas hifas, mientras que las algas aportan las estructuras especializadas para realizar la fotosíntesis.
- 1585. SENDERO DEL GARABATO d) Mutualismo no obligatorio. Protocooperación (+,+): Ambas poblaciones se benefician de alguna manera pero la relación no es esencial para la supervivencia de ninguna. Un ejemplo es la relación entre las abejas y las flores. e) Mimetismo Mülleriano (+,+): Semejanza de dos o más especies desagradables o peligrosas, lo cual aumenta el rechazo por parte del depredador. En este caso se benefician ambas especies ya que los depredadores aprenden rápidamente a evitarlas. Ej. las abejas y las avispas, ambas presentan bandas negras y amarillas. Como ambas comparten el mismo patrón de advertencia, los predadores (aves, reptiles, anfibios, arañas, etc.) aprenden con mayor rapidez a evitarlas recibiendo también un beneficio, ya que se ahorran el gasto energético que implica cazar presas desagradables o peligrosas. f) Mimetismo Batesiano (+,-): Se presenta cuando una especie sabrosa o inofensiva (imitadora) trata de asemejarse a una especie de mal sabor o peligrosa (modelo). De esta manera, la especie imitadora o mimética, se beneficia ahuyentando a los predadores con coloraciones advertidoras. Pero la especie modelo se ve perjudicada ya que algunos predadores encontrarán estas mismas coloraciones en especies sabrosas o inofensivas y requerirán de más tiempo para aprender a evitar a la especie verdaderamente peligrosa. Un ejemplo que ilustra este fenómeno es la coloración mimética de la falsa coral asemejándose a la víbora de coral. Ambas tienen franjas de color rojo, negro y amarillo, pero es diferente el orden que presentan los colores a o largo del reptil, además de que las franjas son completas en la verdadera coral e incompletasen la falsa coral, dejando el vientre liso. g) Depredación (+,-): En esta interacción hay un beneficiado (el depredador) y un perjudicado (la presa). Podemos definir dos tipos de depredación: Depredación Total, Depredación o Carnivoría (+,-): Es la relación que se establece entre un carnívoro y su presa. En esta interacción el depredador mata y consume a su presa. La selección natural influye sobre ambas poblaciones, tiende a aumentar la eficiencia del predador para encontrar, capturar y consumir la presa; y por otro lado, favorece la aparición de nuevas adaptaciones de la presa para evitar ser encontrada, capturada y consumida. Ejemplos de depredación total son los carnívoros como el puma, que caza y se alimenta de roedores (maras, vizcachas, cuises, chinchillas) y guanacos. El zorro y aves rapaces, se alimentan de medianos y pequeños roedores, culebras e insectos.
- 1586. SENDERO DEL GARABATO Depredación Parcial. Herbivoría (+,-): El depredador (herbívoro) no mata a su presa (existen casos excepcionales), sino que consume partes de ella como las hojas, brotes tiernos, frutos y semillas. Un ejemplo muy conocido en nuestra provincia es el ganado caprino, que consume hojas y brotes de numerosas plantas que habitan el desierto. Entre la fauna silvestre encontramos al tunduque o tuco-tuco, el guanaco, los cuises, la vizcacha, la mara, etc. como ejemplos de animales herbívoros. h) Parasitismo (+,-): Puede considerarse también como una forma de depredación parcial, en la que el parásito vive a expensas de su hospedador u huésped. El parásito se alimenta de su hospedador pero rara vez llega a matarlo, ya que no logra sobrevivir y ni reproducirse sin él. Son ejemplos la liga y su planta hospedadora, el algarrobo y la flor de tierra, la pulga y el perro y los numerosos parásitos intestinales de animales domésticos y del hombre. Hemiparasitismo (+,-): Es un caso especial de parasitismo donde el parásito es otra planta que se alimenta del su hospedador y lo utiliza como sustrato, pero a la vez realiza la fotosíntesis produciendo su propio alimento. Se desarrolla un ejemplo en la diapositiva 3. i) Comensalismo (+,o): Se presenta cuando una especie mantiene o proporciona una condición necesaria para el bienestar de otra, pero al mismo tiempo no afecta a su propio bienestar. Por ejemplo, la garcita bueyera se alimenta de los insectos que espanta el ganado al caminar por el pasto o al pastorear. En este caso el ganado no se beneficia ni perjudica. j) Amensalismo (-,o): Una especie reduce o afecta de manera adversa a la población de otra especie, pero la especie afectada no ejerce ninguna influencia sobre la primera. Ejemplo es el hongo Penicillium y las bacterias. El hongo produce una sustancia llamada penicilina que impide el crecimiento de las bacterias. DIAPOSITIVA 2: Interacciones en el Ecosistema. El Algarrobo. Ecológicamente, el algarrobo es considerado una “especie clave” en los ecosistemas áridos, porque es un recurso importante para otras especies, brinda hábitats para distintos organismos y modifica el suelo y la disponibilidad de agua. Por eso lo hemos elegido como centro de algunas interesantes interacciones:
- 1587. SENDERO DEL GARABATO Mutualismo Obligatorio. Simbiosis (+,+): Es una asociación obligatoria en la que ambas especies se benefician. Un ejemplo muy común en nuestro desierto es la simbiosis entre especies de la familia de las Leguminosas, como el algarrobo y el garabato, y las bacterias fijadoras de Nitrógeno. En este caso las bacterias ingresan a las raíces del árbol y comienzan a desarrollar colonias que se visualizan como nódulos en las raíces. En su actividad metabólica, las bacterias son capaces de utilizar nitrógeno atmosférico (el cual no es accesible para las plantas) e incluirlo en compuestos que se incorporan al suelo y así pueden ser absorbidos directamente por la planta. De esta manera se benefician las dos partes, la planta le ofrece protección a las bacterias y estas le proporcionan Nitrógeno, elemento indispensable para la vida. Mutualismo no obligatorio. Protocooperación (+,+): Ambas poblaciones se benefician de alguna manera pero la relación no es esencial para la supervivencia de ninguna. Las flores del algarrobo son muy atractivas para las abejas melíferas que se alimentan de su néctar y transportan el polen fecundando a otras plantas (Polinización) La mara y la vizcacha se alimentan de las vainas (fruto) del algarrobo, transportando las semillas en su sistema digestivo. Las semillas son eliminadas a través de las heces, en lugares alejados de la planta madre lo que les permite aprovechar recursos para germinar y colonizar otros ambientes. Este es un ejemplo de protocooperación llamado Dispersión. Parasitismo (+,-): en este caso la flor de tierra es una angiosperma que carece de clorofila y parasita al algarrobo alimentándose de la savia a través de sus raíces. Herbivoría (+,-): muchas especies animales se alimentan del algarrobo, y consumen sus hojas, raíces, flores, semillas y frutos. Los roedores silvestres, el ganado doméstico, los insectos, etc. son algunos de los herbívoros que utilizan el algarrobo como recurso alimentario. DIAPOSITIVA 3: La Liga y sus Interacciones. La liga es una planta hemiparásita de muchas especies que habitan el desierto mendocino. Posee una flor muy llamativa por su intenso color rojo y su forma campanular. Estas características las hacen muy atractivas para los picaflores, que las visitan constantemente en busca de su néctar. Al introducirse en las flores, estas pequeñas aves
- 1588. SENDERO DEL GARABATO transportan en sus plumas millones de granos de polen que son depositados en otras plantas de liga facilitando la polinización. La flor de la liga se transforma en un fruto negro carnoso y muy pegajoso, apetecido por otras aves que lo consumen. La semilla del fruto queda adherida al pico y es transportadas hacia otros sitios (dispersión). Las aves se limpian en las ramas depositando la semilla en otras plantas que se transforman en nuevas hospedadoras. Así, la semilla se liga puede germinar, emitiendo raíces que penetran en los vasos de la planta huésped. Por medio de sus raíces, la liga obtiene de la planta huésped la savia bruta, y a partir de allí realiza el proceso de fotosíntesis. Es un organismo hemiparásito porque no vive totalmente a expensas de la planta huésped. DIAPOSITIVA 4: Competencia Interespecífica. Los recursos como el alimento, nutrientes minerales, agua, sitios de nidificación, etc. generalmente no se encuentran ilimitadamente en el ambiente. Los individuos que poseen requerimientos similares van a competir por esos recursos. La competencia puede manifestarse a través comportamientos agresivos entre animales que se disputan el territorio o el alimento, por ejemplo el puma y el yaguareté. Las plantas que comparten un área también compiten por la luz, e agua y los nutrientes, produciendo sustancias (sustancias alelopáticas) que impiden el crecimiento de otras plantas de la misma especie. Hay que tener en cuenta que la competencia es un proceso natural de todos los ecosistemas, pero la introducción de especies exóticas, tanto animales como vegetales que compiten con la fauna y flora nativa, se convierte en un problema ambiental que contribuye a la pérdida de biodiversidad. En ausencia de predadores naturales, las especies exóticas se reproducen fácilmente explotando recursos utilizados por las nativas y perjudicándolas. Un ejemplo es la introducción de la liebre de castilla para obtener carne y pieles, que ocasionó una disminución de las poblaciones de mara. La introducción de ganado en los campos naturales perjudica a muchas especies de herbívoros silvestres, como el guanaco y la mara. DIAPOSITIVA 5: Depredación Total. La depredación es una transferencia de energía entre seres vivos y constituye una interacción directa y compleja entre dos o más especies, la que come y la que es comida.
- 1589. SENDERO DEL GARABATO La abundancia de depredadores puede en ocasiones depender de la abundancia de sus presas. Cada una de las especies puede influir sobre el crecimiento poblacional de la otra, y favorecer el establecimiento de nuevas adaptaciones. En esta diapositiva se puede observar parte de la cadena trófica, en donde un carnívoro se alimenta de herbívoros. El predador mata a su presa y la consume en su totalidad. Bibliografía Campos, C.M.; De Pedro, M. del C.; 2001. La Vida en las zonas áridas. El Desierto mendocino. Zeta editores, 109 págs. Claver, S.; Roig Juñet, S. (Eds.). 2001. El Desierto del Monte: La Reserva de la Biosfera de Ñacuñán. 226 págs. Curtis, H.; Barnes, N.S. 1994. Biología. Quinta Edición; 1199 págs. Herrera, C.M.; Pellmyr, O. (Eds.). 2002. Plant-Animal Interactions. An Evolutionary Approach. Blackwell Publishing. 313 págs. Parera, A. 2002. Los mamíferos de la Arentina y la región austral de Sudamérica. Editorial El Ateneo. 453 págs. Simpson, B.B. (Ed.) 1997. Mesquite. Its Biology in Two Desert Scrub Ecosystems. US/IBP Síntesis Series 4. 250 pp. Smith, R.L.; Smith, T.M. 2001. Ecología. Cuarta Edición. Addison Wesley. Pearson Educación S.A. Madrid. 664 págs.
- 1590. Ecología Para otros usos de este término, véase ecología (desambiguación). Ernst Haeckel , creador del términoecología y considerado el fundador de su estudio. La ecología (del griego «οίκοσ» oikos=hogar, y «λóγοσ» logos= estudio ) es la ciencia que estudia a los seres vivos, su ambiente, la distribución, abundancia y cómo esas propiedades son afectadas por la interacción entre los organismos y su ambiente: «la biología de los ecosistemas» (Margalef, 1998, p. 2). En el ambiente se incluyen las propiedades físicas que pueden ser descritas como la suma de factores abióticos locales, como el clima y la geología, y los demás organismos que comparten ese hábitat (factores bióticos). La visión integradora de la ecología plantea que es el estudio científico de los procesos que influyen la distribución y abundancia de los organismos, así como las interacciones entre los organismos y la transformación de los flujos de energía y materia.1 Índice [ocultar] 1 Historia 2 Objeto de estudio 3 Principios y conceptos de la ecología o 3.1 Teoría de sistemas o 3.2 Principios de Ecología
- 1591. o 3.3 Flujos de materia y energía ƒ 3.3.1 Flujo de energía o 3.4 Niveles de organización o 3.5 Cadena trófica o 3.6 Producción y productividad o 3.7 Tasa de renovación o 3.8 Riqueza, diversidad y biodiversidad o 3.9 Biosfera o 3.10 Ecosistema o 3.11 Relaciones espaciales y subdivisiones de la tierra 4 Disciplinas de la Ecología o 4.1 Otras disciplinas 5 Ecólogos célebres 6 Véase también 7 Referencias 8 Bibliografía 9 Enlaces externos Historia[editar] El término ökologie fue introducido en 1869 por el alemán prusiano Ernst Haeckel en su trabajo Morfología general de los organismos (Generelle morphologie der organismen);2 está compuesto por las palabras griegas oikos (casa, vivienda, hogar) y logos (estudio o tratado), por ello ecología significa «el estudio del hogar». En un principio, Haeckel entendía por ecología a la ciencia que estudia las relaciones de los seres vivos con su ambiente, pero más tarde amplió esta definición al estudio de las características del medio, que también incluye el transporte de materia y energía y su transformación por las comunidades biológicas. Objeto de estudio[editar]
- 1592. La ecología es la rama de la Biología que estudia las interacciones de los seres vivos con su hábitat. Esto incluye factores abióticos, esto es, condiciones ambientales tales como: climatológicas, edáficas, etc.; pero también incluye factores bióticos, esto es, condiciones derivadas de las relaciones que se establecen con otros seres vivos. Mientras que otras ramas se ocupan de niveles de organización inferiores (desde la bioquímica y la biología molecular pasando por la biología celular, la histología y la fisiología hasta la sistemática), la ecología se ocupa del nivel superior a éstas, ocupándose de las poblaciones, las comunidades, los ecosistemas y la biosfera. Por esta razón, y por ocuparse de las interacciones entre los individuos y su ambiente, la ecología es una ciencia multidisciplinaria que utiliza herramientas de otras ramas de la ciencia, especialmente Geología,Meteorología, Geografía, Sociología, Física, Química y Matemática. Los trabajos de investigación en esta disciplina se diferencian con respecto de la mayoría de los trabajos en las demás ramas de la Biología por su mayor uso de herramientas matemáticas, como la estadística y los modelos matemáticos. Además, la comprensión de los procesos ecológicos se basa fuertemente en los postulados evolutivos (Dobzhansky, 1973). Principios y conceptos de la ecología[editar] Teoría de sistemas[editar] Artículo principal: Teoría de sistemas. Principios de Ecología[editar] Plantas y animales florecen solo cuando ciertas condiciones físicas están presentes. En la ausencia de tales condiciones, las plantas y animales no pueden sobrevivir sin ayuda de estos, son comensalismos. Flujos de materia y energía[editar]
- 1593. Artículo principal: Ciclos biogeoquímicos. Flujo de energía[editar] En esta sucesión de etapas en las que un organismo se alimenta y es devorado la energía fluye desde un nivel trófico a otro. Las plantas verdes u otros organismos que realizan la fotosíntesis utilizan la energía solar para elaborar hidratos de carbono para sus propias necesidades. La mayor parte de esta energía química se procesa en el metabolismo y se pierde en forma de calor en la respiración. Las plantas convierten la energía restante en biomasa sobre el suelo como tejido leñoso y herbáceo y, bajo éste, como raíces. Por último, este material, que es energía almacenada, se transfiere al segundo nivel trófico que comprende los herbívoros que pastan, los descomponedores y los que se alimentan de detritos. Si bien, la mayor parte de la energía asimilada en el segundo nivel trófico se pierde de nuevo en forma de calor en la respiración, una porción se convierte en biomasa. En cada nivel trófico los organismos convierten en biomasa menos energía de la que reciben. Por lo tanto, cuantos más pasos se produzcan entre el productor y el consumidor final queda menos energía disponible. Rara vez existen más de cuatro o o cinco niveles en una cadena trófica. Con el tiempo, toda la energía que fluye a través de los niveles tróficos se pierde en forma de calor. El proceso por medio del cual la energía pierde su capacidad de generar trabajo útil se denomina entropía. Niveles de organización[editar] Para los ecólogos modernos (Begon, Harper y Townsend, 1999)(Molles, 2006), la ecología puede ser estudiada a varios niveles o escalas: x Organismo (las interacciones de un ser vivo dado con las condiciones abióticas directas que lo rodean) x Población (las interacciones de un ser vivo dado con los seres de su misma especie) x Comunidad (las interacciones de una población dada con las poblaciones de especies que la rodean), x Ecosistema (las interacciones propias de la biocenosis sumadas a todos los flujos de materia y energía que tienen lugar en ella) x Biosfera (el conjunto de todos los seres vivos conocidos) Cadena trófica[editar] Artículo principal: Cadena trófica. Cadena trófica, también llamada red trófica, son una serie de cadenas alimentarias íntimamente relacionadas por las que circulan energía y materiales en un ecosistema. Se entiende por cadena alimentaria cada una de las relaciones alimenticias que se establecen de forma lineal entre organismos que pertenecen a distintos niveles tróficos. La cadena trófica está dividida en dos grandes categorías: la
- 1594. cadena o red de pastoreo, que se inicia con las plantas verdes, algas o plancton que realiza la fotosíntesis, y la cadena o red de detritos que comienza con los detritos orgánicos. Estas redes están formadas por cadenas alimentarias independientes. En la red de pastoreo, los materiales pasan desde las plantas a los consumidores de plantas (herbívoros) y de éstos a los consumidores de carne (carnívoros). En la red de detritos, los materiales pasan desde las plantas y sustancias animales a las bacterias y a los hongos (descomponedores), y de éstos a los que se alimentan de detritos (detritívoros) y de ellos a sus depredadores (carnívoros). Por lo general, entre las cadenas tróficas existen muchas interconexiones; por ejemplo, los hongos que descomponen la materia en una red de detritos pueden dar origen a setas que son consumidas por ardillas, ratones y ciervos en una red de pastoreo. Los petirrojos son omnívoros, es decir, consumen plantas y animales, y por esta razón están presentes en las redes de pastoreo y de detritos. Los petirrojos se suelen alimentar de lombrices de tierra que son detritívoras y se alimentan de hojas en estado de putrefacción. Producción y productividad[editar] En un ecosistema, las conexiones entre las especies se relacionan generalmente con su papel en la cadena alimentaria. Hay tres categorías de organismos: x Productores o Autótrofos -- Generalmente las plantas o las cianobacterias que son capaces de fotosintetizar pero podrían ser otros organismos tales como las bacterias cerca de los respiraderos del océano que son capaces de quimiosintetizar. x Consumidores o Heterotrofos -- Animales, que pueden ser consumidores primarios (herbívoros), o consumidores secundarios o terciarios (carnívoros y omnívoros). x Descomponedores o detritívoros -- Bacterias, hongos, e insectos que degradan la materia orgánica de todos los tipos y restauran los alimentos al ambiente. Entonces los productores consumirán los alimentos, terminando el ciclo. Estas relaciones forman las secuencias, en las cuales cada individuo consume al precedente y es consumido por el siguiente, lo que se llama cadenas alimentarias o las redes del alimento. En una red de alimento habrá pocos organismos en cada nivel como uno sigue los acoplamientos de la red encima de la cadena, formando una pirámide. Estos conceptos llevan a la idea de biomasa (la materia viva total en un ecosistema), de la productividad primaria (el aumento en compuestos orgánicos), y de la productividad secundaria (la materia viva producida por los consumidores y los descomponedores en un rato dado). Estas dos ideas pasadas son dominantes, puesto que permiten evaluar la capacidad de carga -- el número de organismos que se pueden apoyar por un ecosistema dado. En ninguna red del alimento se transfiere totalmente la energía
- 1595. contenida en el nivel de los productores a los consumidores. Se pierden ascendentes cuanto más alta es la cadena, mayor la energía y los recursos. Así, puramente de una energía y desde el punto de vista del alimento es más eficiente para que los seres humanos sean consumidores primarios (subsistir de vehículos, de granos, de las legumbres, de la fruta, etc.) que consumidores secundarios (herbívoros consumidores, omnívoros, o sus productos), y aún más que sean consumidores terciarios (carnívoros consumidores, omnívoros, o sus productos). Un ecosistema es inestable cuando sobra la capacidad de carga. La productividad total de los ecosistemas es estimada a veces comparando tres tipos de ecosistemas con base en tierra y el total de ecosistemas acuáticos; se estima que la mitad de la producción primaria puede ocurrir en tierra, y el resto en el océano. x Los bosques (1/3 de la superficie terrestre de la Tierra) contienen biomasas densas y muy productivas. x Sabanas, praderas, y pantanos (1/3 de la superficie terrestre de la Tierra) contienen biomasas menos densas, pero es productiva. Estos ecosistemas representan a las mayores partes de las que dependen el alimento humano. x Ecosistemas extremos en las áreas con climas más extremos -- desiertos y semi-desiertos, tundra, prados alpestres, y estepas -- (1/3 de la superficie terrestre de la Tierra). Tienen biomasas muy escasas y baja productividad. x Finalmente, los ecosistemas del agua marina y dulce (3/4 de la superficie terrestre de la Tierra) contiene biomasas muy escasas (aparte de las zonas costeras). Los ecosistemas difieren en su biomasa (carbón de los gramos por metro cuadrado) y la productividad (carbón de los gramos por metro cuadrado por día), y las comparaciones directas de la biomasa y la productividad puede no ser válida. Un ecosistema como este en la taiga puede ser alto en biomasa, pero de crecimiento lento y así bajo en productividad. Los ecosistemas se comparan a menudo en base de su volumen de ventas (cociente de la producción) o del tiempo del volumen de ventas que sean los recíprocos del volumen de ventas. Las acciones humanas durante los últimos siglos han reducido seriamente la cantidad de la tierra cubierta por los bosques (tala de árboles), y han aumentado agroecosistemas. En últimas décadas ha ocurrido un aumento en las áreas ocupadas por ecosistemas extremos, como en el caso de la desertificación. Tasa de renovación[editar] Riqueza, diversidad y biodiversidad[editar] Artículo principal: Biodiversidad.
- 1596. Algunas de las tasas de diversidad biológica más altas se observan en los arrecifes de coral. Biosfera[editar] Artículo principal: Biosfera. La capa exterior del planeta Tierra puede ser dividida en varios compartimentos: la hidrosfera (o esfera de agua), la litosfera (o ámbito de los suelos y rocas), y la atmósfera (o la esfera de aire). La biosfera (o la esfera de la vida), a veces descrita como el cuarto sobre es la materia viva del planeta, o la parte del planeta ocupada por la vida. Alcanza así en los otros tres ámbitos, aunque no hay habitantes permanentes de la atmósfera. En relación con el volumen de la Tierra, la biosfera es sólo la capa superficial muy delgada que se extiende 11.000 metros bajo el nivel del mar a 15.000 metros por encima. Se piensa que la vida por primera vez se desarrolló en la hidrosfera, a profundidades someras, en la zona fótica. (Sin embargo, recientemente, una teoría de la competencia se ha convertido, de que la vida se originó alrededor de fuentes hidrotermales en la profundidad de océano. Véase elorigen de la vida.) Luego aparecieron los organismos multicelulares y colonizaron las zonas bentónicas. Organismos fotosintéticos gradualmente emitieron, mediante reacciones químicas, los gases hasta llegar a las actuales concentraciones, especialmente la abundancia de oxígeno, que caracterizan a nuestro planeta. La vida terrestre se desarrolló más tarde, protegida de los rayos UV por la capa de ozono. La diversificación de las especies terrestres se piensa que fue incrementada por la deriva de los continentes por aparte, o, alternativamente, chocar. La biodiversidad se expresa en el nivel ecológico
- 1597. (ecosistema), nivel de población (diversidad intraespecífica), especies (diversidad específica), y nivel genético. La biosfera contiene grandes cantidades de elementos tales como carbono, nitrógeno, hidrógeno y oxígeno. Otros elementos, tales como el fósforo, calcio y potasio, también son esenciales a la vida, aún están presentes en cantidades más pequeñas. En el ecosistema y los niveles de la biosfera, es un continuo reciclaje de todos estos elementos, que se alternan entre los estados minerales y orgánicos. Aunque hay una ligera entrada de la energía geotérmica, la mayor parte del funcionamiento de los ecosistemas se basa en la aporte de la energía solar. Las plantas y los microorganismos fotosintéticos convierten la luz en energía química mediante el proceso de fotosíntesis, lo que crea la glucosa (un azúcar simple) y libera oxígeno libre. La glucosa se convierte así en la segunda fuente de energía que impulsa el ecosistema. Parte de esta glucosa se utiliza directamente por otros organismos para la energía. Otras moléculas de azúcar pueden ser convertidas en otras moléculas como los aminoácidos. Las plantas usan alguna de estos azúcares, concentrado en el néctar, para atraer a los polinizadores para la ayuda en la reproducción. La respiración celular es el proceso mediante el cual los organismos (como los mamíferos) rompen de glucosa hacia abajo en sus mandantes, el agua y el dióxido de carbono, por lo tanto, recuperar la energía almacenada originalmente dio el sol a las plantas. La proporción de la actividad fotosintética de las plantas y otros fotosintetizadores a la respiración de otros organismos determina la composición de la atmósfera de la Tierra, en particular su nivel de oxígeno. Las corrientes de aire globales unen la atmósfera mantieniendo casi el mismo equilibrio de los elementos en áreas de intensa actividad biológica y las áreas de la actividad biológica ligera. El agua es también intercambiada entre la hidrosfera, la litosfera, la atmósfera, la biosfera y en ciclos regulares. Los océanos son grandes depósitos que almacenan el agua, aseguran la estabilidad térmica y climática, y facilitan el transporte de elementos químicos gracias a las grandes corrientes oceánicas. Para una mejor comprensión de cómo funciona la biosfera, y las diversas disfunciones relacionadas con la actividad humana, científicos Americanos trataron de simular la biosfera en un modelo en pequeña escala, llamado Biosfera 2. Ecosistema[editar] Artículo principal: Ecosistema.
- 1598. El Daintree Rainforest de Queensland,Australia es un ejemplo de un ecosistema forestal tropical . Un principio central de la ecología es que cada organismo vivo tiene una relación permanente y continua con todos los demás elementos que componen su entorno. La suma total de la interacción de los organismos vivos (la biocenosis) y su medio no viviente (biotopo) en una zona que se denomina un ecosistema. Los estudios de los ecosistemas por lo general se centran en la circulación de la energía y la materia a través del sistema. Casi todos los ecosistemas funcionan con energía del sol capturada por los productores primarios a través de la fotosíntesis. Esta energía fluye a través de la cadena alimentaria a los consumidores primarios (herbívoros que comen y digeren las plantas), y los consumidores secundarios y terciaria(ya sea omnívoros o carnívoros). La energía se pierde a los organismos vivos cuando se utiliza por los organismos para hacer el trabajo, o se pierde como calor residual. La materia es incorporada a los organismos vivos por los productores primarios. Las plantas fotosintetizadoras fijan el carbono a partir del dióxido de carbono y del nitrógeno de la atmósfera o nitratos presentes en el suelo para producir aminoácidos. Gran parte de los contenidos de carbono y nitrógeno en los ecosistemas es creado por las instalaciones de ese tipo, y luego se consume por los consumidores secundarios y terciarios y se incorporan en sí mismos. Los nutrientes son generalmente devueltos a los ecosistemas a través de la descomposición. Todo el movimiento de los productos químicos en un ecosistema que se denomina un ciclo biogeoquímico, e incluye el ciclo del carbono y del nitrógeno. Los ecosistemas de cualquier tamaño se pueden estudiar, por ejemplo, una roca y la vida de las plantas que crecen en ella puede ser considerado un ecosistema. Esta roca puede estar dentro de un llano, con muchas de estas rocas, hierbas pequeñas, y animales que pastorean - también un ecosistema-. Este puede ser simple en la tundra, que también es un ecosistema (aunque una vez que son de este tamaño,
- 1599. por lo general se denominaecozonas o biomas). De hecho, toda la superficie terrestre de la Tierra, toda la materia que lo compone, el aire que está directamente encima de éste, y todos los organismos vivos que viven dentro de ella puede ser considerados como una solo, gran ecosistema. Los ecosistemas se pueden dividir en los ecosistemas terrestres (incluidos los ecosistemas de bosques, estepas, sabanas, etc), los ecosistemas de agua dulce (lagos, estanques y ríos), y losecosistemas marinos, en función del biotopo dominante. Relaciones espaciales y subdivisiones de la tierra[editar] Artículo principal: Bioma. Artículo principal: Ecozona. Montículos de Termita con chimeneas de diferentes alturas para regular el intercambio de gases, temperatura y otros parámetros ambientales necesarios para mantener la fisiologia de toda la colonia.3 Los ecosistemas no están aislados unos de otros sino interrelacionadas; por ejemplo, el agua puede circular entre los ecosistemas por medio de un río o corriente oceánica. El agua en sí, como un medio líquido, incluso define los ecosistemas. Algunas especies, como el salmón o la anguila de agua dulce se mueven entre los sistemas marinos y de agua dulce. Estas relaciones entre los ecosistemas conducen a la idea de bioma. Un bioma es una formación homogénea ecológica que existe en una amplia región, como la tundra y las estepas. La biosfera comprende la totalidad de los biomas de la Tierra - la totalidad de los lugares donde la vida es posible - desde las montañas más altas a las profundidades oceánicas.
- 1600. Los biomas están bastante bien distribuidos a lo largo de las subdivisiones a las latitudes, desde el ecuador hacia los polos, con las diferencias basadas en el entorno físico (por ejemplo, los océanos o cordilleras) y el clima. Su variación está generalmente relacionada con la distribución de las especies de acuerdo a su capacidad para tolerar la temperatura, la sequedad, o ambos. Por ejemplo, se pueden encontrar algas fotosintéticas sólo en la parte luminosa de los océanos (donde penetra la luz), mientras que las coníferas se encuentran principalmente en las montañas. Aunque esta es una simplificación de un sistema más complicado, la latitud y la altitud representan de manera adecuada la distribución de la diversidad biológica dentro de la biosfera. En general, la riqueza de la diversidad biológica (así como de los animales como para las especies de plantas) está disminuyendo más rápidamente cerca del ecuador y más lentamente a medida que nos aproximamos a los polos. La biosfera también puede ser dividida en ecozonas, que están muy bien definidas y sobre todo hoy en día sigue las fronteras continentales. Las zonas ecológicas son divididas en las ecorregiones, aunque no hay acuerdo sobre sus límites. Disciplinas de la Ecología[editar] Como disciplina científica en donde intervienen diferentes caracteres la ecología no puede dictar qué es bueno o malo. Aun así, se puede considerar que el mantenimiento de la biodiversidad y sus objetivos relacionados han provisto la base científica para expresar los objetivos del ecologismo y, así mismo, le ha provisto la metodología y terminología para expresar los problemas ambientales. La economía y la ecología comparten formalismo en muchas de sus áreas; algunas herramientas utilizadas en esta disciplina, como tablas de vida yteoría de juegos, tuvieron su origen en la economía. La disciplina que integra ambas ciencias es la economía ecológica. x La ecología microbiana es la rama de la ecología que estudia a los microorganismos en su ambiente natural, los cuales mantienen una actividad continua imprescindible para la vida en la Tierra. En los últimos años se han logrado numerosos avances en esta disciplina con las técnicas disponibles de biología molecular. Los mecanismos que mantienen la diversidad microbiana de la biosfera son la base de la dinámica de los ecosistemas terrestres, acuáticos y aéreos. Es decir, la base de la existencia de lasselvas y de los sistemas agrícolas, entre otros. Por otra parte, la diversidad microbiana del suelo es la causa de la fertilidad del mismo. x La biogeografía: es la ciencia que estudia la distribución de los seres vivos sobre la Tierra, así como los procesos que la han originado, que la modifican y que la pueden hacer desaparecer. Es una ciencia interdisciplinaria, de manera que aunque formalmente es una rama de la Geografía,
- 1601. recibiendo parte de sus fundamentos de especialidades como la Climatología y otrasCiencias de la Tierra, es a la vez parte de la Biología. La superficie de la Tierra no es uniforme, ni en toda ella existen las mismas características. El espacio isotrópico que utilizan, o suponen, los esquemas teóricos de localización es tan solo una construcción matemática del espacio. x La ecología matemática se dedica a la aplicación de los teoremas y métodos matemáticos a los problemas de la relación de los seres vivos con su medio y es, por tanto, una rama de la biología. Esta disciplina provee de la base formal para la enunciación de gran parte de la ecología teórica x La ecología urbana es una disciplina cuyo objeto de estudio son las interrelaciones entre los habitantes de una aglomeración urbana y sus múltiples interacciones con el ambiente. x La ecología de la recreación es el estudio científico de las relaciones ecológicas entre el ser humano y la naturaleza dentro de un contexto recreativo. Los estudios preliminares se centraron principalmente en los impactos de los visitantes en áreas naturales. Mientras que los primeros estudios sobre impactos humanos datan de finales de la década de los 20, no fue sino hasta los 70s que se reunió una importante cantidad de material documental sobre ecología de la recreación, época en la cual algunos países sufrieron un exceso de visitantes en áreas naturales, lo que ocasionó desequilibrios dentro de procesos ecológicos en dichas zonas. A pesar de su importancia para el turismo sostenible y para el manejo de áreas protegidas, la investigación en este campo ha sido escasa, dispersa y relativamente desarticulada, especialmente en países biodiversos. x La ecología del paisaje es una disciplina a caballo entre la geografía física orientada regionalmente y la biología. Estudia los paisajes naturales prestando especial atención a los grupos humanos como agentes transformadores de la dinámica físico-ecológica de éstos. Ha recibido aportes tanto de la geografía física como de la biología, ya que si bien la geografía aporta las visiones estructurales del paisaje (el estudio de la estructura horizontal o del mosaico de subecosistemas que conforman el paisaje), la biología nos aportará la visión funcional del paisaje (las relaciones verticales de materia y energía). Este concepto comienza en 1898, con el geógrafo, padre de la pedología rusa, Vasily Vasilievich Dokuchaev y fue más tarde continuado por el geógrafo alemán Carl Troll. Es una disciplina muy relacionada con otras áreas como la Geoquímica, la Geobotánica, las Ciencias Forestales o la Pedología. x La limnología es la rama de la ecología que se centra en el estudio de los sistemas acuáticos continentales: ríos, lagos, lagunas, etcétera. x La dendroecología se centra en el estudio de la ecología de los árboles.
- 1602. x La ecología regional es una disciplina que estudia los procesos ecosistémicos como el flujo de energía, el ciclo de la materia o la producción de gases de invernadero a escala de paisaje regional o bioma. Considera que existen grandes regiones que funcionan como un único ecosistema. x La agronomía, pesquería y, en general, toda disciplina que tenga relación con la explotación o conservación de recursos naturales, en especial seres vivos, tienen la misma relación con la ecología que gran parte de las ingenierías con la matemática, física o química.
- 1603. El ecosistema y su dinámica El ecosistema Al estudiar un sistema natural desde el punto de vista ecológico, existe algo más que una suma de organismos dentro de un soporte físico-químico. Por ello hay que considerar una serie de elementos básicos: Biotopo: es el medio físico o conjunto de factores abióticos. Está constituido por un suelo (bosque, prado o campo de cultivo) o por una masa de agua (charco, laguna, río o océano) y por todo el conjunto de factores físico-químicos del agua, suelo o atmósfera (temperatura, pluviosidad, iluminación, etc.). Biocenosis: es la comunidad formada por las poblaciones de seres vivos que se condicionan mutuamente, y que solo dependen del ambiente inanimado exterior. Por ecosistema se entiende una unidad ecológica formada por un biotopo y su biocenosis, implicados en un proceso dinámico e incesante de intercambio de materia y energía, y una secuencia continua de nacimientos y muertes, cuyo resultado final es la evolución a nivel de especies y la sucesión a nivel del sistema entero. En un ecosistema, los diferentes elementos están organizados y poseen una estructura determinada, desarrollando cada especie una función concreta. Los ecosistemas poseen un proceso vital en el que alcanzan la madurez (climax), logrando un equilibrio estable necesario para su autorregulación y mantenimiento. La competencia entre especies será mayor cuanto más semejante sea su función, de tal forma que si es la misma, una de ellas eliminará a la otra. La nutrición es una de las principales características que conforman la estructura de un ecosistema, interrelacionando a diversas especies, de manera que los organismos de un ecosistema se organizan según el tipo de nutrición en tres niveles tróficos: productores, consumidores y descomponedores Para saber más Ecosistema Una definición sencilla. En este documento encontrarás definiciones conceptuales del Ecosistemas y sus partes constituyentes. Lee este documento y las dos páginas siguientes y realiza las actividades de autocomprobación. http://recursos.cnice.mec.es/biosfera/alumno/4ESO/servivo/contenidos3.htm ¿Qué es el ecosistema? Conceptos En esta Web, podrás ampliar tus conocimientos sobre el concepto de Ecosistema y elementos adyacentes de manera amena. http://icarito.latercera.cl/enc_virtual/c_nat/ecosistema/eco3.html Ecosistemas, una introducción elemental En esta Web, conocerás más detalladamente los Ecosistemas, sus elementos constituyentes, su evolución y la cadena alimenticia. http://www.barrameda.com.ar/ecologia/ecosistem.htm Ecosistemas: amplia y consolida los conceptos
- 1604. El ecosistema y su dinámica El ecosistema y su dinámica Mediante este documento, podrás profundizar sobre los Ecosistemas y sus conceptos, de una forma amena e interactiva. http://www.esi.unav.es/asignaturas/ecologia/Hipertexto/04Ecosis/100Ecosis.htm#Estudio% 20del%20ecosistema [versión en cache] Ecosistemas: monografía En esta página Web, podrás hallar una monografía interesante sobre los ecosistemas y la contaminación ambiental. http://www.monografias.com/trabajos16/ecosistema-contaminacion/ecosistema- contaminacion.shtml [versión en cache] Área de Ciencias de la Naturaleza - Módulo III Interacciones bióticas En la naturaleza, las poblaciones de diferentes especies no se encuentran aisladas, integrándose dentro de las comunidades. Una comunidad se define como un conjunto de poblaciones que habitan un ambiente común y se encuentran en interacción recíproca. Las relaciones que se establecen entre poblaciones pertenecientes a la misma especie (intraespecíficas) o diferentes especies (interespecíficas), responde a dos modelos: 1. Facultativas. Las especies aisladas no se influyen, sin embargo, cuando están en contacto siguen indiferentes o se perjudican mutuamente (competencia). 2. Obligatorias. Cuando dos especies de forma de vida diferente, al estar en contacto, una de ellas obtiene un beneficio no recíproco de su asociación con la otra (depredación, parasitismo y comensalismo), o ambas se benefician mutuamente (mutualismo). En todos los casos, al menos una de las especies necesita de la otra para su supervivencia. Área de Ciencias de la Naturaleza - Módulo III Relaciones intraespecíficas Se denominan relaciones intraespecíficas a aquellas que se producen entre individuos de la misma especie, dentro de una población o de una biocenosis.
- 1605. Existen dos tipos de mecanismos que rigen estas relaciones: La dispersión, que asegura la suficiente separación para cubrir las necesidades de espacio y alimentos. La cohesión, que posibilita la reproducción y protección mutua. Según las diferentes formas de relación que se pueden establecer en una población, estas pueden ser: 1. Poblaciones familiares. Se componen de individuos emparentados entre sí, que conviven con la finalidad de facilitar la procreación y el cuidado de las crías. Es típica en los mamíferos y en las aves. 2. Poblaciones gregarias. Consisten en grupos de individuos, no necesariamente emparentados, que permanecen unidos durante cierto tiempo para buscar alimento, emigrar, defenderse, etcétera. Este tipo de asociación se observa en las manadas de mamíferos, bandadas de aves o bancos de peces. 3. Poblaciones coloniales. Están formadas por individuos que proceden de un mismo progenitor, a través de reproducción asexual, y que permanecen unidos durante toda su existencia. Una de sus ventajas es capturar el alimento con mayor facilidad. Las esponjas, corales y otros pólipos forman este tipo de asociaciones. 4. Poblaciones sociales. Formadas por individuos que constituyen una auténtica sociedad
- 1606. El ecosistema y su dinámica jerarquizada con distribución del trabajo, de forma que aunque son independientes, están estrechamente unidos en su forma de vida, siendo incapaces de sobrevivir aislados. Un ejemplo son las hormigas o las abejas, en cuyas poblaciones encontramos zánganos (que son los machos), obreras (hembras) y reina (hembra fértil). Para saber más Poblaciones biológicas Lee el apartado de este artículo correspondiente a Poblaciones y sus características, en él podrás complementar tus conocimientos sobre las poblaciones entre animales. http://www.ecoportal.net/content/view/full/21386/ [versión en cache] La langosta del desierto: relaciones gregarias La lectura de este documento te ayudara a entender de forma ejemplificante las poblaciones gregarias. http://ipmworld.umn.edu/cancelado/Spchapters/ShowlerSP.htm [versión en cache] Hormigas y abejas: insectos sociales Mediante este artículo podrás acceder al ejemplo de las poblaciones sociales de las hormigas y abejas, conociendo todo los aspectos de sus relaciones. http://www.icarito.cl/icarito/2003/905/pag5.htm Corales: relaciones coloniales Este artículo ofrece información sobre las colonias de corlares y en concreto la colonia perteneciente a los corales Cuerno de Ciervo, pudiendo conocer su hábitat, distribución, alimentación, reproducción y amenazas. http://www.sheddaquarium.org/sea/fact_sheets_sp.cfm?id=70 [versión en cache] Área de Ciencias de la Naturaleza - Módulo III Relaciones interespecíficas Las relaciones interespecíficas son las que se establecen entre los individuos de diferentes especies, y por tanto, pertenecientes a poblaciones distintas.
- 1607. Se diferencian, según sean, por mantener el nicho ecológico (misma función dentro del ecosistema) o por las relaciones beneficiosas o perjudiciales que puedan establecerse entre las especies. Consideremos cada relación: Competencia. Se produce cuando dos especies desempeñan una función semejante dentro del ecosistema, luchando ambas por mantener el nicho ecológico y vencer sobre la otra. La competencia es necesaria para el equilibrio del ecosistema, actuando como un mecanismo evolutivo en la aparición de nuevas especies, ya que al competir, la selección natural favorecerá las diferencias que permitan la explotación del entorno de manera distinta. Mutualismo o simbiosis: consiste en una asociación en la que ambas especies obtienen un beneficio mutuo. Este tipo de asociación, es tan positiva para algunas especies que no podrían sobrevivir de forma independiente, como ocurre con los líquenes, unión de algas y hongos. Existen muchos ejemplos de simbiosis como el cangrejo ermitaño y la anémona o la abeja y la flor. Comensalismo: es una interacción en la que una especie se beneficia y la otra no se ve afectada. El animal comensal se aprovecha de los restos de comida no utilizados, así como de mudas, descamaciones o secreciones de otra especie sin causarle perjuicio. Un ejemplo característico es el del pez rémora que se adhiere a un tiburón y se desprende para alimentarse de los restos de su comida; aunque existen otros muchos ejemplos, como las bacterias que viven en nuestro intestino.
- 1608. Inquilinismo: se puede entender como un tipo de comensalismo en el que la especie inquilina obtiene cobijo y protección del otro, que permanece indiferente. Las aves que anidan en los árboles son ejemplos del inquilinismo, como también lo son las rubíocas que viven en el interior de los pepinos de mar. Parasitismo: las especies parásitas son aquellas que viven a expensas de otras especies denominadas hospedadores. El parásito perjudica al hospedador aunque no suele causarle la muerte inmediata ya que su objetivo inicial es alimentarse de él. Los parásitos pueden ser: Ectoparásitos o parásitos externos: son los que viven fuera del hospedador, se adhieren a su superficie y succionan parte de sus líquidos, como las garrapatas, mosquitos, piojos, etcétera. Endoparásitos también llamados parásitos internos: se alojan en el interior del hospedador donde obtienen su alimento. Entre ellos destacan las lombrices intestinales y los microorganismos patógenos que provocan enfermedades. Depredación: es la forma de relación por la cual el depredador se alimenta de la presa, capturándola y provocándole la muerte. Los depredadores más conocidos son los grandes felinos como los leones o tigres, pero también hay otros muchos ejemplos como serpientes, águilas, arañas, etcétera.
- 1609. El ecosistema y su dinámica Las poblaciones de depredadores y presas se autocontrolan, de manera que cuando aumenta la población de presas, aumentan también los depredadores, lo que hace bajar la población de presas, y en consecuencia disminuye la población depredadora. Para saber más Relaciones interespecíficas entre animales: definición En este artículo podrás conocer una explicación sencilla de las relaciones interespecíficas entre los animales. http://www.wikilearning.com/relaciones_interespecificas-wkccp-2660-10.htm Relaciones interespecíficas: esquemas Este documento nos proporciona de forma esquemática, sencilla y amena, toda la información necesaria para conocer más detalladamente las relaciones interespecíficas entre individuos de distintas especies. http://www.upch.edu.pe/faest/clasvirtual/biologia/biologia_te15.pdf [versión en cache] Relaciones entre organismos: conceptos En este documento, encontraremos una definición simple de los tipos de relaciones interespecíficas. http://www.esi.unav.es/asignaturas/ecologia/Hipertexto/04Ecosis/150RelEsp.htm [versión en cache] Relación interespecífica: una definición ampliada Este documento ofrece una amplia información sobre las diferentes relaciones interespecíficas, que nos ayudaran a consolidar nuestros conocimientos. http://www.brujula.net/wiki/Relaci%C3%B3n_interespec%C3%ADfica.html Área de Ciencias de la Naturaleza - Módulo III Cadenas y redes tróficas Desde el punto de vista trófico o alimentario, los distintos elementos de la biocenosis está interrelacionados entre si mediante cadenas tróficas, que son secuencias coordinadas de organismos en los que unos se comen a otros antes de ser comidos a su vez.
- 1610. Para comprender mejor cómo fluye la energía en un ecosistema, los seres vivos se agrupan en una serie de niveles alimentarios o tróficos, caracterizados por una alimentación semejante, denominados productores, consumidores y descomponedores. Los productores forman el primer nivel trófico, estando integrado por organismos autótrofos que, mediante la fotosíntesis, transforman la energía luminosa en energía química, la cual acumulan en forma de compuestos orgánicos elaborados a partir de materia inorgánica. Son productores todas las plantas verdes, las algas y las bacterias quimiosintéticas. Los consumidores son organismos heterótrofos, que se nutren de materiales orgánicos ya elaborados, al ser incapaces de producir su propio alimento. Se subdividen en: consumidores primarios: son los herbívoros, que comen plantas o algas, y los parásitos de plantas verdes. La mayor parte de la materia orgánica consumida por los herbívoros se elimina sin digerir, utilizándose la energía procedente del material digerido para mantener sus procesos metabólicos y realizar sus actividades cotidianas. Los consumidores secundarios son los carnívoros que se alimentan de herbívoros; apareciendo frecuentemente consumidores de tercer y cuarto orden, aunque cinco eslabones son usualmente el límite. Estos consumidores (carpa, león, águila, pulga, etc.), pueden ser depredadores o parásitos.
- 1611. El ecosistema y su dinámica También pueden aparecer omnívoros, que son animales con una alimentación variada (vegetales, herbívoros o carnívoros), entre los que se encuentra el hombre. En cada nivel trófico disminuye la cantidad total de energía almacenada en la biomasa animal, y en consecuencia, disponible para otros consumidores. Los descomponedores, se alimentan de productos de desecho, excrementos o materia orgánica muerta asegurando el retorno de los materiales inorgánicos al suelo o al agua, de manera que puedan ser nuevamente utilizados por los productores. Para ello, los transformán en compuestos inorgánicos y humus que enriquece el suelo favoreciendo el desarrollo de los vegetales. Su labor es esencial para el reciclaje de la materia y el equilibrio de la biosfera. Área de Ciencias de la Naturaleza - Módulo III Redes tróficas La cadena trófica comienza con el productor primario y sobre ella se establecen los siguientes eslabones tróficos, pero un animal puede variar su dieta y alimentarse de organismos de diferentes niveles. Debido a ello, en la mayoría de los ecosistemas, el flujo de la energía no se realiza en un proceso lineal simple del tipo hierba-vaca-hombre, existiendo una compleja trama alimentaria, denominada red trófica, la cual se representa mediante un esquema de flechas que nos indica quién se come a quién.
- 1612. El ecosistema y su dinámica Para saber más Cadenas y redes tróficas: dinámica del ecosistema Lee este documento en el que hallarás una información esquemática sobre las relaciones entre especies en relaciones sus funciones alimentarias. Realiza las actividades propuestas. http://recursos.cnice.mec.es/biosfera/alumno/4ESO/Dinamica/contenidos3.htm#cadenastroficas Cadenas y redes alimenticias: conceptos Lee este documento para ampliar tus conocimientos sobre las redes alimenticias. http://www.jmarcano.com/nociones/trofico2.html [versión en cache] Cadenas y redes tróficas: una explicación sencilla Mediante la lectura de este artículo conocerás más ampliamente las cadenas tróficas de manera amena e interactiva. http://www.ecopibes.com/ambiente/trofica.htm [versión en cache] Área de Ciencias de la Naturaleza - Módulo III Las pirámides ecológicas El estudio de los distintos niveles tróficos y redes alimentarias que se generan en un ecosistema se representa a través de pirámides ecológicas. Éstas consisten en construcciones gráficas a través de rectángulos superpuestos que se corresponden con los niveles tróficos. Se utilizan tres tipos de pirámides: Las pirámides de números: representan la cantidad de individuos de cada nivel. No siempre tienen forma de pirámide y, en ocasiones, se pueden encontrar invertidas.
- 1613. Las pirámides de biomasa: se utilizan para representar el peso total o biomasa de cada nivel trófico en un momento dado. Las pirámides de energía o producción: ofrecen una visión de la cantidad de energía que existe en cada nivel trófico y de la que se transfiere al siguiente nivel, es decir, del flujo de energía del ecosistema. Este tipo de pirámide no puede estar invertida porque la energía de un nivel inferior siempre debe ser mayor para poder sustentar a otro superior. Para saber más Cadenas, redes y pirámides ecológicas: conceptos Este documento ofrece definiciones sencillas referente a las cadenas tróficas y sus representaciones gráficas. http://natureduca.iespana.es/cienc_cadenas.htm Ecología: diapositivas Está página Web ofrecer una interesante colección de diapositivas que recogen todos los aspectos de la unidad. http://web.educastur.princast.es/proyectos/biogeo_ov/4a_ESO/08_Ecologia/INDICE.htm
- 1614. El ecosistema y su dinámica Área de Ciencias de la Naturaleza - Módulo III La sucesión ecológica La evolución de un ecosistema a lo largo del tiempo, se conoce como sucesión ecológica. Este desarrollo se efectúa de forma gradual, apareciendo comunidades cada vez más estables hasta alcanzar el estadio de madurez o clímax, en el cual las diferentes poblaciones alcanzan un equilibrio mutuo y con el medio abiótico. La sucesión primaria se desarrolla sobre zonas, que no han sido ocupadas anteriormente por ninguna comunidad (coladas volcánicas, dunas arenosas, etc.), iniciándose un proceso lento, que puede durar siglos. La sucesión secundaria se produce en lugares previamente ocupados por otras comunidades, las cuales han sufrido una degradación (tierras de cultivo abandonadas, praderas aradas, bosques talados, fuegos, etc.), siendo generalmente una evolución más rápida, aunque también pueden transcurrir cientos de años antes de alcanzarse el clímax. Para saber más Dinámica del ecosistema: amplia tus conceptos En este artículo encontraremos una definición sencilla de sucesión ecológica y sus distintos tipos. http://natureduca.iespana.es/cienc_dinamica.htm Sucesión ecológica en los bosques En este documento encontrarás un ejemplo de sucesión ecológica y su proceso evolutivo. http://www.jmarcano.com/bosques/tiempo/sucesion.html [versión en cache] Sucesión ecológica: amplia tus conocimientos Este documento permitirá profundizar en las sucesiones y en sus aspectos más característicos. http://biologia.eia.edu.co/ecologia/documentos/sucesionecologica.htm [versión en cache]
- 1615. Bosque tropical en una isla del Pacífico: un ejemplo de sucesión Esta página ofrece un ejemplo esquemático e ilustrativo sobre un ejemplo de sucesión, para observar la imagen de correcta debes pulsar el icono que aparecerá al situar el puntero en la parte inferior derecha de la imagen. http://web.educastur.princast.es/proyectos/biogeo_ov/4a_ESO/08_Ecologia/diapositivas/Diaposi Área de Ciencias de la Naturaleza - Módulo III
- 1616. Unidad 7: La tabla periódica. I.E.S. Clara Campoamor (Getafe) LA TABLA PERIÓDICA CONTENIDOS 1.- Primeras clasificaciones periódicas. 1.1. Sistema periódico de Mendeleiev. 2.- La tabla periódica actual (relación estructura electrónica y reactividad). 2.1. Ley de Moseley. 3.- Carga nuclear efectiva y reactividad. 4.- Propiedades periódicas y su variación en la tabla: 4.1. Tamaño de los átomos: Radios atómico e iónicos. 4.2. Energía de ionización. 4.3. Afinidad electrónica. 4.4. Electronegatividad y carácter metálico. PRIMERAS CLASIFICACIONES PERIÓDICAS. Cuando a principios del siglo XIX se midieron las masas atómicas de una gran canti- dad de elementos, se observó que ciertas propiedades variaban periódicamente en rela- ción a su masa. De esa manera, hubo diversos intentos de agrupar los elementos, todos ellos usando la masa atómica como criterio de ordenación. x Triadas de Döbereiner (1829) (Enlace Web): Buscaba tríos de elementos en los que la masa del elemento intermedio es la media aritmética de la masa de los otros dos. Así se encontraron las siguientes triadas: 9 Cl, Br y I; 9 Li, Na y K; 9 Ca, Sr y Ba; 9 S, Se y Te… x Anillo de Chancourtois (1862). Co- loca los elementos en espiral de forma que los que tienen pareci- das propiedades queden unos en- cima de otros. x Octavas de Newlands (1864). x Clasificación de Mendeleiev (1869). Clasificación de Mendeleiev (1869).Clasificación de Mendeleiev (1869). La clasificación de Mendeleiev es la mas conocida y elaborada de todas las primeras clasificaciones periódicas. Clasificó lo 63 elementos conocidos hasta entonces utilizando el criterio de masa atómica usado hasta entonces, ya que hasta bastantes años después no se definió el concepto de número atómico puesto que no se habían descubierto los protones. (Enlace Web) C OBe B NLiH Si SNa Mg Al PF Ti FeK Ca Cr MnCl Octavas de Newlands F. Javier Gutiérrez Rodríguez Página 1 de 9
- 1617. Unidad 7: La tabla periódica. I.E.S. Clara Campoamor (Getafe) Su tabla periódica dejaba espacios vacíos, que él consideró que se trataba de ele- mentos que aún no se habían descubierto. Así, predijo las propiedades de algunos de éstos, tales como el germanio (Ge), al que Mendeleiev llamó ekasilicio. Cuando todavía en vida de Mendeleiev se descubrió el Ge que tenía las propiedades previstas por éste, su clasificación periódica adquirió gran prestigio. Tabla periódica de Mendeleiev Otro de los inconvenientes que poseía la tabla de Mendeleiev era que algunos ele- mentos tenía que colocarlos en desorden de masa atómica para que coincidieran las pro- piedades. Él lo atribuyó a que las masas atómicas estaban mal medidas. Así, por ejemplo, colocó el teluro (Te) antes que el yodo (I) a pesar de que la masa atómica de éste era menor que la de aquel. Hoy sabemos que las masas atómicas estaban bien medidas y que el problemas era el criterio de clasificación hasta entonces usado. (Ver Tabla origi- nal). LA TABLA PERIÓDICA ACTUAL. En 1913 Moseley ordenó los ele- mentos de la tabla periódica usando como criterio de clasificación el número atómico. Enunció la “ley periódica”: Si los elementos se colocan según au- menta su número atómico, se obser- va una variación periódica de sus propiedades físicas y químicas. A partir de entonces la clasificación periódica de los elementos siguió ese criterio, pues en los átomos neutros el número de protones es igual al de elec- trones y existe una relación directa entre el último orbital ocupado por un e– de un átomo (configuración electrónica) y su F. Javier Gutiérrez Rodríguez Página 2 de 9
- 1618. Unidad 7: La tabla periódica. I.E.S. Clara Campoamor (Getafe) posición en la tabla periódica y, por tanto, en su reactividad química, fórmula estequiomé- trica de compuestos que forma... (Ver Tabla en la Web) Se clasifica en cuatro bloques: hozar x Bloque “s”: A la izquierda de la tabla, formado por los grupos 1 y 2. x Bloque “p”: A la derecha de la tabla, formado por los grupos 13 al 18. x Bloque “d”: En el centro de la tabla, formado por los grupos 3 al 12. x Bloque “f”: En la parte inferior de la tabla. El hidrógeno (H) de difícil ubicación en la tabla y el helio (He), claramente en el gru- po 18 de los gases nobles, tienen configuración “s1 ” y “s2 ” respectivamente. BloqueGrupoNombres Config. Electrón. s 1 2 Alcalinos Alcalino-térreos n s1 n s2 p 13 14 15 16 17 18 Térreos Carbonoideos Nitrogenoideos Anfígenos Halógenos Gases nobles n s2 p1 n s2 p2 n s2 p3 n s2 p4 n s2 p5 n s2 p6 d 3-12 Elementos de transición n s2 (n–1)d1-10 f El. de transición Interna (lantánidos y actínidos)n s2 (n–1)d1 (n–2)f1-14 Cada uno de los e– de cada elemento viene determinado por una combinación de cuatro números cuánticos, de tal manera, que tal y como se enunció en el principio de exclusión de Pauli: “No hay dos electrones del mismo átomo que tenga los cuatro núme- ros cuánticos iguales, Ejemplo: Determinar la posición que ocupará un átomo cuya configuración electrónica termine en 5d4 6 s2 . W Periodos 1 2 3 4 5 6 7 F. Javier Gutiérrez Rodríguez Página 3 de 9
- 1619. Unidad 7: La tabla periódica. I.E.S. Clara Campoamor (Getafe) CARGA NUCLEAR EFECTIVA (Z*) Es la carga real que mantiene unido a un e– al núcleo. Depende de dos factores contrapuestos: x Carga nuclear (Z). A mayor ”Z” mayor ”Z* ”, pues habrá mayor atracción por parte del núcleo al haber más protones. x Apantallamiento o efecto pantalla (a) de e– interiores o repulsión electrónica. A mayor apantallamiento menor ”Z* ”. Así consideraremos que: Z Z a Variación de Z* en la tabla.Variación de Z* en la tabla. x Varía poco al aumentar Z en los e– de valencia de un mismo grupo, pues aunque hay una mayor carga nuclear también hay un mayor apantallamiento. Considera- remos que en la práctica cada e– de capa interior es capaz de contrarrestar el efecto de un protón. Ejemplo:Z Z* sobre el e– exterior del Li sería: 3 – 2 = 1, mientras que en el caso del Na sería: 11 – 10 = 1, es decir apenas varía. x Crece hacia la derecha en los elemen- tos de un mismo periodo, debido al me- nor apantallamiento de los e– de la últi- ma capa y al mayor “Z”, de manera que según se avanza en un periodo hacia la derecha crece más “Z” que “a”, pues el apantallamiento de los e– de ultima ca- pa es inferior a 1. aumenta Carga nuclear efectiva Ejemplo: Z* sobre uno de los e– exteriores del Be sería: 4 – (2 + 0,8) = 1,2 mientras que en el caso del Li era: 3 – 2 = 1. Nota: el valor 0,8 de apantallamiento del e– de la segunda capa es orientativo; lo importante es que es un número inferior a 1. Carga nuclear efectiva y reactividad.Carga nuclear efectiva y reactividad. La atracción que sufren los electrones de valencia no sólo dependen de la carga nu- clear efectiva, sino también de la distancia del e– al núcleo (ley de Coulomb). Por ello, la reactividad de los átomos dependerá de ambos factores. Así, los metales serán tanto más reactivos cuanto menor Z* y mayor distancia al nú- cleo, es decir, cuando pierdan los e– con mayor facilidad. Ejemplo: El e– 4s del K es más reactivo que el 3s del Na. F. Javier Gutiérrez Rodríguez Página 4 de 9
- 1620. Unidad 7: La tabla periódica. I.E.S. Clara Campoamor (Getafe) tesGasesiner METALES NO METALES Aumento en la Reactividad Sin embargo, los no-metales serán más reactivos a mayor Z* y menor distancia al núcleo, es decir, cuando los e– que entran sean más atraídos. Ejemplo: El e– que capture el F será más atraído que el que capture el O o el Cl. PROPIEDADES PERIÓDICAS. Tal y como viene enunciado en la ley periódica, hay una serie de propiedades en los elementos que varían de manera periódica al ir aumentando el número atómico. Vamos a estudiar algunas de ellas. (Ver en la Web) x Tamaño del átomo: 9 Radio atómico: – Radio covalente. – Radio metálico. 9 Radio iónico. x Energía de ionización. x Afinidad electrónica. x Electronegatividad. x Carácter metálico. TAMAÑO DE LOS ÁTOMOS. Radio atómicoRadio atómico Se define como: “la mitad de la distancia de dos átomos iguales que están enlazados entre sí”. Por dicha razón, se habla de radio cova- lente y de radio metálico según sea el tipo de enlace por el que están unidos. Es decir, el radio de un mismo átomo depende del tipo de enlace que forme, e incluso del tipo de red cristalina que formen los metales. Haz clic en la imagen para verla ampliada F. Javier Gutiérrez Rodríguez Página 5 de 9
- 1621. Unidad 7: La tabla periódica. I.E.S. Clara Campoamor (Getafe) En un mismo periodo disminuye al aumen- tar la carga nuclear efectiva, es decir, hacia la derecha, debido a que los electrones de la últi- ma capa estarán más fuertemente atraídos. En un grupo, lógicamente aumenta al au- mentar el periodo pues existen más capas de electrones. Radio iónicoRadio iónico Es el radio que tiene un átomo cuando ha perdido o ganado electrones, adquiriendo la estructura electrónica del gas noble más cercano. Los cationes son menores que los átomos neutros por la mayor carga nuclear efec- tiva (menor apantallamiento o repulsión electrónica). Cuanto mayor sea la carga, menor será el ion; así, en un mismo periodo, los metales alcalinotérreos serán menores que los alcalinos correspondientes, dado que en ambos casos existe el mismo apantallamiento, mientras que los alcalinotérreos superan en una unidad la carga nuclear de los alcalinos. Los aniones son mayores que los átomos neutros por la disminución de la carga nuclear efectiva (mayor apantallamiento o repulsión electrónica). Cuanto mayor sea la carga, mayor será el ion; así, en un mismo periodo, los anfígenos serán mayores que los halógenos correspondientes, dado que en ambos casos existe el mismo apantallamiento, mientras que los halógenos superan en una unidad la carga nuclear de los anfígenos. En general, entre los iones con igual número de electrones (isoelectrónicos) tiene mayor radio el de menor número atómico, pues la fuerza atractiva del núcleo es menor al ser menor su carga. COMPARACIÓN DE TAMAÑOS DE ATOMOS E IONES Metales alcalinos Halógenos Iones isolectrónicos Imágenes tomadas de http://eros.pquim.unam.mx/~moreno/cap04a.htm#_Toc508460408 Aumento del radio atómico F. Javier Gutiérrez Rodríguez Página 6 de 9
- 1622. Unidad 7: La tabla periódica. I.E.S. Clara Campoamor (Getafe) Ejemplo (Selectividad. Madrid Junio 1997). a) De las siguientes secuencias de iones, razone cual se corresponde con la ordenación en función de los radios iónicos: (I) Be2+ Li+ F- N3- , (II) Li+ Be2+ N3- F- ; b) Orde- ne de mayor a menor los radios de los elementos de que proceden. a) La secuencia “I” es la correcta, ya que a igualdad de electrones, y por tanto igual apantallamiento, el Be2+ tiene una mayor “Z” y por tanto una mayor ”Z* ” que el Li+ . Igualmente, el N3– tiene el mismo nº de electrones que el F– pero es mayor por tener una mayor ”Z* ” (mayor carga nuclear e igual apantallamiento). b) Li Be N F ya que, para el mismo periodo, el radio atómico disminuye hacia la derecha al haber una mayor ”Z* ” (aumenta más “Z” que “a” al ser el apantalla- miento de los e– de la última capa inferior a 1). ENERGÍA DE IONIZACIÓN (EI). También llamado potencial de ioniza- ción. “Es la energía necesaria para extraer un e– de un átomo neutro en estado gaseoso y formar un catión”. Es siempre positiva (proce- so endotérmico). Se habla de 1ª EI (EI1), 2ª EI (EI2),... según se trate del primer, segundo, ... e– extraído. La EI aumenta hacia arriba en los gru- pos al haber una mayor atracción por una “Z* ” parecida y una menor distancia de los electro hacia la derecha en los periodos por una mayor “Z http://www.puc.cl/sw_educ/qda1106/CAP2/2C/2C3/h nes externos al núcleo; también aumenta AFINIDAD ELECTRÓNICA (AE) * ” y un menor radio. La EI de los gases nobles al igual que la 2ª EI en los metales alcalinos es muy grande, pues se debe extraer un e– a átomos con configuración electrónica muy estable. “Es la energía intercambiada cuando un átomo gaseoso captura un e– y forma un anión Aumento en la Energía de ionización Haz clic en la imagen para verla ampliada ”. Es difícil de medir y se suele hacer por métodos indirectos. Puede ser positiva o F. Javier Gutiérrez Rodríguez Página 7 de 9
- 1623. Unidad 7: La tabla periódica. I.E.S. Clara Campoamor (Getafe) negativa aunque suele ser exotérmica. Al igual que con la energía de ionización, habla- mos de 1ª, 2ª,… AE. Es más negativa en los halógenos (crece en valor absoluto hacia la derecha del sis- tema periódico y en un mismo grupo hacia arriba) y suele ser positiva en gases nobles y metales alcalinotérreos. La 2ª y posteriores AE también suelen ser positivas, pues se trata de introducir un e– a un anión, lo que lógicamente está impedido por repulsión electrostática. ELECTRONEGATIVIDAD (F) Y CARÁCTER METÁLICO. Son conceptos opuestos (a mayor “F” menor carácter metálico y viceversa). La electronegatividad mide la tendencia de un átomo a atraer los e– de otros átomos a los que está enlazado. Es un compendio entre EI y AE. La electronegatividad aumenta hacia arri- ba en los grupos pues los e– son más atraídos por el núcleo a menores distancias y hacia la derecha en los periodos ya que hay mayor “Z* ” y una menor distancia. Pauling estableció una escala de electronegatividades entre 0,7 (Fr) y 4 (F). Aumento de la electronegatividad Aunque la Tabla Periódica se clasifica tradicionalmente en metales, no-metales y gases nobles, no existe una barrera clara entre las dos primeras clases, existiendo unos elementos llamados semimetales con características intermedias ya que la mayor o me- nor tendencia a perder o capturar electrones es gradual a lo largo de la tabla. Ejemplo (Selectividad. Madrid Previo 1998). Dados los elementos A y B de números atómicos 19 y 35 respectivamente: a) Establezca la configuración electrónica de cada uno de ellos. b) Indique su situación en el sistema periódico. c) Compare tres propiedades periódicas de ambos elementos. d) Justifique el tipo de enlace que producen al unirse. a) A (Z=19): 1s2 2s2 p6 3s2 p6 4s1 ; B (Z= 35): 1s2 2s2 p6 3s2 p6 d10 4s2 p5 b) A (4s1 ) Grupo 1 (alcalinos) Periodo 4 B (4s2 p5 ) Grupo 17 (halógenos) Periodo 4 c) Al estar en el mismo periodo sólo hay que ver la variación de izquierda a derecha: x Radio atómico : A B (el radio disminuye hacia la derecha) x EI: A B (la EI aumenta hacia la derecha) x F: A B (la F aumenta hacia la derecha) d) Al ser A un metal alcalino y B un no-metal halógeno formarán un enlace iónico ya que A tenderá a ceder el electrón 4s con facilidad (baja EI) y B tenderá a capturarlo (alta F): F. Javier Gutiérrez Rodríguez Página 8 de 9
- 1624. Unidad 7: La tabla periódica. I.E.S. Clara Campoamor (Getafe) A – 1 e– o A+ ; B + 1 e– o B – Ÿ Fórmula: AB (KBr) Ejercicio A (Selectividad. Madrid Previo 1997). Supuesto que se conocen los números cuánticos n, l y m, que definen el estado del último electrón que forma parte de la corteza de un elemento E. Razone si puede saber- se: a) Si será oxidante o reductor; b) Si es un metal o no metal; c) Si será muy electrone- gativo; d) Si su volumen atómico será elevado. ¼ Algunos enlaces interesantes:Algunos enlaces interesantes: x http://eos.cnice.mecd.es/mem2000/tablap/index.htm x http://eos.cnice.mecd.es/mem2002/quimica/ x www.adi.uam.es/docencia/elementos/link.html x www.educaplus.org/sp2002/ x www.geocities.com/erkflores/Tabla.htm x http://eros.pquim.unam.mx/~moreno/cap04a.htm#_Toc508460408 F. Javier Gutiérrez Rodríguez Página 9 de 9
- 1625. http://fisicayquimicaenflash.es Clasificación periódica de los elementos. Enlace químico Página 3/ 11 Potencial de ionización El potencial de ionización (I) es la energía que hay que suministrar a un átomo neutro, en su estado fundamental, perteneciente a un elemento en estado gaseoso, para arrancarle un electrón de la capa mas externa. La reacción puede expresarse de la siguiente forma: X + I ---- X+ + 1e- Su valor se expresa en eV/mol ó en J/mol y disminuye en el mismo grupo a medida que el electrón que va a ser arrancado está mas lejos del núcleo es decir hacia abajo. Por otra parte a medida que avanzamos en un periodo tendrá que aumentar puesto que la configuración electrónica es mas cercana a la de un gas noble. Si arrancamos un segundo electrón decimos que se trata del segundo potencial de ionización. Los potenciales mínimos de ionización corresponden a los alcalinos y los máximos a los gases nobles. Afinidad electrónica La afinidad electrónica (AE) es la cantidad de energía que libera o gana un átomo aislado en fase gaseosa cuando gana un electrón para formar un ion negativo. Si se libera esta energía en el proceso, la afinidad electrónica tendrá valor negativo. Así ocurre en la mayor parte de los elementos y a medida que nos movemos hacia la derecha en la tabla periódica esta se va haciendo más negativa mientras que se hace menor cuanto mayor sea el efecto de pantalla que ejercen los otros electrones (cuando descendemos en el mismo grupo. X + 1e- ----- X- + AE Su valor absoluto crece en la tabla periódica hacia la derecha con lo que los elementos con mayor afinidad electrónica son los halógenos. La animación ilustra la variación de la afinidad electrónica y del potencial de ionización:
- 1626. http://fisicayquimicaenflash.es Clasificación periódica de los elementos. Enlace químico Página 4/ 11 Electronegatividad La electronegatividad una medida de fuerza de atracción que ejerce un átomo sobre el par electrónico compartido en un enlace covalente. Su valor aumenta en la tabla periódica de izquierda a derecha y de abajo hacia arriba. Así como se puede observar los no metales tienen una electronegatividad alta mientras que los metales la tienen mas baja En general, los diferentes valores de electronegatividad de los átomos determinan el tipo de enlace que se formará en la molécula que los combina. Así, según la diferencia entre las electronegatividades de éstos se puede determinar (convencionalmente) si el enlace será, según la escala de Linus Pauling: • Iónico (diferencia superior o igual a 1.7) • Covalente (diferencia menor que 1,7)
- 1627. IVIVIVIV. ENLACES QUÍMICOS. ENLACES QUÍMICOS. ENLACES QUÍMICOS. ENLACES QUÍMICOS OBJETIVOOBJETIVOOBJETIVOOBJETIVO.- Identificar los tipos de enlace en la formación de moléculas relacionándolos con sus propiedades y las fuerzas que las unen. 1.1.1.1. CONCEPTO DE ENLACE QUÍMICOCONCEPTO DE ENLACE QUÍMICOCONCEPTO DE ENLACE QUÍMICOCONCEPTO DE ENLACE QUÍMICO Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre si, ceden, aceptan oceden, aceptan oceden, aceptan oceden, aceptan o comparten electrones. Son los electrones de valenciacomparten electrones. Son los electrones de valenciacomparten electrones. Son los electrones de valenciacomparten electrones. Son los electrones de valencia quienes determinan de que forma se unirá un átomo con otro y las características del enlace. 1.11.11.11.1. Regla del octeto.. Regla del octeto.. Regla del octeto.. Regla del octeto. El último grupo de la tabla periódica VIII A (18), que forma la familia de los gases nobles, son los elementos más estables de la tabla periódica. Esto se debe a que tienen 8 electrones en su capa más externa, excepto el Helio que tiene sólo 2 electrones, que también es una configuración estable. Los elementos al combinarse unos con otros, aceptan, ceden oLos elementos al combinarse unos con otros, aceptan, ceden oLos elementos al combinarse unos con otros, aceptan, ceden oLos elementos al combinarse unos con otros, aceptan, ceden o comparten electrones con la finalidad de tener 8 electrones en su nivelcomparten electrones con la finalidad de tener 8 electrones en su nivelcomparten electrones con la finalidad de tener 8 electrones en su nivelcomparten electrones con la finalidad de tener 8 electrones en su nivel más externomás externomás externomás externo (excepto los cuatros primeros elementos)(excepto los cuatros primeros elementos)(excepto los cuatros primeros elementos)(excepto los cuatros primeros elementos), esto es lo que, esto es lo que, esto es lo que, esto es lo que se conoce como lase conoce como lase conoce como lase conoce como la regla del ocregla del ocregla del ocregla del octetotetotetoteto. 1.2 Energía de ionización1.2 Energía de ionización1.2 Energía de ionización1.2 Energía de ionización La energía de ionizaciónenergía de ionizaciónenergía de ionizaciónenergía de ionización. es la cantidad de energía que se requiere para retirar el electrón más débilmente ligado al átomo. La energía de
- 1628. ionización en los periodos aumenta de izquierda a derecha y en los grupos, aumenta de abajo hacia arriba. Los metales tienen bajas energía de ionizaciónLos metales tienen bajas energía de ionizaciónLos metales tienen bajas energía de ionizaciónLos metales tienen bajas energía de ionización y fácilmente ceden sus electrones. En cambio, los no metales tienelos no metales tienelos no metales tienelos no metales tienennnn alta energíaalta energíaalta energíaalta energía de ionizaciónde ionizaciónde ionizaciónde ionización y difícilmente ceden sus electrones. 1.3 Afinidad1.3 Afinidad1.3 Afinidad1.3 Afinidad electrónicaelectrónicaelectrónicaelectrónica AFINIDAD ELECTRÓNICAAFINIDAD ELECTRÓNICAAFINIDAD ELECTRÓNICAAFINIDAD ELECTRÓNICA.- Cantidad de energía desprendida o absorbida cuando un átomo gana un electrón adicional. Es la tendencia de los átomos a ganar electrones. La afinidad electrónica aumenta en los periodos de izquierda a derecha, y en los grupos de abajo hacia arriba. En la siguiente tabla se muestran las variaciones de esas dos propiedades 2222. ENLACE IÓNICO. ENLACE IÓNICO. ENLACE IÓNICO. ENLACE IÓNICO 2.12.12.12.1 CaracterísticasCaracterísticasCaracterísticasCaracterísticas: 7 Está formado por metal y no metal ENERGÍA DE IONIZACIÓNENERGÍA DE IONIZACIÓNENERGÍA DE IONIZACIÓNENERGÍA DE IONIZACIÓN AFINIDAD ELECTRÓNICAAFINIDAD ELECTRÓNICAAFINIDAD ELECTRÓNICAAFINIDAD ELECTRÓNICA
- 1629. 7 No forma moléculas verdaderas, existe como un agregado de aniones (iones negativos) y cationes (iones positivos). 7 Los metales ceden electronesmetales ceden electronesmetales ceden electronesmetales ceden electrones formando cationescationescationescationes, los no metalesmetalesmetalesmetales aceptanaceptanaceptanaceptan electroneselectroneselectroneselectrones formando anionesanionesanionesaniones. 2.2 Formación2.2 Formación2.2 Formación2.2 Formación ddddeeee eeeenlacesnlacesnlacesnlaces iiiiónicosónicosónicosónicos Ejm: NaF Na: metalmetalmetalmetal del grupo IA ENLACE IÓNICOENLACE IÓNICOENLACE IÓNICOENLACE IÓNICO F: no metalno metalno metalno metal del grupo VIIA Para explicar la formación del enlace escribimos la configuración electrónica de cada átomo: 11Na: 1s2 , 2s2 , 2p6 , 3s1 Electrones de valencia = 1 9F: 1s2 , 2s2 , 2p5 Electrones de valencia = 5 +2 = 7 Si el sodio pierde el electrón de valencia, su último nivel sería el 2, y en éste tendría 8 electrones de valencia, formándose un catión (ión positivo) Na1+ . El flúor con 7 electrones de valencia, solo necesita uno para completar su octeto, si acepta el electrón que cede el sodio se forma un anión (ion negativo) F1- . Esta transferencia de electrones entre el sodio y el flúor, permite que ambos elementos tengan 8 electrones en su nivel más externo. La estructura de Lewis del compuesto se representa de la siguiente forma:
- 1630. Como el catión es quien cede los electrones, éstos no se indican. Pero en el anión si ya que está ganando electrones. Se representa con rojo el electrón que ganó el flúor, completando así su octeto. Otro ejemplo: MgBr2 Mg: metalmetalmetalmetal del grupo II A Br: no metalno metalno metalno metal del grupo VIIA METAL + NO METALMETAL + NO METALMETAL + NO METALMETAL + NO METAL IÓNICOIÓNICOIÓNICOIÓNICO No es necesario hacer la configuración sino solo la estructura de Lewis de cada elemento. Recuerde, el número de grupo en romano, para los representativos, indica el número de electrones de valencia. Nosotros solo usaremos compuestos formados por elementos representativos.
- 1631. El átomo de Mg pierde sus 2 e- de valencia, y cada Br acepta uno para completar el octeto. Los átomos de Br completan su octeto gracias a uno de los dos electrones cedidos por el Mg, el cual también queda con 8 electrones en un nivel más bajo. EJERCICIO 8EJERCICIO 8EJERCICIO 8EJERCICIO 8 Dibuje la estructura de Lewis para los siguientes compuestos indicando el tipo de enlace. Señale catión y anión. a) K2S b) Cs2O c) Ca,2 d) Al2O3 Conociendo los principios del enlace iónico, podemos proponer un tipo de ejercicio diferente. Observe el ejemplo. 9 Para los elementos K y O,: a) Indique el tipo de enlace. b) Escriba la fórmula del compuesto c) Dibuje la estructura de Lewis del compuesto. CATIÓN ANIÓN ANIÓN
- 1632. K.K.K.K. MetalMetalMetalMetal del grupo IAdel grupo IAdel grupo IAdel grupo IA O:O:O:O: No metalNo metalNo metalNo metal del grupo VIAdel grupo VIAdel grupo VIAdel grupo VIA Cuando un metal pierde sus electrones de valencia, pierde un nivel, y su nivel anterior siempre está lleno, por lo que queda con un nivel más bajo pero completo el octeto. Por tanto, si el potasio puede ceder ese electrón, tendrá su octeto completo. El oxígeno en cambio, le faltan dos electrones para completar el octeto, pero el potasio solo pude dar uno ¿cuántos átomos de cada elemento deben combinarse? La respuesta es dos de potasio y uno de oxígeno, de esta manera cada átomo de potasio cederá uno de los electrones que necesita el oxígeno, por tanto la fórmula del compuesto es b) K2O (óxido de potasio) c) Estructura de Lewis Recuerde que el número de electrones cedidos debe ser igualRecuerde que el número de electrones cedidos debe ser igualRecuerde que el número de electrones cedidos debe ser igualRecuerde que el número de electrones cedidos debe ser igual que número de electrones que se aceptan.que número de electrones que se aceptan.que número de electrones que se aceptan.que número de electrones que se aceptan. ENLACE IÓNICO
- 1633. EJERCICIO 9EJERCICIO 9EJERCICIO 9EJERCICIO 9 Para los pares de elementos: a) Indique el tipo de enlace. b) Escriba la fórmula del compuesto c) Dibuje la estructura de Lewis del compuesto 1) Sr, Cl 2) S y Ga 3) CsI Recuerde que la fórmula de un compuesto que tiene un metal, se inicia con el símbolo del metal. 2.3 Propiedades de los compuestos iónicos2.3 Propiedades de los compuestos iónicos2.3 Propiedades de los compuestos iónicos2.3 Propiedades de los compuestos iónicos Los compuestos formados por enlaces iónicos tienen las siguientes características: … Son sólidos a temperatura ambiente, ninguno es un líquido o un gas.. * Tienen altos puntos de fusión y ebullición. * Son solubles en solventes polares como el agua. * En disolución acuosa, son buenos conductores de la corriente eléctrica.
- 1634. Burns, Ralph. Fundamentos de Química. 2ª Edición, México, Prentice Hall, 1996. . 3.3.3.3.---- ENLACE COVALENTEENLACE COVALENTEENLACE COVALENTEENLACE COVALENTE Burns, Ralph. Fundamentos de Química. 2ª Edición, México, Prentice Hall, 1996. . Disposición de los iones en un cristal de cloruro de sodio. Modelo de esferas y varillas de un cristal de cloruro de sodio. El diámetro de un ion cloruro es alrededor del doble del de un ion sodio.
- 1635. 3.1 Características3.1 Características3.1 Características3.1 Características ::::del enlace covalente.del enlace covalente.del enlace covalente.del enlace covalente. 7 Está basado en la compartición de electrones. Los átomos no ganan ni pierden electrones, COMPARTEN. 7 Está formado por elementos no metálicos. Pueden ser 2 o 3 no metales. 7 Pueden estar unidos por enlaces sencillos, dobles o triples, dependiendo del compuestos que se forma. 3.23.23.23.2 Formación de enlaces covalentesFormación de enlaces covalentesFormación de enlaces covalentesFormación de enlaces covalentes Ejemplificaremos, con elementos que existen como moléculas diatómicas. Cl2, cloro molecular, formado por dos átomos de cloro. Como es un no metal, sus átomos se unen por enlaces covalentes. El cloro es un elemento del grupo VII A. El átomo de cloro sólo necesita un electrón para completar su octeto. Al unirse con otro átomo de cloro ambos comparten su electrón desapareado y se forma un enlace covalente sencillo entre ellos.
- 1636. Este enlace se representa mediante una línea entre los dos átomos. La línea roja representa un enlace covalente sencilloun enlace covalente sencilloun enlace covalente sencilloun enlace covalente sencillo, formadoformadoformadoformado por dos electronespor dos electronespor dos electronespor dos electrones. Estos electrones se comparten por igual por ambos átomos. O2 La molécula de oxígeno también es diatómica. Por ser del grupo VIA la estructura de Lewis del oxígeno es: Al oxígeno le hacen falta dos electrones para completar su octeto. Cada oxígeno dispone de 6 electrones, con los cuales ambos deben tener al final ocho electrones. Por lo tanto el total de electrones disponibles es: 2 x 6 e- = 12 e- menos dos que se ocupan para el enlace inicial restan 10. Estos 10 e---- se colocan por pares al azar entre los dos átomos. ........ Ahora revisamos cuántos electrones tiene cada átomo alrededor. Observamos que el oxígeno de la derecha está completo, mientras que el de la izquierda tiene solo seis. Recuerde que el enlace indicado con la línea, cuenta como 2 para ambos átomos. Entonces uno de los
- 1637. pares que rodean al oxígeno de la derecha, se coloca entre los dos átomos formándose un doble enlace, y de esa forma los dos quedan con 8 electrones. La molécula queda formada por un enlace covalente dobleun enlace covalente dobleun enlace covalente dobleun enlace covalente doble,,,, 2222 pares depares depares depares de electroneselectroneselectroneselectrones compartidoscompartidoscompartidoscompartidos y 4 pares de electrones noy 4 pares de electrones noy 4 pares de electrones noy 4 pares de electrones no enlazados.enlazados.enlazados.enlazados. N2 El nitrógeno, otra molécula diatómica, está ubicado en el grupo VA, por lo tanto cada nitrógeno aporta 5 electrones x 2 átomos = 10 electrones, menos los dos del enlace inicial son un total de 8 electrones. Ambos átomos están rodeados por solo 6 electrones, por lo tanto, cada uno de ellos compartirá uno de sus pares con el otro átomo formándose un triple enlacetriple enlacetriple enlacetriple enlace.
- 1638. La molécula queda formada por un enlace covalente tripleun enlace covalente tripleun enlace covalente tripleun enlace covalente triple, 3 pares3 pares3 pares3 pares dededede electrones enlazados y dos pares de electrones no enlazadoselectrones enlazados y dos pares de electrones no enlazadoselectrones enlazados y dos pares de electrones no enlazadoselectrones enlazados y dos pares de electrones no enlazados. En los compuestos covalentes formados por 3 elementos o más, siempre debe seleccionarse un átomo como central para hacer el esqueleto básico del compuesto. Para esto se siguen las siguientes reglas: 7 El átomo central es de un elemento unitario (o sea que solo hay un átomo de ese elemento en la molécula). 7 El oxígeno y el hidrógeno no pueden ser átomos centrales. 7 El carbono tiene preferencia como átomo central sobre el resto de los elementos. 7 En compuestos que contengan oxígeno e hidrógeno en la misma molécula, el hidrógeno nunca se enlaza al átomo central, sino que se enlaza al oxígeno, por ser éste el segundo elemento más electronegativo. 7 El hidrógeno no cumple la regla del octeto, sino que es estable al lograr la configuración del gas noble helio con 2 electrones en su último nivel. 7 Los átomos deben acomodarse de tal forma que la molécula resulte lo más simétrica posible.
- 1639. Ejemplos: CO2 (dióxido de carbono) TRES ÁTOMOS NO METÁLICOS COVALENTE Las estructuras de Lewis del carbono y el oxígeno son: El carbono es un elemento muy especial, y sus característica han demostrada que acomoda sus electrones de valencia de la manera indicada. Total de electrones de valencia: C 1 x 4 electrones = 4 electrones O 2 x 6 electrones = 12 electrones + 16161616 electrones El carbono es el átomo central, por lo que se gastan cuatro electrones, y los 12 restantes se acomodan en pares al azar.
- 1640. En esta estructura sólo el carbono ha completado su octeto, entonces los pares no enlazantes del carbono, son los que deben compartirse con cada oxígeno para que éstos también completen su octeto. La estructura final sería: La estructura está formada por 2 enlaces covalentes dobles, 4 pares de electrones no enlazantes y 4 pares enlazados. HNO3 (ácido nítrico) H, N y O son tres no metalesno metalesno metalesno metales entonces el tipo de enlace es covalentecovalentecovalentecovalente. Las estructuras de Lewis son: Electrones de valencia totales: H 1 x 1e- = 1 N 1 x 5 e- = 5 O 3 x 6 e- = 18 + 24 electrones de valencia totales
- 1641. El nitrógeno es el átomo central, por lo que se ocupan tres enlaces covalentes para enlazar los oxígenos y uno más para enlazar el hidrógeno a uno de los oxígenos. Recuerde que una de las reglas establece que: 7 En compuestos que contengan oxígeno e hidrógeno en la misma molécula, el hidrógeno nunca se enlaza al átomo central, sino que se enlaza al oxígeno, por ser éste el segundo elemento más electronegativo. Se selecciona el oxígeno que está abajo porque de esta forma la molécula es más simétrica. Son cuatro enlaces covalentes, por tanto a los 24 total le restamos 8 y resultan 16 electrones16 electrones16 electrones16 electrones que se acomodan por pares en forma aleatoria en los oxígenos y el nitrógeno. Recuerde que el hidrógeno se completa con 2 electrones, porque adquiere la estructura estable del primero de los gases nobles, el helio.
- 1642. Los oxígenos laterales están completos, el nitrógeno y el hidrógeno también. Lo lógico sería pensar que el nitrógeno coloque su par no enlazante de tal forma que se complete el octeto del oxígeno, pero ESTOESTOESTOESTO NO ES CORRECTONO ES CORRECTONO ES CORRECTONO ES CORRECTO,,,, PORQUE EL OXÍGENO SOLOPORQUE EL OXÍGENO SOLOPORQUE EL OXÍGENO SOLOPORQUE EL OXÍGENO SOLO PUEDE FORMAPUEDE FORMAPUEDE FORMAPUEDE FORMARRRR 2 ENLACES, Y DE ESA MANERA TENDRÍA2 ENLACES, Y DE ESA MANERA TENDRÍA2 ENLACES, Y DE ESA MANERA TENDRÍA2 ENLACES, Y DE ESA MANERA TENDRÍA TRESTRESTRESTRES.. Así como el carbono forma máximo 4 enlaces, el nitrógeno forma 3 y el oxígeno solo forma 2 por lo tanto, ese doble enlace que necesita la estructura debe estar entre el nitrógeno y uno de los oxígenos laterales: Es cierto que la estructura no tiene simetría, pero no hay otra forma de acomodarla y esta es la correcta.
- 1643. Por tanto la estructura de HNO3 tiene: 4 enlaces covalentes, 3 sencillos y uno doble 5 pares de electrones enlazados 14 electrones no enlazados (7 pares) Para comprobar que sus respuestas son lógicas los electroneslos electroneslos electroneslos electrones enlazados + los no enlazadosenlazados + los no enlazadosenlazados + los no enlazadosenlazados + los no enlazados = electrones totales de valenc= electrones totales de valenc= electrones totales de valenc= electrones totales de valencia. SO3 (trióxido de azufre) Electrones de valencia: S 1 x 6 e- = 6 O: 3 x 6 e- = 18 + 24 24 – 6 = 18 electrones colocados al azar. Uno de los electrones enlazados está incompleto. El azufre coloca su par no enlazante con ese oxígeno.
- 1644. La estructura tiene: 3 enlaces covalentes, uno doble y dos sencillos. 8 electrones compartidos (4 pares) 16 electrones no enlazados (8 pares) EJERCICIO #EJERCICIO #EJERCICIO #EJERCICIO # 9999....---- Dibuje la estructura de Lewis de los siguientes compuesto e indique: a) Número total de electrones de valencia. b) Número de electrones no enlazados. c) Número de electrones enlazados d) Número y tipo de enlaces formados. 1) HCN, 2) SO2, 3) H2CO3 4) H2SO4 5) HIO2
- 1645. TARETARETARETAREAAAA # 1# 1# 1# 13333 Para los siguientes compuestos, indique el tipo de enlace y dibuje la estructura de Lewis. De acuerdo al tipo de enlace señale la información solicitada en el recuadro. ENLACE IÓNICOENLACE IÓNICOENLACE IÓNICOENLACE IÓNICO ENLACE COVALENTEENLACE COVALENTEENLACE COVALENTEENLACE COVALENTE a) Catión b) Anión a) Número total de electrones de valencia. b) Número y tipo de enlaces. c) Números de electrones enlazados. d) Números de electrones no enlazados. 1) SiO2 2) H3PO4 3) Al2O3 4) MgO 5) HNO3 6) H2SiO3 7) K2Se 9)CaBr2 10) HCN Entregue su tarea en hojas blancas tamaño carta, en la clase indicada por su profesor. 3.3 Propiedades de los compuestos covalentes3.3 Propiedades de los compuestos covalentes3.3 Propiedades de los compuestos covalentes3.3 Propiedades de los compuestos covalentes Las características de los compuestos unidos por enlaces covalentes son: * Los compuestos covalentes pueden presentarse en cualquier estado de la materia: sólido, líquido o gaseoso. * Sus disoluciones no conducen la corriente eléctrica..
- 1646. … Son solubles en solventes no polares como benceno, tetracloruro de carbono, etc., e insolubles en solventes polares como el agua … En términos generales, tienen bajos puntos de fusión y de ebullición. … Son aislantes del calor y la electricidad. 3.43.43.43.4 TTTTipos de enlaces covalentesipos de enlaces covalentesipos de enlaces covalentesipos de enlaces covalentes4444 3.4.1 Electronegatividad3.4.1 Electronegatividad3.4.1 Electronegatividad3.4.1 Electronegatividad La electronegatividad es una medida de la tendencia quetendencia quetendencia quetendencia que muestra un átomo, a atraer hacia si los electrones.muestra un átomo, a atraer hacia si los electrones.muestra un átomo, a atraer hacia si los electrones.muestra un átomo, a atraer hacia si los electrones. La electronegatividad aumenta en los periodos de izquierda a derecha y en los grupos de abajo hacia arriba, tal y como sucede con la afinidad electrónica y al energía de ionización. Linus Pauling, fue el primer químico que desarrolló una escala numérica de electronegatividad. En su escala, se asigna al flúor, el elemento más electronegativo, el valor de 4. El oxígeno es el segundo, seguido del cloro y el nitrógeno. A continuación se muestra los valores de electronegatividad de los elementos. Observe que no se reporta valor par los gases nobles por ser los elementos menos reactivos de la tabla periódica.
- 1647. 3.4.2 Enlace polar y no polar3.4.2 Enlace polar y no polar3.4.2 Enlace polar y no polar3.4.2 Enlace polar y no polar La diferencia en los valores de electronegatividad determina la polaridad de un enlace. Cuando se enlazan dos átomos iguales, con la misma electronegatividad, la diferencia es cero, y el enlace es covalente no polar, ya que los electrones son atraídos por igual por ambos átomos.
- 1648. El criterio que se sigue para determinar el tipo de enlace a partir de la diferencia de electronegativad, en términos, generales es el siguiente: DiDiDiDiferencia deferencia deferencia deferencia de electronegatividadelectronegatividadelectronegatividadelectronegatividad Tipos de enlaceTipos de enlaceTipos de enlaceTipos de enlace Menor o igual a 0.4 Covalente no polar De 0.5 a 1.7 Covalente polar Mayor de 1.7 Iónico Casi todos los compuestos que contienen enlaces covalente polares; quedan comprendidos entre los extremos de lo covalente no polar y lo iónico puro. Por tanto, en el enlace covalente polar los electrones se compartenen el enlace covalente polar los electrones se compartenen el enlace covalente polar los electrones se compartenen el enlace covalente polar los electrones se comparten de manera desigualde manera desigualde manera desigualde manera desigual, lo cual da por resultado que un extremo de la molécula sea parcialmente positivo y el otro parcialmente negativo. Esto se indica con la letra griega delta (δ). Ejemplo: La molécula de HCl. ÁtomosÁtomosÁtomosÁtomos ElectronegatividadElectronegatividadElectronegatividadElectronegatividad Diferencia deDiferencia deDiferencia deDiferencia de electronegatividadelectronegatividadelectronegatividadelectronegatividad HHHH 2.12.12.12.1 ClClClCl 3.03.03.03.0 3.03.03.03.0 –––– 2.12.12.12.1 0.90.90.90.9 Tipo de enlaceTipo de enlaceTipo de enlaceTipo de enlace COVALENTE POLARCOVALENTE POLARCOVALENTE POLARCOVALENTE POLAR
- 1649. δ + δ − H Cl El átomo más electronegativo, en éste caso es el cloro, que adquiere la carga parcial negativa, y el menos electronegativo, es el hidrógeno que adquiere la carga parcial positiva. Ejemplo: De acuerdo a la diferencia de electronegatividad, clasifique los siguientes enlaces como polar, no polar o iónico. EnlaceEnlaceEnlaceEnlace ElectronegatividadesElectronegatividadesElectronegatividadesElectronegatividades Diferencia deDiferencia deDiferencia deDiferencia de electronegatividadelectronegatividadelectronegatividadelectronegatividad Tipo de enlaceTipo de enlaceTipo de enlaceTipo de enlace N - O 3.0 3.5 3.5 -3.0 = 0.5 Polar Na - Cl 0.9 3.0 3.0 - 0.9 = 2.1 Iónico H - P 2.1 2.1 2.1 - 2.1 = 0 No polar As -O 2.0 3.5 3.5 - 2.0 = 1.5 Polar Observe que al obtener la diferencia, siempre es el mayor menos el menor ya que no tendría sentido una diferencia de electronegatividad negativa.
- 1650. TAREA # 14TAREA # 14TAREA # 14TAREA # 14 De acuerdo a la diferencia de electronegatividad, clasifique los siguientes enlaces como polar, no polar o iónico. EnlaceEnlaceEnlaceEnlace ElectronegatividadesElectronegatividadesElectronegatividadesElectronegatividades Diferencia deDiferencia deDiferencia deDiferencia de electronegatividadelectronegatividadelectronegatividadelectronegatividad Tipo de enlaceTipo de enlaceTipo de enlaceTipo de enlace NNNN––––HHHH PPPP––––HHHH LiLiLiLi––––ClClClCl CaCaCaCa––––SSSS CCCC––––OOOO SSSS––––OOOO Envíe su tarea al correo electrónico del profesor. 3.4.33.4.33.4.33.4.3 Enlace covalente coordinadoEnlace covalente coordinadoEnlace covalente coordinadoEnlace covalente coordinado.- En este tipo de enlace el átomo menos electronegativo aporta los dos electrones que forma el enlace. Ejemplo: Realizamos la estructura de Lewis del H2SO4 formado por tres no metales y por tanto un compuesto covalente.
- 1651. Electrones totales: H 2 x 1e- = 2 S 1 x 6e- = 6 O 4 x 61e- = 24 + 32 electrones totales Ahora haremos la estructura indicando los electrones que cada átomo aporta: Se han utilizado 12 electrones, por tanto quedan 32-12 = 20 electrones que deben acomodarse por pares en los oxígenos.
- 1652. Observe la estructura con atención. El oxígeno de arriba y el de abajo aparecen con 7 puntitos rojos (electrones del oxígeno) siendo que el oxígeno solo tiene seis, mientras que el azufre aparece con solo 4 puntos azules (4 electrones) siendo que también tiene seis. En un enlace covalente no se pierden ni se ganan electrones, solo se comparten y se acomodan de la forma más conveniente, por lo tanto, la estructural real es: La estructura muestra dos enlaces covalentes coordinados y 4 enlaces que no lo son porque cada átomo aportó un electrón al enlace. Un enlace covalente coordinado en nada se puede distinguir de un covalente típico, ya que las características del enlace no se modifican. 4. ENLACE METÁLI4. ENLACE METÁLI4. ENLACE METÁLI4. ENLACE METÁLICOCOCOCO 4.1 Los electrones libres y la energía de ionización4.1 Los electrones libres y la energía de ionización4.1 Los electrones libres y la energía de ionización4.1 Los electrones libres y la energía de ionización Muchas veces hemos observando un fenómeno conocido como corrosión, que es la conversión de un metal en un compuesto metálico por una reacción entre el metal y alguna sustancia del ambiente.
- 1653. Cuando un ion, átomo o molécula incrementa su carga positiva decimos que se oxida, pierde electrones. Los metales tienden a tener energía de ionización bajas y por tanto se oxidan (pierden electrones) cuando sufren reacciones químicas). Los enlaces metálicos se encuentran en metales sólidos como el cobre, hierro y aluminio. En los metales, cada átomo metálico está unido a varios átomos vecinos. Los electrones de enlace tienen relativa libertad para moverse a través de toda la estructura tridimensional. Los enlaces metálicos dan lugar a las propiedades características de los metales. Hoy se acepta que el enlace metálico no es precisamente entre átomos, sino un enlace entre cationes metálicos y sus electrones. El modelo más sencillo para explicar este tipo de enlace propone un ordenamiento de cationes en un “mar” de electrones de valencia. 4.2 Propiedades de los metales en función4.2 Propiedades de los metales en función4.2 Propiedades de los metales en función4.2 Propiedades de los metales en función ddddel enlace metálicoel enlace metálicoel enlace metálicoel enlace metálico Conductividad eléctricaConductividad eléctricaConductividad eléctricaConductividad eléctrica.- Para explicar la conductividad eléctrica, se utiliza un modelo propuesto por Drude conocido como el modelo delmodelo delmodelo delmodelo del gas de electronesgas de electronesgas de electronesgas de electrones. En este modelo se considera que los electrones más alejados del núcleo están desdesdesdes localizadoslocalizadoslocalizadoslocalizados, es decir, que se mueven libremente, por lo que pueden hacerlo con rapidez, lo que permite el paso de la corriente eléctrica. MaleabilidadMaleabilidadMaleabilidadMaleabilidad y ductibilidady ductibilidady ductibilidady ductibilidad.- Estas propiedades se deben a que las distancias que existen entre los átomos son grandes; al golpear un metal, las capas de átomos se deslizan fácilmente permitiendo la deformación del metal, por lo que pueden laminarse o estirase como hilos.
- 1654. 5. FUERZAS INTERMOLECULARES5. FUERZAS INTERMOLECULARES5. FUERZAS INTERMOLECULARES5. FUERZAS INTERMOLECULARES En los líquidos y en los sólidos, podemos distinguir tres tipos de fuerzas: ¾ Interiónicas ¾ Intramoleculcares ¾ Intermoleculares Fuerzas inteFuerzas inteFuerzas inteFuerzas interrrriónicasiónicasiónicasiónicas.- Son las que se dan entre iones.. Son las más intensas ya que son de tipo electrostático, aniones y cationes que se atraen entre sí. A esto se deben los altos puntos de fusión de los compuestos iónicos. Fuerzas intramolecularesFuerzas intramolecularesFuerzas intramolecularesFuerzas intramoleculares.- Son las que existen entre los átomos que forman una molécula. Fuerzas intermolecularesFuerzas intermolecularesFuerzas intermolecularesFuerzas intermoleculares.- Son mucho más débiles que las intramoleculares. Son las fuerzas que unen a las moléculas. También se conocen como fuerzas de van de Waals, en honor al físico
- 1655. holandés Johannes van der Waals, porque fue el primero en poner de relieve su importancia. Las fuerzas intermoleculares en orden decreciente de intensidad son: X Puentes de hidrógeno X Fuerzas dipolares X Fuerzas de London 5.1 Dipolos inducidos y dipolos instantáneos5.1 Dipolos inducidos y dipolos instantáneos5.1 Dipolos inducidos y dipolos instantáneos5.1 Dipolos inducidos y dipolos instantáneos Las moléculas polares, que tienen centros separados de carga no equilibrados, reciben el nombre de dipolos. Si estos dipolos se acercan, el extremo positivo de una molécula atrae al extremo negativo de otra. Estas fuerzas bipolares pueden estar presenta en toda la estructura de un líquido o un sólido. En general las fuerzas entre dipolos son más débiles que las que se ejercen entre iones, pero más intensas que las de moléculas no polares de tamaño comparable. La formación de dipolos instantáneos es una característica de la fuerzas de dispersión o de London y se analizarán en ese punto. 5.2 Puentes de hidrógeno5.2 Puentes de hidrógeno5.2 Puentes de hidrógeno5.2 Puentes de hidrógeno Son un tipo de fuerzas que se presentan en molécula polares que contienen átomos de hidrógeno unidos a flúor, oxígeno o nitrógeno. Estás fuerzas son más intensas que las atracciones dipolo- dipolo.
- 1656. a) Caraca) Caraca) Caraca) Características del aguaterísticas del aguaterísticas del aguaterísticas del agua....---- Las moléculas de agua están unidas por puentes de hidrógeno y es precisamente este tipo de fuerza intermolecular la que da al agua ciertas características especiales. En la siguiente estructura de Lewis se indica en forma punteada en color rojo el puente de hidrógeno. El modelo en barras y esferas Las líneas azules son enlaces covalentes, y la línea punteada roja es un puente de hidrógeno. Éste último es más débil que un enlace covalente. Para pasar del estado sólido al líquido debe suministrarse energía para vencer la fuerza de atracción entre las moléculas. Los puentes de hidrógeno son fuerzas intermoleculares fuertes, por lo que ha medida que el hielo empieza a fundirse a 0°C, algunos de los
- 1657. puentes de hidrógeno se rompen, pero no todos. El requerimiento de energía es mayor que en aquellos compuestos donde no hay puentes de hidrógeno, sino otro de tipos fuerzas intramoleculares, lo cual explica el elevado punto de fusión del agua. Si elevamos la temperatura del agua líquida a 100°C, disminuye la cantidad de puentes de hidrógeno. Al cambiar su estado de líquido a gaseosos, casi todos los puentes de hidrógeno se rompen. La cantidad de energía para lograr este rompimiento, es mayor que la cantidad de energía requerida por sustancias que no tienen este tipo de enlace entre sus moléculas. Esto explica el elevado punto de ebullición del agua. Las moléculas de los sólidos siempre están más cercanas que en los líquidos, pero al enfriarse el agua la formación de puentes de hidrógeno entre sus moléculas, da como resultado una estructura con gran cantidad de espació vacío que es la estructura del hielo. (Insertar figura 13.8 Seese-Daub página 343) Esta es la razón por la que la densidad del agua sólida es menor que el agua líquido, lo cual es muy conveniente para la conservación de los ecosistemas acuáticos. Si el hielo no flotara sobre el agua se hundiría, y los lagos y mares se congelarían de abajo hacia arriba y ningún ser vivo podría permanecer en esas condiciones.
- 1658. I.E.S. “Al-Ándalus”. Dpto. de Física y Química. F.Q. 1º Bachillerato Tema 4. Reacciones químicas - 1 - TEMA 4. REACCIONES QUÍMICAS 4.1 Concepto de reacción química: reactivos y productos. Ecuaciones químicas. 4.2 Estequiometría 4.3 Intercambios energéticos en las reacciones químicas. Entalpías de formación y de reacción. Ley de Hess. 4.4 Estudio de algunos tipos de reacciones químicas. 4.5 Importancia de las reacciones químicas en la naturaleza y la sociedad. 4.1. CONCEPTO DE REACCIÓN QUÍMICA: REACTIVOS Y PRODUCTOS. ECUACIONES QUÍMICAS. Constantemente observamos cómo en la naturaleza y en nuestra vida cotidiana se producen cambios. Un charco se seca, un cubito de hielo se derrite, un trozo de hierro se oxida con el tiempo, los alimentos cambian al ser cocinados, las plantas y los animales crecen, unas sustancias se mezclan con otras; podemos incluso separar mezclas de sustancias. Hay cambios en los que las sustancias siguen siendo las mismas, sólo cambia su aspecto, o su estado de agregación. Los cambios de estado (sólido, líquido, gas), las mezclas de sustancias, o la separación de mezclas, son de este tipo. Como la sustancia sigue siendo la misma, también las moléculas son las mismas, sólo cambia la unión entre ellas. A este tipo de cambios se les llama cambios físicos. En otros cambios, sin embargo, no sólo se modifica el aspecto. Las sustancias que tenemos después del cambio son otras de las que teníamos antes de que se produjera. Vemos que, a partir de dos sustancias, se han producido otras dos distintas. Las sustancias han cambiado, y por lo tanto también sus propiedades. A este tipo de transformación se le denomina cambio químico, o también reacción química. En toda reacción química, a la sustancia o sustancias iniciales se les llama reactivos. Las sustancias nuevas que se forman, son los productos de la reacción. La reacción química se escribe de esta forma: REACTIVOS Æ PRODUCTOS ¿Cómo puede ser posible que, a partir de unas sustancias, puedan formarse otras con propiedades muy diferentes? La razón está en las moléculas. Al formarse sustancias diferentes, las moléculas de las nuevas sustancias también deben ser diferentes a las que teníamos al principio. Las moléculas han cambiado. ¿Cómo pueden transformarse unas moléculas en otras diferentes? Pues modificando su estructura atómica. En la reacción, las moléculas de las distintas sustancias chocan unas con otras. Al chocar, los átomos se separan y posteriormente se vuelven a unir de forma diferente, dando lugar a moléculas distintas a las que teníamos al principio. Como consecuencia, las sustancias cambian y sus propiedades también. Ecuaciones químicas: Una reacción química se expresa mediante una ecuación química. En La ecuación aparecen: - Fórmulas de reactivos y productos. - Estado de agregación de las sustancias que intervienen en la reacción: (s): sólido, (l): líquido, (g): gas , (ac): disolución acuosa. - Una flecha que indica el sentido en el que se da la reacción. - Coeficientes estequiométricos, que indican la proporción en que reaccionan o se producen las moléculas de las sustancias que intervienen en la reacción. Ejemplo: 2 H2O (l) Æ 2 H2 (g) + O2 (g) Ajuste de una reacción: Ajustar la ecuación química consiste en colocar los coeficientes (nº de moléculas) necesarios para que el número total de átomos de cada elemento sea el mismo en cada miembro de la ecuación. Hay que recordar que la reacción
- 1659. I.E.S. “Al-Ándalus”. Dpto. de Física y Química. F.Q. 1º Bachillerato Tema 4. Reacciones químicas - 2 - se produce entre moléculas, no entre átomos individuales, por lo que las fórmulas químicas no podemos modificarlas, ni añadir átomos sueltos. La forma más sencilla de ajustar una ecuación es por tanteo. Comenzaremos ajustando normalmente átomos de metales, o elementos que aparezcan una única vez en cada miembro de la ecuación. Continuaremos uno a uno con los siguientes elementos, dejando como norma habitual las sustancias simples para el final (si en la reacción interviene oxígeno, casi siempre será el último elemento en ser ajustado). Es posible que, durante el tanteo, tengamos que modificar alguno de los coeficientes que habíamos colocado previamente. Es algo normal, pero habrá que tener cuidado de hacer esa modificación en ambos miembros de la ecuación. La reacción la tendremos ajustada cuando comprobemos que existe el mismo número de átomos de cada elemento en ambos lados. Puede ocurrir que aparezcan coeficientes fraccionarios (1/2, 1/3...). Ejemplo: 2 1 N2 (g) + 2 3 H2 (g) Æ NH3 (g) Parece imposible que reaccione media molécula, pero pensemos que los coeficientes indican proporción entre moléculas (en realidad, reacciona un número de moléculas del orden de NA= 6,02 ·1023 ). En el ejemplo anterior, lo que ocurre es que de hidrógeno reaccionan el triple de moléculas que de nitrógeno, y de amoniaco se forman el doble de las que han reaccionado de hidrógeno. Podemos deshacernos de las fracciones multiplicando todos los coeficientes de la ecuación por un mismo número, de forma que queden enteros. En el ejemplo: 2 ·( 2 1 N2 (g) + 2 3 H2 (g) Æ NH3 (g) ) Æ N2 (g) + 3 H2 (g) Æ 2 NH3 (g) Importante: Estamos viendo que los coeficientes nos indican proporción entre moléculas. Por lo tanto, también será una proporción entre número de moles de cada sustancia. NUNCA será una proporción entre masas (g). Símbolos especiales: oPt Reacción que se produce en presencia de un catalizador (platino en este caso). ( n ) Producto gaseoso que se desprende. (p ) Producto sólido que precipita. ( œ ) Reacción reversible. Reacciones reversibles: equilibrio químico. En la ecuación química, la flecha nos indica el sentido en el que se da la reacción (reactivos que se consumen, dando lugar a productos). Sin embargo, en muchas reacciones, los productos vuelven a reaccionar entre ellos para volver a dar los reactivos iniciales (la reacción se da también en el sentido inverso, aunque a un ritmo más lento). Se dice entonces que la reacción es reversible. Se usará para distinguirlas una flecha doble ( œ ) El ritmo, la velocidad a la que se da la reacción, depende de la cantidad de sustancias que tengamos. Los reactivos, al irse consumiendo, reaccionan cada vez más lentamente, mientras que los productos, al volver a reaccionar en sentido inverso, cada vez lo hacen más rápidamente. Se llegará a un equilibrio cuando ambas reacciones se produzcan al mismo ritmo (las sustancias siguen reaccionando, pero ya no se observan más cambios). La situación final se denomina de equilibrio químico. No se habrá consumido completamente ninguna de las sustancias. El estudio de estas reacciones se hará en el curso próximo. Las reacciones químicas que se dan en un solo sentido se denominan irreversibles. Leyes de las reacciones químicas: En toda reacción química se cumplen las leyes ponderales que ya tratamos en el Tema 1. Las más importantes a la hora de entender la reacción química son: Ley de conservación de la masa (Lavoisier): “En toda reacción química, la masa total permanece constante. Es decir, la masa total de los reactivos es igual a la masa total de los productos”. Esto se explica teniendo en cuenta que en la reacción, aunque las moléculas cambien, los átomos siguen siendo los mismos, en tipo y cantidad. Sólo se han unido de forma diferente. Por lo tanto, si los átomos son los mismos, la masa tiene que permanecer constante. Ley de las proporciones constantes (Proust): “En una reacción química, las cantidades de las sustancias que intervienen (que reaccionan o que se producen) están en una proporción fija.”
- 1660. I.E.S. “Al-Ándalus”. Dpto. de Física y Química. F.Q. 1º Bachillerato Tema 4. Reacciones químicas - 3 - Esta ley se explica teniendo en cuenta cómo se produce la reacción. Las moléculas que intervienen lo hacen en una proporción fija, de números sencillos. Por lo tanto, en las masas de productos y reactivos también debe existir una proporción fija (aunque no sea la misma que nos indican los coeficientes, ya que la masa molecular de cada sustancia es diferente). 4.2. ESTEQUIOMETRÍA Por estequiometría entendemos el estudio de las proporciones (en masa, en moles, en volumen) existentes entre las distintas sustancias que intervienen en la reacción química. Es decir, nos permite calcular las cantidades de sustancias que reaccionan y/o se producen, a partir de unos datos iniciales. A la hora de realizar cálculos estequiométricos, seguimos unas reglas básicas: - En primer lugar, escribimos la ecuación química completa debidamente ajustada (este paso es fundamental, y el que genera más fallos. Un error en la fórmula de alguna de las sustancias o en el ajuste, hará que todos los cálculos posteriores sean incorrectos). - Ya que los coeficientes estequiométricos de la ecuación nos indican proporción entre moles de sustancias, debemos pasar el dato inicial a moles. - Atendiendo al resultado que nos piden, debemos trabajar con la proporción existente entre la sustancia dato y la sustancia problema (nos la indican los coeficientes). Esto nos dará como resultado el número de moles de la sustancia problema. - Finalmente, ese número de moles lo pasamos a la unidad que nos esté pidiendo el problema (masa, volumen, nº de moléculas...) Reactivos impuros: Algunas sustancias no se encuentran puras al cien por cien, sino que contienen impurezas; de este modo, para trabajar con ellas, necesitamos disponer de un dato adicional: la riqueza (R) o tanto por ciento de sustancia pura que contienen. Así por ejemplo si nos dicen que tenemos una muestra de sulfuro de plomo (II) del 70% en riqueza, hemos de considerar que por cada 100 gramos (o moles) de la muestra solo 70 gramos (o moles) corresponderán al compuesto sulfuro de plomo (II). Reactivo limitante: Es posible que inicialmente tengamos datos de dos o más reactivos. Lo más probable es que no se consuman ambos completamente. En cuanto uno de ellos se agote, la reacción finalizará, sobrando parte de cada uno de los otros. Ese reactivo que se agota en primer lugar se denomina reactivo limitante, y debemos identificarlo, ya que es con él con el que debemos trabajar, considerándolo el dato inicial. Cuando de uno de los reactivos tenemos toda la cantidad necesaria (y de sobra) para completar la reacción (caso del oxígeno atmosférico en una combustión al aire libre, por ejemplo), se denomina reactivo en exceso. Rendimiento de una reacción química: En teoría, una reacción química irreversible se da al 100%, es decir, el reactivo limitante reacciona completamente, se agota. Sin embargo, en la práctica, es posible que parte del reactivo quede sin reaccionar. Por ejemplo, en una cocina de butano, parte del butano se escapa sin arder, o cuando uno de los reactivos es un sólido en trozos gruesos, la parte interior puede que quede sin reaccionar. El rendimiento de la reacción nos indica qué porcentaje del reactivo es el que realmente reacciona (y, por tanto, qué porcentaje de productos se forman, respecto a la cantidad teórica). (Nota: El rendimiento de la reacción es, lógicamente, menor que el 100%. Esto significa: Reactivos: La cantidad de reactivo que reacciona (real) es siempre menor que la cantidad inicial (teórica, necesaria). Productos: La cantidad de producto obtenida (real) es siempre menor que la cantidad de producto que se obtendría teóricamente.) Ejercicio: A partir de la reacción: Zn (s) + H Cl (ac) Æ ZnCl2 (s) + H2 (g) Calcula: a) Cantidad de ZnCl2 obtenida si reaccionan completamente 100 g Zn (208,56 g ZnCl2) b) Volumen de H2 obtenido en c.n. si reaccionan completamente 100 g Zn (34,25 L H2) c) Volumen de disolución de HCl 5 M necesario para que reaccionen completamente los 100 g Zn (0,61 L disol) d) Cantidad de zinc con riqueza del 75% necesaria para obtener 20 g ZnCl2. (12,82 g Zn impuro) e) Si reaccionan 100 g Zn, Vol. H2 obtenido a 800 mmHg y 30ºC suponiendo un rendimiento del 70%. (25,26 L H2) f) Cantidad en g de HCl necesaria para obtener 10 g ZnCl2, suponiendo un rendimiento del 70%. (7,65 g HCl)
- 1661. I.E.S. “Al-Ándalus”. Dpto. de Física y Química. F.Q. 1º Bachillerato Tema 4. Reacciones químicas - 4 - 4.3. INTERCAMBIOS ENERGÉTICOS EN LAS REACCIONES QUÍMICAS. ENERGÍA DE REACCIÓN. CINÉTICA QUÍMICA. Toda reacción química está unida a una absorción o desprendimiento de energía. Tanto las moléculas de los reactivos como las de los productos almacenan energía en los enlaces entre sus átomos. Al cambiar estos enlaces, la energía de los productos será diferente a la de los reactivos (puede ser menor o mayor). Para medir la energía en las reacciones químicas se usa una magnitud denominada entalpía (H). Al nivel que se desarrolla este curso, no hay diferencias apreciables entre entalpía y energía ( ambas se miden en J ). Pero es conveniente que nos vayamos habituando al uso de esta nueva magnitud. La variación de energía ('E) en una reacción química se denomina Calor de reacción (Entalpía de reacción). Se calcula siempre como: 'E = Eproductos – Ereactivos Según se absorba o se desprenda energía en la reacción, encontramos dos tipos de reacciones químicas. Reacciones endotérmicas: La energía de los productos es mayor que la de los reactivos. 'E 0;. Se absorbe energía. Esta energía adicional procede del medio que rodea a la reacción (bien porque la aportemos por calentamiento, luz, chispa eléctrica, etc, o porque tome directamente esa energía del medio, enfriándolo). Ejemplos de reacciones endotérmicas: cocinar los alimentos (desnaturalización de proteínas) , fotosíntesis, recargar la batería del móvil. Reacciones exotérmicas: La energía de los productos es menor que la de los reactivos. 'E 0; . Se desprende energía. El hecho de que se desprenda energía no significa necesariamente que se produzca una llama. Para que eso ocurra, la reacción debe producirse rápidamente y producirse un gran aumento de la temperatura, para que los productos se pongan incandescentes (en eso consiste la llama). Una reacción química puede desprender energía en forma de calor, luz o corriente eléctrica. Ejemplos de reacciones exotérmicas: reacciones ácido-metal, combustiones, pilas y baterías. Entalpía: (función de estado) La mayoría de las reacciones químicas que se llevan a cabo en el laboratorio se producen en recipientes abiertos, es decir, a presión constante. Cuando el proceso tiene lugar a presión constante, el calor de reacción se denomina variación de entalpía ('H). Y si las condiciones son de 25ºC y 1 atm de presión, se denomina 'Hº (variación de entalpía standard) Energía de activación: El hecho de que una reacción sea exotérmica, que desprenda energía, no significa que dicha reacción se produzca espontáneamente en cuanto los reactivos entren en contacto. Por ejemplo, la combustión del butano es muy exotérmica, pero el butano no arde solo al estar en contacto con el oxígeno. Hace falta una pequeña llama, una chispa, que inicie la reacción; posteriormente, se mantiene por sí sola. Esa cantidad de energía inicial se denomina energía de activación. ¿Por qué es necesaria la energía de activación? Recordemos cómo es el mecanismo de una reacción química. Las moléculas de los reactivos chocan entre sí, se rompen las uniones entre los átomos, formándose un estado intermedio llamado complejo activado, y posteriormente se vuelven a formar nuevas moléculas, dando lugar a los productos.
- 1662. I.E.S. “Al-Ándalus”. Dpto. de Física y Química. F.Q. 1º Bachillerato Tema 4. Reacciones químicas - 5 - Pues bien. Para romper los enlaces en las moléculas de los reactivos es necesario un aporte de energía (el complejo activado intermedio tiene mayor energía que los reactivos). Luego, los nuevos enlaces formados desprenderán energía (energía de enlace). Si esa energía desprendida es mayor que la de activación, La reacción será exotérmica. Si, por el contrario, se desprende menos de la que se ha absorbido, los productos tendrán mayor energía que los reactivos reacción endotérmica. Existen sustancias, llamadas catalizadores, que en contacto con los reactivos, hacen que disminuya la energía de activación necesaria, haciendo que la reacción pueda darse con mayor rapidez. Las sustancias reaccionan, pero el catalizador no, no se gasta (no aparece en la reacción como reactivo ni como producto), sólo mejora las condiciones para que la reacción se produzca. Los catalizadores son específicos de una reacción concreta. Actualmente buena aparte de la investigación química avanza en la búsqueda de catalizadores apropiados para distintas reacciones. Ejemplos de reacciones catalizadas: procesos digestivos y del metabolismo de los seres vivos (enzimas). Obtención de derivados del petróleo. Fermentación de yogur, cerveza, bebidas alcohólicas (levaduras). Obtención de ácidos. Los inhibidores son sustancias ralentizan e incluso paralizan la reacción, bloqueando el mecanismo de formación del complejo activado. También son específicos de cada reacción. Velocidad de reacción: Cinética química: La velocidad de una reacción química está ligada al valor de la energía de activación por lo tanto los catalizadores aumentan la velocidad de la reacción. Otros factores que influyen en la velocidad de una reacción química son: temperatura, estado de agregación de los reactivos, concentración de los reactivos y la superficie de contacto. Evidentemente la energía de activación no se modifica con estos factores, pero si ayudan a que las moléculas de los reactivos formen con mayor facilidad el complejo activado y por tanto la velocidad sea mayor. 4.4 ESTUDIO DE ALGUNOS TIPOS DE REACCIONES QUÍMICAS. 4.4.1 Reacciones de oxidación-combustión: El oxígeno (O2) es una de las sustancias más reactivas que se conocen. Reacciona con la mayoría de los metales, dando lugar a óxidos metálicos; y con compuestos orgánicos, que contienen C, H, N, P, S, dando lugar a combinaciones de oxígeno con dichos elementos. Normalmente, las reacciones en las que interviene el oxígeno, van acompañadas de un desprendimiento de energía. Cuando el desprendimiento es considerable, llegando a producirse una llama, la reacción se denomina de combustión. Es lo que ocurre con la materia orgánica, si bien es necesario aportar una cantidad inicial de energía. Ejemplos: Oxidación del hierro: 2 Fe (s) + O2 (g) Æ 2 Fe O (s) ; 4 Fe (s) + 3 O2 (g) Æ 2 Fe2O3 (s) Combustión del magnesio: 2 Mg (s) + O2 (g) Æ 2 Mg O (s) Combustión del butano: 2 C4H10 (g) + 13 O2 (g) Æ 8 CO2 (g) + 10 H2O (g) 4.4.2 Reacciones ácido-base: (según la teoría de Arrhenius) Una sustancia es ácida cuando al disolverse en agua libera protones ( iones H+ ). Por ejemplo: H Cl (ac) Æ Cl- (ac) + H+ (ac) H2SO4 (ac) Æ SO4 -2 (ac) + 2 H+ (ac) Por el contrario, es básica cuando al disolverse en agua, origina iones hidróxido (OH- ). Por ejemplo, los hidróxidos son bases, y también el amoniaco, la lejía... Na OH (ac) Æ Na+ (ac) + OH- (ac) NH3 (ac) + H2O Æ NH4 + (ac) + OH- (ac) Los ácidos son muy reactivos y atacan a los metales (formando sales) y a la materia orgánica, descomponiéndola. 2 HCl (ac) + Zn (s) Æ Zn Cl2 (ac) + H2 (g) Reactivos Productos Complejo activado E Ea Ea Sin catalizador Con catalizador Reacción
- 1663. I.E.S. “Al-Ándalus”. Dpto. de Física y Química. F.Q. 1º Bachillerato Tema 4. Reacciones químicas - 6 - Concepto de pH: Para medir el nivel de acidez o basicidad de una disolución se usa el concepto de pH. Mide la concentración en la disolución de iones H+ (protones), responsables de la acidez. En el agua pura, las moléculas de agua chocan entre ellas y en algunos de esos choques se puede producir la rotura de la molécula en dos iones, H+ y OH- . La reacción sería: H2O Æ H+ + OH- En el equilibrio, la concentración de H+ y OH- en el agua es muy baja. Se cumple la siguiente relación: C(H+ ) · C(OH- ) = 10-14 Cuando ambas concentraciones son iguales ( 10-7 moles/l cada una) la disolución es neutra. x Si disolvemos un ácido, la concentración de H+ aumenta, con lo que la de OH- debe disminuir para que se cumpla la relación anterior. Al haber mayor cantidad de H+ (mayor que 10-7 M), la disolución será ácida. x Al disolver una base, aumenta la concentración de OH- , con lo que la de H+ disminuirá, y será menor de 10-7 M. La disolución se dice que es básica. Para evitar trabajar con potencias de 10, se define un concepto nuevo, el pH. El pH de una disolución se define como: pH = - log [C(H+ )] Así, si la disolución es neutra C(H+ ) = 10-7 M Æ pH = - log (10-7 ) = 7 x Para una disolución ácida, en la que, por ej. C(H+ ) = 0,001 M = 10-3 M Æ pH = 3 x Para una disolución básica, en la que, por ej. C(H+ ) = 10-9 M Æ pH = 9 Una disolución neutra tiene un pH = 7 Una disolución ácida tiene un pH 7 Una disolución básica tiene un pH 7 4.4.3 Reacciones de sustitución: En este tipo de reacciones, un compuesto A B reacciona con un elemento C. El elemento C sustituye a B en el compuesto, dejándolo libre. A B + C Æ A C + B El compuesto A C es más estable (tiene menor energía) que el A B Un ejemplo de reacción de sustitución que es usado en la industria es de los procesos metalúrgicos para la obtención de hierro puro. A partir de pirita (sulfuro de hierro(II) Fe S ), o hematites (óxido de hierro(III) Fe2O3), y haciéndolos reaccionar con carbono, éste sustituye al hierro en el compuesto. Ambas reacciones requieren elevadas temperaturas, lo que se consigue en los altos hornos. 2 Fe S (s) + C (s) Æ C S2 (g) + 2 Fe (l) 2 Fe2O3 (s) + 3 C (s) Æ 3 CO2 (g) + 4 Fe (l) 4.4.4 Reacciones de síntesis (formación de compuestos): Consisten en la formación de un compuesto a partir de los elementos que lo componen en estado puro (como sustancias simples). Algunas de ellas, la formación de óxidos metálicos, ya las hemos estudiado. Otras son: Formación de amoniaco: N2 (g) + 3 H2 (g) Æ 2 NH3 (g) Formación de ácido clorhídrico H2 (g) + Cl2 (g) Æ 2 HCl Formación de cloruro de sodio 2 Na (s) + Cl2 (g) Æ 2 Na Cl (s) 4.4.5 Reacciones de descomposición: Podemos hacer reaccionar un único compuesto para descomponerlo en otros compuestos o en sustancias simples. Normalmente es necesario un aporte energético para que la reacción se lleve a cabo. Los procedimientos más usuales son el aporte de calor (descomposición térmica) y de corriente eléctrica (electrólisis). Ejemplos: Descomposición térmica del óxido de mercurio(II) 2 Hg O (s) Æ 2 Hg (l) + O2 (g)
- 1664. I.E.S. “Al-Ándalus”. Dpto. de Física y Química. F.Q. 1º Bachillerato Tema 4. Reacciones químicas - 7 - Descomposición térmica del clorato potásico K ClO3 (s) Æ O2 (g) + K Cl (s) Electrólisis del agua: 2 H2O (l) Æ 2 H2 (g) + O2 (g) Electrólisis del cloruro de sodio 2 Na Cl (ac) Æ Cl2 (g) + 2 Na (s) 4.5 IMPORTANCIA DE LAS REACCIONES QUÍMICAS EN LA NATURALEZA Y LA SOCIEDAD. Las reacciones químicas están presentes en todos los ámbitos de la naturaleza. No olvidemos que todo cuerpo, vivo o inerte, está formado por sustancias, las cuales a su vez están compuestas de moléculas o redes cristalinas. Entre las sustancias se dan constantemente reacciones químicas. Por ejemplo: - Fenómenos de oxidación y corrosión. Combustiones. - Acción química del agua: Acción sobre roca caliza (Gruta de las Maravillas, por ejemplo) También en los seres vivos están presentes las reacciones químicas. La existencia de todo organismo vivo está basada en las reacciones que se producen entre sustancias del propio organismo y/o sustancias del exterior. Detrás de cualquier acto de un ser vivo, hay una o múltiples reacciones químicas. Por poner algunos ejemplos: - Fotosíntesis de las plantas: elaboración de materia orgánica a partir de inorgánica. - Metabolismo de los alimentos: todos los procesos digestivos se basan en reacciones. - Recepción de estímulos: la visión, el olfato, el oído, la respuesta al calor, o al dolor, se deben a impulsos nerviosos. Dichos impulsos se generan a partir de reacciones entre unas sustancias llamadas neurotransmisores. - Crecimiento: Elaboración de proteínas y nuevas células - Mecanismos de defensa a las enfermedades. Inmunidad. - Fermentación y descomposición de materia orgánica, por parte de microorganismos. Importancia en la sociedad: El desarrollo de la civilización va muy unido al descubrimiento y aprovechamiento de las reacciones químicas por parte del género humano. De hecho, la tecnología tuvo un importante desarrollo a partir de la mitad del s XIX, cuando se establecieron las bases de la química moderna. Como muestra: - Obtención de energía: Combustiones Reacciones ácido-metal: producción de corriente eléctrica. - Metalurgia: obtención de metales a partir de minerales. - Tratamiento del petróleo y sus derivados: Combustibles Plásticos - Elaboración y conservación de alimentos - Elaboración de medicamentos Inconvenientes: El conocimiento de los procesos que rigen las reacciones químicas ha permitido un importante desarrollo, pero no todos son ventajas. Entre los principales inconvenientes: x Contaminación: En toda reacción química se producen sustancias nuevas. Algunas pueden ser útiles o al menos inofensivas, pero otras (la mayoría) son contaminantes. Si la reacción se produce a gran escala (industrias) esto supone un importante problema. Las principales fuentes de contaminación: - Combustiones: producen gases como el CO2 (si está en exceso es reponsable del efecto invernadero), compuestos de azufre y nitrógeno SO2, SO3 y NO2, (responsables de la lluvia ácida). Los plásticos, al arder, producen estas sustancias. Evidentemente son perjudiciales para la salud (problemas respiratorios, alergias ...). También los compuestos conocidos como CFCs, que destruyen la capa de ozono. - Residuos de cianuro y compuestos de metales pesados (Hg, Pb, etc.): Son productos o reactivos de múltiples procesos industriales y metalúrgicos. Contaminan el agua y dañan seriamente el medio ambiente y la salud de las personas (por ej. los metales pesados, cancerígenos, no los elimina el organismo, y se van acumulando). x Incremento de las diferencias entre países ricos y países empobrecidos x Destrucción de espacios naturales para obtención de materias primas
- 1665. $3Ë78/2 (/ 3+ $VSHFWRV WHyULFRV (O S+ HV XQD H[SUHVLyQ GHO FDUiFWHU iFLGR R EiVLFR GH XQ VLVWHPD DFXRVR (Q XQ VHQWLGR HVWULFWR HV XQD PHGLGD GH OD DFWLYLGDG GHO LRQ KLGURQLR´ HQ XQ VHQWLGR SUiFWLFR HV XQD PHGLGD GH OD ³FRQFHQWUDFLyQ PRODU GHO LRQ KLGURQLR´ HQ XQ VLVWHPD DFXRVR (O S+ HV XQD PHGLGD GH OD LQWHQVLGDG iFLGD R DOFDOLQD GH XQD PXHVWUD GH DJXD TXH GLILHUH GH ORV WpUPLQRV ³DFLGH] R DOFDOLQLGDG´ HQ OD PHGLGD HQ TXH HVWRV ~OWLPRV H[SUHVDQ HVHQFLDOPHQWH ³OD FDSDFLGDG DPRUWLJXDGRUD GH OD PXHVWUD´ PiV TXH VX FDUiFWHU iFLGR R EiVLFR SURSLDPHQWH GLFKR /RV FRQFHSWRV GH S+ DOFDOLQLGDG DFLGH] VH UHODFLRQDQ PXWXDPHQWH GHELGR D TXH HO S+ GH OD PXHVWUD VH XWLOL]D FRPR FULWHULR SDUD GHWHUPLQDU VL OD FDSDFLGDG DPRUWLJXDGRUD GH XQD PXHVWUD GH DJXD VH KD GH PHGLU HQ IXQFLyQ GH VX DFLGH] R HQ IXQFLyQ GH VX DOFDOLQLGDG (Q HVWH VHQWLGR ORV FRQFHSWRV GH S+ DFLGH] DOFDOLQLGDG VH DVHPHMDQ PXFKR D ORV GH WHPSHUDWXUD FDORU (O RULJHQ GH OD HVFDOD GH S+ SURYLHQH GHO YDORU GH OD FRQVWDQWH GH LRQL]DFLyQ GHO DJXD D Û .: +2 ĺ + 2+ ņ + @2+ ņ @ .: +2@ D TXH HQ OD PDRUtD GH ORV FDVRV SDUD YDORUHV GH S+ FRPSUHQGLGRV HQWUH
- 1666. OD FRQFHQWUDFLyQ GH DJXD HV PXFKR PiV JUDQGH TXH OD GHO LRQ KLGUyJHQR + R OD GHO LRQ KLGUR[LOR 2+ SDUD OD PDRUtD GH ILQHV SUiFWLFRV VH DVXPH TXH HVWH YDORU HV PX JUDQGH VLHPSUH FRQVWDQWH VH UHSUHVHQWD OD FRQVWDQWH GH LRQL]DFLyQ GHO DJXD VLPSOHPHQWH FRPR .: + @+2ņ @ ņ D ž 3XHVWR TXH SDUD XQD PLVPD WHPSHUDWXUD .: HV FRQVWDQWH FXDQGR OD + @ DXPHQWD OD 2+ ņ @ GLVPLQXH D OD LQYHUVD 'H OD DQWHULRU HFXDFLyQ VH GHGXFH TXH FXDQGR HO DJXD HV QHXWUD OD + @ ņ 0 D TXH QR HV SUiFWLFR H[SUHVDU OD FRQFHQWUDFLyQ PRODU GH QLQJXQD HVSHFLH HQ HVWH FDVR GHO LRQ KLGUyJHQR
- 1667. HQ FLIUDV H[SRQHQFLDOHV VH KD HVWDEOHFLGR XQD HVFDOD ORJDUtWPLFD PiV SUiFWLFD HQ HVWH FDVR HVWD HVFDOD FRQRFLGD FRPR OD HVFDOD GH S+ VH GHILQH PDWHPiWLFDPHQWH FRPR S+ ņORJ+ @ 6LHQGR OD HVFDOD GH S+ ³ORJDUtWPLFD H LQYHUVD´ XQ DXPHQWR GH XQD XQLGDG HQ HO S+ FRUUHVSRQGH D XQD GLVPLQXFLyQ GH YHFHV HQ OD FRQFHQWUDFLyQ PRODU GHO LRQ KLGUyJHQR (O H[WUHPR LQIHULRU GH OD HVFDOD S+
- 1668. FRUUHVSRQGH D XQ FDUiFWHU iFLGR HTXLYDOHQWH DO GH XQD VROXFLyQ 0 GH +O PLHQWUDV TXH HO H[WUHPR VXSHULRU S+
- 1669. FRUUHVSRQGH D XQ FDUiFWHU EiVLFR HTXLYDOHQWH DO GH XQD VROXFLyQ GH 1D2+ 0
- 1670. 'H HVWD IRUPD ³OD HVFDOD GH S+ HV VLPSOHPHQWH XQD HVFDOD GH PHGLFLyQ GHO FDUiFWHU iFLGR R EiVLFR GH XQ VLVWHPD DFXRVR HQWUH GRV H[WUHPRV RSXHVWRV XQR PRODU iFLGR XQR PRODU EiVLFR´ ILJXUD
- 1671. /D HVFDOD GH PHGLFLyQ GHO FDUiFWHU iFLGR R EiVLFR DVt GHILQLGD KD UHVXOWDGR VHU PX ~WLO SXHV DXQ FXDQGR H[LVWHQ HQ OD QDWXUDOH]D VLVWHPDV DFXRVRV PiV iFLGRV TXH HO S+ R PiV EiVLFRV TXH HO S+ HQ HO GH ORV FDVRV HO S+ GH ORV VLVWHPDV DFXRVRV QDWXUDOHV VH KDOOD FRPSUHQGLGR GHQWUR GHO UDQJR GH HVWD HVFDOD (TXLOLEULR ÈFLGR²%DVH HQ $JXD 0HGLR ÈFLGR + !!! 2+² 0HGLR %iVLFR 2+² !!! + 0HGLR 1HXWUR + 2+² ),*85$ ,/8675$,Ï1 *5È),$ '( /$ (6$/$ '( 3+ )8(17( $8725 3RFDV SURSLHGDGHV HQ OD QDWXUDOH]D SRVHHQ XQ JUDGR GH YDULDFLyQ WDQ JUDQGH FRPR HO GHO S+ $Vt SRU HMHPSOR OD GXUH]D HQ HO DJXD HO FRORU OD WXUELGH] R VX FRQGXFWLYLGDG HOpFWULFD VRQ SDUiPHWURV FXR UDQJR GH YDULDFLyQ QR OOHJD VLTXLHUD D OD VH[WD FLIUD GHFLPDO PLHQWUDV TXH HO GHO S+ DOFDQ]D ODV £ FLIUDV GHFLPDOHV 3LHQVH HQ HVWR ³£VL OD HVFDOD GH S+ IXHVH XQD FLQWD PpWULFD SDUD PHGLU GLVWDQFLDV FRQ GLFKD HVFDOD VH SRGUtD PHGLU FyPRGDPHQWH £GHVGH XQ PLOtPHWUR KDVWD OD GLVWDQFLD GH OD 7LHUUD DO VRO ´ )RUPDV GH 0HGLFLyQ 8QD LQGLFDFLyQ DSUR[LPDGD GHO S+ SXHGH REWHQHUVH PHGLDQWH HO XVR GH LQGLFDGRUHV R SDSHOHV LPSUHJQDGRV GH XQ LQGLFDGRU ORV FXDOHV PHGLDQWH VXV YDULDFLRQHV HQ FRORU LQGLFDQ ODV YDULDFLRQHV HQ HO YDORU GHO S+ (VWRV PpWRGRV VRQ HPSOHDGRV FXDQGR OD UDSLGH] GH OD PHGLFLyQ SUHYDOHFH VREUH OD H[DFWLWXG GH OD PHGLGD R FXDQGR OD PHGLFLyQ GLUHFWD FRQ HOHFWURGR VH GLILFXOWD FRPR SRU HMHPSOR FXDQGR VH WUDWD GH PXHVWUDV PX FDOLHQWHV R PX DOFDOLQDV 'H FXDOTXLHU PDQHUD FXDQGR VH WUDWD GH PXHVWUDV FRORUHDGDV R FXDQGR VH UHTXLHUH H[DFWLWXG HQ ODV PHGLGDV HO PpWRGR PiV FRQILDEOH VHJXUR SDUD GHWHUPLQDU HO S+ GH XQ VLVWHPD DFXRVR HV VLHPSUH PHGLDQWH HO XVR GH XQ S+PHWUR 'LVWDQFLD WLHUUD DO VRO C NP
- 1672. 8Q S+PHWUR HV XQ LQVWUXPHQWR DQDOtWLFR TXH FRQVWD GH XQ VHQVRU R HOHFWURGR VHOHFWLYR SDUD HO LRQ KLGUyJHQR GH XQ VLVWHPD HOHFWUyQLFR TXH FDSWXUD OD VHxDO GH FRQFHQWUDFLyQ FRPR XQD VHxDO HOpFWULFD OD WUDGXFH HQ XQD HVFDOD GH YDORUHV QXPpULFRV D TXH HQ WpUPLQRV JHQHUDOHV FXDOTXLHU GLIHUHQFLD GH FRQFHQWUDFLyQ SXHGH DVRFLDUVH D XQD GLIHUHQFLD GH SRWHQFLDO HOpFWULFR XQ S+PHWUR HV HQ SULQFLSLR XQ YROWtPHWUR TXH PLGH GLIHUHQFLDV GH SRWHQFLDO HOpFWULFR DVRFLDGDV D GLIHUHQFLDV GH FRQFHQWUDFLyQ 'H DKt HO RULJHQ GH VX GHQRPLQDFLyQ FRPR ³SRWHQFLyPHWUR´ $Vt HO IXQGDPHQWR GH OD GHWHUPLQDFLyQ SRWHQFLRPpWULFD GHO S+ HV OD PHGLFLyQ GH OD DFWLYLGDG GH ORV LRQHV KLGUyJHQR PHGLDQWH HO XVR GH XQ HOHFWURGR SDWUyQ GH KLGUyJHQR RWUR GH UHIHUHQFLD (O DOPD GH HVWRV HTXLSRV OD FRQVWLWXH HO HOHFWURGR SRU HQGH VH UHFRPLHQGD HVSHFLDO FXLGDGR FRQ HVWD SDUWH GHO HTXLSR $OJXQDV UHFRPHQGDFLRQHV HVSHFLDOHV TXH VH GHEHQ WHQHU GXUDQWH HO XVR GH HVWRV HOHFWURGRV VRQ $]XOGH7LPRO $PDULOORGH0HWLOR 5RMRGH0HWLOR $]XOGH%URPRWLPRO 5RMRGH)HQRO 7LPROIWDOHLQD 1DUDQMDGH0HWLOR )HQRIWDOHLQD $PDULOORGH$OL]DULQD $]XOGH%URPRIHQRO 9LROHWDGH0HWLOR ),*85$ ,1',$'25(6 3+0(752 )8(17( $8725 x (O VHQVRU GHO HOHFWURGR GHEH SHUPDQHFHU VLHPSUH K~PHGR SDUD DVHJXUDU VX KLGUDWDFLyQ x XDQGR HO HOHFWURGR QR HVWp HQ XVR VH GHEH PDQWHQHU VXPHUJLGR HQ XQD VROXFLyQ GH .O 0 x 3XHVWR TXH HO HOHFWURGR GH UHIHUHQFLD HQ XQ HOHFWURGR FRPELQDGR GH S+ FRQVWD GH XQD FHOGD GH $J$JO VH GHEH SURFXUDU JXDUGDUOR LQPHUVR HQ VROXFLRQHV TXH FRQWHQJDQ FORUXURV HYLWDU DTXHOODV TXH FRQWHQJDQ LRQHV TXH SUHFLSLWHQ HO LRQ SODWD WDOHV FRPR PXHVWUDV TXH FRQWHQJDQ VXOIXURV FURPDWRV HWF x 6H GHEHQ HYLWDU ODV PXHVWUDV H[WUHPDGDPHQWH FDOLHQWHV R GH S+ H[WUHPR SDUWLFXODUPHQWH ODV GH S+ EiVLFR 'LFKDV PXHVWUDV GHVFDOLEUDQ HO HTXLSR GLVPLQXHQ OD YLGD ~WLO GHO HOHFWURGR 8Q S+PHWUR FRPR FXDOTXLHU RWUR HTXLSR GH PHGLFLyQ QHFHVLWD GH XQ SURFHVR GH FDOLEUDFLyQ UXWLQDULR SDUD TXH SXHGD VXPLQLVWUDU UHVXOWDGRV FRQILDEOHV 3RU OR JHQHUDO GXUDQWH ODV FDPSDxDV GH PXHVWUHR HQ FDPSR VH GHEH FDOLEUDU HO S+PHWUR SRU OR PHQRV XQD YH] DO GtD DQWHV GH FDGD MRUQDGD 6L HO S+ HVSHUDGR HQ ODV PXHVWUDV TXH VH UHTXLHUH PHGLU HV OLJHUDPHQWH iFLGR HV DFRQVHMDEOH FDOLEUDU HO LQVWUXPHQWR IUHQWH D VROXFLRQHV SDWUyQ GH S+ 6L SRU HO FRQWUDULR
- 1673. HO S+ HVSHUDGR HV OLJHUDPHQWH DOFDOLQR VH UHFRPLHQGD FDOLEUDU FRQ VROXFLRQHV SDWUyQ GH S+ 3UHSDUDFLyQ GH ORV SDWURQHV GH S+ x /RV SDWURQHV SDUD S+ VXHOHQ SUHSDUDUVH D SDUWLU GH DJXD GHVPLQHUDOL]DGD R ELHQ D SDUWLU GH XQD VROXFLyQ GLOXLGD GH .O SDUD REYLDU OD DFLGH] GHO DJXD GHVPLQHUDOL]DGD (VWD VROXFLyQ VH XWLOL]D SDUD HO ODYDGR GHO HOHFWURGR HQ XQ IUDVFR ODYDGRU
- 1674. DQWHV GHVSXpV GH FDGD FDOLEUDFLyQ ),*85$ 3+0(752 '( $032 (/(752'2 '( 3+ )8(17( $8725 x %XIIHU S+ 3HVDU J GH .++2 VHFDGR D ž OOHYDU D XQ OLWUR HO S+ GH HVWD VROXFLyQ HV GH D ž x %XIIHU S+ 3HVDU J .+32 J GH 1D+32 VHFDGRV FRQ DQWLFLSDFLyQ OOHYDU D XQ OLWUR HO S+ GH HVWD VROXFLyQ HV GH D ž x %XIIHU S+ 'LVXHOYD J GH 1D%2 +2 FRPSOHWH D XQ OLWUR HO S+ GH HVWD VROXFLyQ HV GH D ž 127$ (O HOHFWURGR GHEH SHUPDQHFHU YHUWLFDO FRQ HO VHQVRU KXPHGHFLGR FXDQGR QR VH HVWp XVDQGR (O GHMDUOR VHFR GXUDQWH XQ WLHPSR SURORQJDGR SXHGH GHWHULRUDUOR LUUHYHUVLEOHPHQWH HO PDQWHQHUOR FRQ OD SXQWD GH IULWD GH YLGULR KDFLD DUULED LQWURGXFH EXUEXMDV GH DLUH TXH DOWHUDQ ODV PHGLFLRQHV 0HGLFLRQHV HQ FDPSR (O YDORU PiV UHSUHVHQWDWLYR GHO S+ GH XQ FXHUSR GH DJXDV HV HO TXH VH PLGH GLUHFWDPHQWH HQ FDPSR (V IUHFXHQWH TXH HVWRV YDORUHV FDPELHQ FXDQGR VH PLGHQ HQ HO ODERUDWRULR HQ PXHVWUDV TXH KDQ VLGR WUDQVSRUWDGDV (VWR VXFHGH SRUTXH HO S+ HVWi LQIOXHQFLDGR SRU HO WLSR GH JDVHV GLVXHOWRV HQ OD PXHVWUD OD FRQFHQWUDFLyQ GH HVWRV D VX YH] GHSHQGH GH OD WHPSHUDWXUD GH OD (Q DOJXQRV FDVRV SDUWLFXODUPHQWH FXQDGR VH WUDEDMD FRQ DJXDV GH PX EDMD FRQGXFWLYLGDG HOpFWULFD VH SXHGHQ ORJUDU PHGLFLRQHV GH S+ PDV HVWDEOHV PDV UiSLGDV DGLFLRQDQGR XQDV SRFDV JRWDV GH VROXFLyQ GLOXLGD GH .O
- 1675. SUHVLyQ GH FDGD OXJDU 3RU HVWD UD]yQ VH UHFRPLHQGD UHDOL]DU ODV PHGLFLRQHV GLUHFWDPHQWH HQ OD IXHQWH 0DWHULDOHV x S+PHWUR FLQWD SDUD S+ x 9DVRV GH SUHFLSLWDGRV x )UDVFR ODYDGRU 3UiFWLFD GH ODERUDWRULR /D SDUWH H[SHULPHQWDO GH HVWH FDStWXOR VH UHDOL]D FRQMXQWDPHQWH FRQ OD GH FRQGXFWLYLGDG HOpFWULFD HQ HO FDStWXOR
- 1696. Física: Es una ciencia fundamental que estudia y describe el comportamiento de los fenómenos naturales que ocurren en nuestro universo. Es una ciencia basada en observaciones experimentales y en mediciones. Su objetivo es desarrollar teorías físicas basadas en leyes fundamentales, que permitan describir el mayor número posible de fenómenos naturales con el menor número posible de leyes físicas. Estas leyes físicas se expresan en lenguaje matemático, por lo que para entender sin inconvenientes el tratamiento del formalismo teórico de los fenómenos físicos se debe tener una apropiada formación en matemáticas, en este curso basta un nivel básico de matemáticas. Teoría científica: Síntesis de una gran cantidad de información que abarca diversas hipótesis probadas y verificables de ciertos aspectos del mundo natural. Ningún experimento resulta aceptable a menos que sea reproducible, es decir que produzca un resultado idéntico independientemente de cuando, donde y por quien sea realizado. Los resultados de los distintos experimentos se reúnen para formar una teoría. Una teoría es la síntesis de todas las observaciones realizadas en los experimentos, que debería hacer posible predecir el resultado de nuevos experimentos antes de que se realicen. Pero no se debe esperar que una teoría explique ciertos fenómenos de una vez por todas, sino
- 1697. Cap. 1 Introducción a la Física 17 mas bien los coordine dentro de un conjunto sistemático de conocimientos. La validez de una teoría puede probarse únicamente con el experimento. Una teoría científica no debe contener elemento alguno metafísico o mitológi- co, se deben eliminar los mitos y prejuicios. Hoy en día se debe tener especial cuidado, puesto que nuestro mitos contemporáneos gustan de ataviarse con ropajes científicos, pretendiendo con ello alcanzar gran respetabilidad. Los charlatanes siempre buscan mencionar el nombre de algún gran científico en un intento por hacer creíbles sus charlatanerías. Mecánica. Es una rama de la física. Su objetivo es describir (con la cinemáti- ca) y explicar (con la dinámica) el movimiento de los cuerpos. Cinemática. Describe el movimiento de los cuerpos sin preocuparse de las causas que lo producen. Dinámica. Describe el movimiento de los cuerpos considerando las causas que lo producen, y las causas del movimiento son las fuerzas. Hipótesis: Suposición bien fundamentada, considerada como un hecho cuan- do se demuestra experimentalmente. Hecho: Acuerdo entre observadores competentes sobre una serie de observa- ciones de un fenómeno particular. Ley: Comprobación de una hipótesis sin ninguna contradicción. Una ley física se considera como tal cuando todos los experimentos obedecen esa ley, si en algún caso no se cumple, deja de ser ley física. ¿Son las leyes terrestres váli- das en todo el Universo? Hay que usarlas y después evaluar su resultado. No se debe pretender buscar una nueva ley para explicar algún fenómeno en el cual las leyes ya existentes no parecen encajar satisfactoriamente, porque esto conduce al caos lógico. Aunque se debe estar dispuesto a aceptar nuevas leyes naturales si su adopción demuestra ser necesaria. Ciencia: Método para dar respuestas a preguntas teóricas. La ciencia descubre hechos y formula teorías. Tecnología: Método para resolver problemas prácticos, usa técnicas y proce- dimientos para aplicar los descubrimientos de la ciencia.
- 1698. Cap. 1 Introducción a la Física 18 Modelo: Concepto introducido por los científicos para ayudarse a visualizar posibles procesos dentro de un sistema físico. Un modelo se usa para repre- sentar la realidad física y debe tener en cuenta dos aspectos conflictivos entre sí: a) tiene que ser lo bastante simple para como para ser elaborado con méto- dos matemáticamente rigurosos, b) debe ser realista para que los resultados obtenidos sean aplicables al problema considerado. La sencillez del modelo, su belleza matemática, es incompatible con la fidelidad al problema real. Lo bello raramente es fiel y lo fiel raramente es bello. Matemáticas: Es el lenguaje de las ciencias, es lo que establece una conexión entre la teoría y el experimento. Las leyes Físicas se expresan en lenguaje ma- temático, en general de nivel muy avanzado. Religión: Se ocupa del propósito de la naturaleza, no se preocupa por usar los métodos de la ciencia, tiene que ver con la Fe y la adoración de un ser supre- mo, que es Dios. Ciencia y religión no son contradictorias, son complementa- rias. No es necesario elegir entre ambas, se pueden adoptar las dos. 1.3 EL MÉTODO CIENTÍFICO. El método científico es un método efectivo para adquirir, organizar y aplicar nuevos conocimientos. Su principal fundador fue Galileo (1564-1642). Se ba- sa en la formulación de hipótesis y en la recopilación de pruebas objetivas que traten de probar la veracidad de tales hipótesis establecidas previamente. El método científico puede dividirse a grandes rasgos en varios pasos: a. Observar el medio natural. b. Hacerse una pregunta sobre el comportamiento del medio. c. Formular una hipótesis y derivar de ella predicciones que puedan ser de- mostradas. d. Planear un experimento que pueda verificar esa hipótesis. e. Analizar los datos obtenidos de ese experimento. Si los datos coinciden con las derivaciones de la hipótesis, se podrá decir que ésta funciona y es válida en ese contexto. f. A partir de esa hipótesis demostrada, elaborar una Teoría. g. Nuevamente acudir a la Naturaleza para contrastarla.
- 1699. Cap. 1 Introducción a la Física 19 h. Si la Teoría se cumple y demuestra, a partir de ella se formulará una Ley, que tratará de describir el fenómeno. Antes de Galileo, la mayor parte de los experimentos no seguían este orden de pensamiento, sino que se basaban en la observación del medio y emisión de teorías, sin mayor comprobación posterior de éstas. La novedad que trajo con- sigo el método científico fue que se trabajaba con hipótesis que debían ser demostradas. Todo ello supuso un gran avance para la física como ciencia, puesto que se empezó a observar la naturaleza y a afirmar expresiones, hoy en día tan comunes como “parece que va a llover”. Este método no siempre ha sido la clave de los descubrimientos, en muchos casos gran parte del progreso de la ciencia se ha debido a resultados obtenidos por error o por casualidad. 1.4 SISTEMAS DE MAGNITUDES Y UNIDADES. Medir una magnitud consiste en compararla con una cantidad arbitraria fija de la magnitud. Una medición se expresa con un número seguida de un símbolo de la unidad usada. Existen medidas directas e indirectas, por ejemplo el largo y el ancho de una sala son medidas directas, pero la superficie de la sala es una medida indirecta. Gran parte de la Física tiene que ver con la medida de cantidades físicas tales como distancia, tiempo, volumen, masa, temperatura, etc. Las leyes Físicas se expresan en términos de cantidades básicas que re- quieren una definición clara, llamadas magnitudes físicas fundamentales. En mecánica las magnitudes físicas fundamentales son tres: longitud, tiempo y masa. Se llaman magnitudes físicas fundamentales porque están definidas en forma independiente de cualquier otra magnitud física. Para que sean útiles deben ser invariables y reproducibles y se debe definir una unidad de medida única para la magnitud física, llamada patrón de medi- da. El Sistema Internacional (SI) de unidades determina el conjunto de patro- nes de medida. En este sistema, las unidades de medida de las magnitudes fí- sicas fundamentales en Mecánica, son las que se dan en la tabla 1.1. Este se conoce también como el sistema MKS (abreviaturas de metro, kilogramo y segundo). También existe el sistema CGS cuyas unidades de medida son el centímetro, gramo y segundo, y el sistema inglés de ingeniería, que es extre-
- 1700. Cap. 1 Introducción a la Física 20 madamente confuso, por lo que no lo usaremos en este curso. El SI es el que se usa mayoritariamente en todas las áreas de las ciencias. La definición operacional actual de las magnitudes físicas fundamentales se da a continuación. Tabla 1.1. Unidades de medida de las magnitudes físicas fundamentales en mecánica. Magnitud Física Unidad de medida Símbolo Longitud Metro m Tiempo Segundo s Masa Kilogramo kg Longitud: Se han desarrollado muchos sistemas de medición de longitud, pero se han abandonado por razones de precisión. Desde 1983, la unidad de longi- tud, el metro, se define como la distancia recorrida por la luz en el vacío du- rante un tiempo de 1/299792458 segundos. De paso esta definición establece que la rapidez de la luz en el vacío es de 299 792 458 m/s. Tiempo: En 1967 se definió el segundo como unidad de tiempo igual a 9 192 631 770 periodos de la radiación de átomos de cesio 133. Con un reloj atómi- co de cesio, se puede medir la frecuencia de su radiación con una precisión de una parte en 1012 , lo que equivale a una incertidumbre menor que un segundo cada 30000 años. Masa: Desde 1987 se considera como unidad de masa, el kilogramo, que se define como la masa de una aleación de platino e iridio que se conserva en el Laboratorio Internacional de Pesas y Medidas en Sevres, cerca de París, Fran- cia. Este patrón es confiable porque dicha aleación es muy estable. Las otras magnitudes fundamentales de la Física, que con las anteriores suman siete en total, están indicadas en la tabla 1.2. En ciencias se usan muchas otras magnitudes físicas, que se obtienen como una combinación de las magnitudes físicas fundamentales. Se llaman magni- tudes físicas derivadas, porque se derivan de las magnitudes físicas funda- mentales. Por ejemplo:
- 1701. Cap. 1 Introducción a la Física 21 área = longitud por longitud, se mide en m2 aceleración = longitud/tiempo al cuadrado, se mide en m/s2 fuerza = masa por aceleración, se mide en Newton, N = kg m/s2 densidad = masa/volumen, se mide en kg/m3 , etc. Tabla 1.2. Unidades de medida de las magnitudes físicas fundamentales. Magnitud Física Unidad de medida Símbolo Temperatura Kelvin K Corriente eléctrica Ampere A Intensidad luminosa Candela Cd Cantidad de sustancia Mol mol 1.5 MULTIPLOS, SUBMULTIPLOS Y PREFIJOS. Teniendo en cuenta que la Física estudia el comportamiento del universo, los valores numéricos de las magnitudes físicas varían en un rango muy amplio, desde cantidades muy pequeñas a muy grandes. Por ejemplo, para comprender el origen del Universo, a los astrofísicos y cosmólogos les preocupa actual- mente saber que paso entre el Big Bang y el minúsculo instante ¡10-43 s!, o como determinar bien la edad del Universo cuyas últimas mediciones dan un valor de 1.45x1010 años, con una incertidumbre de un par de miles de millones de años. La Tierra tiene una edad de 4600 millones de años. Especialistas han estudiado la cronología de la Biblia para calcular cuanto tiempo ha pasado desde los días del Edén, sumando la edad de Adán y sus descendientes. En 1650 el arzobispo irlandés James Ussher propuso que Dios creo la Tierra el 22 de octubre del año 4004 antes de nuestra era, valor que no concuerda con las mediciones. Los valores numéricos de la física pueden ser muy complicados de leer en su forma tradicional, por lo que generalmente se expresan en potencias de 10, que es la notación científica. Ejemplos de algunos valores comunes se mues- tran en la tabla 1.3.
- 1702. Cap. 1 Introducción a la Física 22 Tabla 1.3. Algunos valores numéricos de magnitudes físicas conocidas. Masa (kg) Sol Humano Electrón 2 x 1030 70 9.1 x 10-31 Longitud (m) Distancia Tierra - Sol Cancha de fútbol Diámetro núcleo atómico 1.5 x 1011 90 10-14 Tiempo (s) Edad de la Tierra Edad de estudiante UdeC Duración choque nuclear 1.5 x 1017 5 x 108 10-22 Si el exponente de la potencia de 10 es positivo (o negativo) el valor de la magnitud física es un múltiplo (o submúltiplo). Para medir magnitudes muy grandes o muy pequeñas se expresan los valores en potencias de 10 y se usan los prefijos del SI que es el nombre que se le da a la potencia de 10. Existen algunas unidades de medición que tienen nombres especiales, como por ejem- plo el año luz que es la distancia que recorre la luz en un año, igual a 9.45 x 1015 m, o el Angstrom que es igual a 10-10 m. En la tabla 1.4 se dan los nom- bres de los prefijos del Sistema Internacional. 1.5.1 Orden de magnitud. El orden de magnitud es la potencia de 10 más cercana al valor verdadero de una magnitud física conocida cuyo valor numérico se conoce. Para indicarla se usa el símbolo vírgula, ~. Cuando se compara entre magnitudes físicas simila- res, se dice que una magnitud física difiere de la otra en un orden de magnitud, cuando es mayor o menor en un factor de 10. Ejemplo 1.1. El orden de magnitud de 1 es cero ó 100 , el orden de magnitud de 10 es uno ó 101 , el orden de magnitud de 100 es dos ó 102 , etc. Ejemplo 1.2. a) Determinar el orden de magnitud de la masa de la Tierra, cuyo valor es aproximadamente 6 x 1024 kg. b) Si la masa del Sol a 1030 kg, ¿en cuantos órdenes de magnitud difiere de la masa de la Tierra?
- 1703. Cap. 1 Introducción a la Física 23 Solución: a) considerando que 6 es un valor mas cercano a 10 = 101 que a 1 = 100 , su orden de magnitud es 6 a 101 , por lo tanto el orden de magnitud de la ma- sa de la Tierra es 6 x 1024 a 101 x1024 a 1025 kg a 10 Ykg ó del orden de 25. b) Si la masa del Sol a 1030 kg, ¿en cuantos órdenes de magnitud difiere de la masa de la Tierra? Solución: 5 25 30 10 10 10 Tierralademasa Soldelmasa Por lo tanto la masa del Sol es 5 órdenes de magnitud mayor (cien mil veces mas grande) que la masa de la Tierra. Tabla 1.4 Prefijos del Sistema Internacional. Potencia 10x Prefijo Símbolo -24 yocto y -21 zepto z -18 atto. a -15 femto f -12 pico p -9 nano n -6 micro P -3 mili m -2 centi c -1 deci d 1 deca da 2 hecto h 3 kilo k 6 mega M 9 giga G 12 tera T 15 peta P 18 exa E 21 zeta Z 24 yota Y
- 1704. Cap. 1 Introducción a la Física 24 1.5.2 Estimación. Hacer una estimación es asignar un valor numérico razonable a una magnitud Física conocida, cuyo valor verdadero, en el momento de usar esa magnitud, no se conoce. Ejemplo 1.3. Estimar la edad de los alumnos del curso de Física I. Solución: Considerando que los alumnos ingresan a la universidad a la edad aproximada de 18 años, que el curso de Física I lo realizan en el segundo se- mestre, que algunos alumnos ingresan a la carrera tiempo después de egresar de la enseñanza media y que es probable que el curso de física no lo estén cursando en el semestre que corresponde, se puede considerar que la edad de los alumnos del curso de Física I varia entre 18 y 22 años, por lo que se pue- de estimar como edad de cualquier alumno en a 20 años. Su orden de magni- tud es ~ 10 años. 1.5.3 Transformación de unidades. Muchos cálculos en Física requieren convertir unidades de un sistema a otro. Las unidades pueden convertirse sustituyéndolas por cantidades equivalentes. En toda respuesta numérica de los problemas siempre debe escribirse las uni- dades en el resultado final. Ejemplo 1.4. Transformar 18 km/hora a m/s. Solución: Se sabe que 1h = 3600 s y que 1 km = 1000 m, entonces: s m km m s hr hr km 5 1 1000 3600 1 18 uu 1.5.4 Análisis dimensional. Se usa para verificar que todos los términos de una ecuación tengan las mis- mas dimensiones, lo que garantiza que la ecuación está planteada en forma
- 1705. Cap. 1 Introducción a la Física 25 correcta. Cuando se hace el análisis dimensional, los términos no se operan con el álgebra corriente, por ejemplo las unidades de medida no se suman o restan, solo se comparan sus unidades entre términos de la ecuación a dimen- sionar, generalmente se usa el símbolo [ ] en cada término al hacer el análisis. Ejemplo 1.5. Hacer el análisis dimensional para el siguiente modelo físico axvv o 222 , donde v se mide en m/s, x en m y a en m/s2 . Solución: se escriben las unidades de medida en cada término de la ecuación, considerando que las unidades no se suman ni restan y que el 2 es un número sin unidades de medida que no multiplica a la unidad de medida: @ » ¼ º « ¬ ª ¸ ¹ · ¨ © § » ¼ º « ¬ ª »¼ º «¬ ª » ¼ º « ¬ ª ¸ ¹ · ¨ © § » ¼ º « ¬ ª ¸ ¹ · ¨ © § Ÿ 2 2 2 2 22 22 2 s m s m m s m s m s m axvv o Por lo tanto la expresión es dimensionalmente consistente. 1.6 SISTEMAS DE REFERENCIA. En mecánica se tratan problemas relacionados con la descripción del movi- miento de un objeto en el espacio, por lo que se requiere un método para co- nocer la posición de ese objeto. Para esto se definen los sistemas de coordena- das y marcos de referencia. Un sistema de coordenadas usado para indicar las posiciones en el espacio consta de: 1. Un punto de referencia fijo O, llamado origen. 2. Un conjunto de ejes o direcciones con una escala apropiada. 3. Instrucciones sobre como identificar un punto en el espacio respecto al ori- gen y a los ejes. 1.6.1 Coordenadas cartesianas o rectangulares. Un sistema de coordenadas frecuentemente usado es el sistema de coordena- das cartesiano o rectangular, que se muestra en la figura 1.2, con ejes x sa-
- 1706. Cap. 1 Introducción a la Física 26 liendo del plano de la figura, eje y horizontal y eje z vertical. En este sistema un punto P arbitrario se identifica con tres coordenadas identificadas por (x,y,z), con los valores positivos de los ejes hacia fuera del plano de la figura, hacia la derecha y hacia arriba, respectivamente en cada eje, como se indica en la figura 1.2. Es el espacio común en el que vivimos, se llama espacio tridimensional porque tiene tres dimensiones, para indicarlo usamos en símbolo 3D. En ocasiones bastan dos o una coordenadas para fijar la posición del objeto, estos se llaman espacio bidimensional (2D) o unidimensional (1D), respectivamente. Figura 1.2. Coordenadas cartesianas. 1.6.2 Coordenadas polares. Otro sistema de coordenadas conocido es el de las coordenadas polares (r,T) (figura 1.3), donde r es la distancia desde el origen al punto (x,y), generalmen- te llamado radio, y T el ángulo entre el eje x y r, por convención, considerado positivo cuando es medido en sentido antihorario desde el eje x hacia r. La relación entre las coordenadas cartesianas y polares es TT rseny,cosrx . Se deja como ejercicio al alumno demostrar que sus relaciones inversas son:
- 1707. Cap. 1 Introducción a la Física 27 22 yxr , x y tan T Figura 1.3. Coordenadas polares. De paso aprovechemos de recordar el teorema de Pitágoras y las funciones trigonométricas básicas seno, coseno y tangente, que se definen para un trián- gulo rectángulo, como el que se muestra en la figura 1.4, estas son: 222 yxr r y hipotenusa opuestocateto senD r x hipotenusa adyacentecateto cosD x y adyecentecateto opuestocateto tanD
- 1708. Cap. 1 Introducción a la Física 28 Figura 1.4. Un triángulo rectángulo. 1.7 CONCEPTOS BÁSICOS DE VECTORES. Las magnitudes físicas con las que trataremos en el curso pueden ser escalares o vectoriales. Las magnitudes físicas escalares quedan completamente defini- das mediante un número y sus respectivas unidades de medida, por ejemplo la densidad del agua de 1 gr/cm3 o la temperatura del aire de 20º C, son un esca- lar. Para las magnitudes físicas vectoriales debe especificarse su magnitud (un número con sus unidades), su dirección (un número que puede ser un án- gulo si el espacio es bi o tridimensional) y su sentido (que indica hacia adonde se dirige o apunta el vector), por ejemplo una velocidad de 80 km/h hacia el noreste. Un vector se representa gráficamente como un trazo dirigido (flecha) y se simboliza mediante letras mayúsculas o minúsculas, con una flecha sobre la letra o escrita en negrita, como V o V , r o r , OP o OP. La longitud de la flecha indica la magnitud relativa del vector, el punto desde donde se comien- za a dibujar el vector se llama punto de aplicación, la dirección se mide desde algún eje de referencia, generalmente horizontal, el sentido esta dado por la punta de la flecha y la recta sobre la cual se ubica el vector se llama línea de acción. En la figura 1.5, el vector A tiene magnitud A, su punto de aplicación es O y su dirección es D grados sobre la horizontal. 1.7.1 Igualdad de vectores. Dos o más vectores son iguales si: a) apuntan en la misma dirección, b) si sus magnitudes son iguales. En la figura 1.6, dcba independientemente de la ubicación de los vectores en el espacio.
- 1709. Cap. 1 Introducción a la Física 29 Figura 1.5. Representación de un vector. Figura 1.6 Igualdad de vectores. 1.7.2 Multiplicación de un vector por un escalar. El resultado de multiplicar un vector por un escalar O es un vector, de magni- tud distinta y de dirección igual (o contraria) al vector original. En la figura 1.7 se muestra que b2B y d32D . Figura 1.7. 1.7.3 Vectores especiales. x Vector nulo: es un vector de magnitud igual a cero (0).
- 1710. Cap. 1 Introducción a la Física 30 x Vector unitario: vector de magnitud igual a uno (1). 1.7.4 Adición de vectores y algunas de sus propiedades. Los vectores se pueden sumar en forma geométrica por diversos métodos, ta- les como los que se muestran en la figura 1.8, a) el método del polígono o b) el método del paralelogramo. Figura 1.8. a) Método del polígono, b) método del paralelogramo. Además los vectores cumplen con las siguientes propiedades del álgebra: x Conmutatividad de la suma: a + b = a + b. x Asociatividad de la suma: a + b + c = (a + b) + c = a + (b + c). x Distributividad de la multiplicación por un escalar en la suma de vectores. x Conmutatividad del producto: a · b = b · a , a · a = a2 . x Asociatividad del producto: a · ( b + c) = a · b +a · c x Inverso aditivo: si a + b = 0, entonces b es el inverso aditivo de a y se es- cribe b = -a. x La resta de vectores es un caso especial de adición, donde el vector restan- do se suma con su inverso aditivo: a - b = a +(- b). x La división entre vectores no está definida. 1.7.5 Representación de los vectores en coordenadas cartesianas. Las componentes vectoriales de un vector son aquellas que sumadas dan como resultado el vector original. Las componentes vectoriales de un vector en el espacio se calculan a lo largo de un conjunto de 3 líneas mutuamente perpen-
- 1711. Cap. 1 Introducción a la Física 31 diculares que se cortan en un mismo punto, es decir en líneas paralelas a los ejes de un sistema de coordenadas cartesiano. Los vectores unitarios y las componentes vectoriales del vector A en estas direcciones se designan por kji ˆ,ˆ,ˆ y por Ax, Ay, Az, respectivamente, tal que: kˆAjˆAiˆAA zyx En el plano (x, y) de la figura 1.9, se tiene: Vector: jˆAiˆAA yx Componentes: Ax = A cosD, Ay = A senD Magnitud: 2 y 2 x AAA Dirección: tanD = Ay/Ax Figura 1.9. Componentes de un vector. 1.7.6 Igualdad de vectores en componentes. Dos vectores son iguales si todas sus componentes son iguales, esto es, A = B si Ax = Bx, Ay = By y Az = Bz.
- 1712. CII ICII I Cap´ıtulo 1 CINEMATICA Los movimientos m´as f´aciles de describir son los de una part´ıcula puntual, es decir aquella que no tiene dimensi´on alguna ni estructura interna. Sin embargo, antes de des- cribir su movimento, es necesario establecer la base matem´atica que permita localizarla de manera un´ıvoca en el espacio. 1.1. Sistema coordenado cartesiano Para localizar un punto en el espacio, lo m´as sencillo es utilizar lo que se conoce como sistema coordenado cartesiano. Esto no es m´as que el conjunto formado por un punto arbitrario del espacio, O, que se llama origen del sistema coordenado, y tres vectores unitarios y pendiculares entre s´ı, que forman la base del sistema coordenado y que se denotan por i, j y k (ver Fig. 1.1). Es muy importante que el triedro que forman los vectores de la base sea orientado a derechas. Lo que esto quiere decir es que ha de cumplirse que: k = i × j, (1.1) por lo que la orientaci´on de i y j puede elegirse arbitrariamente, pero la de k viene dada por la Ec. 1.1. Una vez hecho esto, la posici´on de cualquier punto P viene especificada por el vector que une el origen con el punto en cuestion. Este vector se conoce por radio vector, y se escribe en general como: r = x i + y j + z k. (1.2) Las longitudes de las componentes del radio vector a lo largo de los vectores de la base, llamadas coordenadas del punto P, se denotan por las letras x, y y z. Otra notaci´on 7
- 1713. CII ICII I 8 X Y Z i j k α β γ y x z r O Figura 1.1: Coordenadas cartesianas. com´un para el radio vector r es: r = (x, y, z). (1.3) Importante: La elecci´on tanto del origen como de los vectores de la base es totalmente arbitraria. Por ello, debe realizarse intentando simplificar al m´aximo el problema que luego queramos resolver. Por ejemplo, si queremos describir el movimiento de un cuerpo a lo largo de una l´ınea recta, es conveniente escoger uno de los ejes coordenados a lo largo de esta l´ınea (el eje OX, por ejemplo). An´alogamente, si el movimiento est´a restringido al plano, es ´util que se escoja dicho plano coincidente con alguno de los tres planos coordenados OXY , OZY ´o OZX, formados, respectivamente, por la envolvente lineal de las parejas correspondientes de vectores de la base i, j y k. c 2004 Ra´ul S´anchez. Dpto. F´ısica. Universidad Carlos III de Madrid.
- 1714. CII ICII I 9 1.2. Trayectoria En general, un cuerpo que describa un movimiento en el espacio se mover´a sobre una curva que se conoce como trayectoria. Es importante darse cuenta de que sobre una mis- ma trayectoria pueden darse infinitos tipos de movimiento. As´ı, por ejemplo, supongamos un cuerpo que se mueve en plano OXY siguiendo la recta y = x. Podr´a moverse a veloci- dad constante, con un movimiento uniformemente acelerado o de una n´umero infinito de maneras. ¿C´omo se describe matem´aticamente esta diferencia? La manera de hacerlo es darse cuenta de que la trayectoria es el lugar geom´etrico de los puntos que visita el m´ovil. En este ejemplo tan simple, viene dada por al ecuaci´on: y = x, z = 0. (1.4) Sin embargo, los distintos tipos de movimento vienen descritos por ecuaciones del tipo: x = f(t), y = f(t) z = 0, (1.5) donde f(t) es una funcion arbitraria del tiempo t que ser´a distinta para cada tipo de movimiento. Por ejemplo, si el movimiento es uniforme, f(t) = a + bt (a y b son dos constantes cualesquiera), mientras que si es uniformemente acelerado, tendremos que f(t) = a + bt + ct2 . Claramente, existe un n´umero infinito de funciones f posibles pe- ro, para cualquier funci´on f que escojamos, siempre se cumple que y = x! Resumiendo, la ecuaci´on de la trayectoria ser´a un conjunto de ecuaciones que relacio- nan a las coordenadas entre s´ı (como la Eq. 1.4), mientras que las que especifican el tipo de movimiento depender´an expl´ıcitamente del tiempo. ¿C´omo se pasa de una a las otras? Pues despejando el par´ametro tiempo de todas las ecuaciones de la Eq. 1.5, e igual´andolas entre s´ı para eliminarlo. 1.3. Vector velocidad Como vimos en la secci´on anterior, existen muchos tipos de movimiento, incluso sobre una misma trayectoria. ´Estos se distinguen por el ritmo con el que cambia el vector posici´on al cambiar el tiempo es diferente. Es importante acostumbrarse a que, en F´ısica, cualquier magnitud que exprese el cambio de una cantidad respecto de otra se representa matem´aticamente por la derivada de la primera respecto a la segunda. Veamos con m´as detalle esto en el caso del cambio del vector posici´on. Para ello, nos concentramos en la Fig. 1.3, que muestra la posici´on de un m´ovil en el instante t, y un poco despu´es, en el c 2004 Ra´ul S´anchez. Dpto. F´ısica. Universidad Carlos III de Madrid.
- 1715. CII ICII I 10 instante t + ∆t. Durante ese intervalo de tiempo, la posici´on del m´ovil ha pasado de estar caracterizada por el vector r(t) a estarlo por el vector r(t+∆t). El cambio que ha sufrido el vector posici´on viene dado por el vector desplazamiento ∆r: ∆r = r(t + ∆t) − r(t), (1.6) que geom´etricamente no es sino el vector que une las puntas de los vectores r(t + ∆t) y r(t). El ritmo con el que cambia ese vector no es sino su cambio en la unidad de tiempo, que en el l´ımite en que ∆t tiende a cero nos da el vector velocidad: v = l´ım ∆t→0 ∆r ∆t = dr dt . (1.7) X Y Z i j k r r(t+ t) r(t) ∆ ∆ Figura 1.2: Vector desplazamiento. c 2004 Ra´ul S´anchez. Dpto. F´ısica. Universidad Carlos III de Madrid.
- 1716. DINÁMICA Hemos estudiado algunos de los distintos tipos de movimientos que existen en la naturaleza. Ahora, llegó el momento de explicar por qué se producen éstos movimientos, y de esto se encarga la dinámica. La dinámica se basa en tres principios fundamentales, denominados Principios de Newton. Tengamos en cuenta que un principio es una verdad científica que no se puede demostrar experimentalmente pero que si se puede verificar en forma parcial. Se denomina principio porque a partir de él construiremos toda una teoría, en este caso, de la mecánica clásica. EL PRINCIPIO DE INERCIA El principio de inercia no fue, estrictamente, descubierto por Newton. En realidad, se sabe que el célebre Leonardo da Vinci (1452-1519) lo había intuido años antes pero lo mantuvo en secreto. Fue Galileo Galilei (1564-1642) quien lo descubre y lo presenta al mundo en su famoso libre dialogo sobre dos nuevas ciencias, sin embargo, no lo formula como principio básico de la naturaleza. Finalmente, Isaac Newton (1642-1727), lo enuncia como el primero de sus tres principios en su famoso libro Principios de filosofía natural, del siguiente modo: Principio de Inercia: Si sobre un cuerpo no actúan fuerzas, o, la suma de las fuerzas que sobre él actúan es igual a cero, el cuerpo permanece en reposo o se mueve con movimiento rectilíneo uniforme. Consideraciones: a- El principio de inercia nos da por primera vez una idea clara acerca de lo que es una fuerza. Es aquel ente físico capaz de producir una modificación en el estado de reposo o de MRU de un cuerpo. b- También nos explica el por qué un cuerpo puede seguirse moviendo cuando deja de actuar la fuerza que lo impulsó. c- Este principio no nos dice nada acerca de lo que sucede con un cuerpo sobre el cual actúan fuerzas, sin embargo lo sugiere. Por acción de las fuerzas los cuerpos se acelerarán, aunque no sabemos de qué forma. d- La inercia es una propiedad fundamental de la materia. Podría definirse a la materia como todo aquel ente físico que posee inercia. EL PRINCIPIO DE MASA Este principio si fue descubierto por Newton y es el principio que relaciona la fuerza aplicada a un cuerpo con la aceleración que adquiere. Es el único de los principios que se expresa través de una ecuación.
- 1717. Principio de Masa: La aceleración que adquiere un cuerpo es directamente proporcional a la fuerza que se le aplica siendo la constante de proporcionalidad una magnitud denominada masa del cuerpo. - La masa de un cuerpo, es la medida de su inercia y está relacionada con la cantidad de materia que el cuerpo posee. b- Como la ecuación es vectorial, es evidente que la aceleración tiene la misma dirección y sentido de la fuerza. c- Como el peso de un cuerpo es una fuerza ( la fuerza con que la tierra lo atrae ), podrá calcularse aplicando el principio de masa, y, teniendo en cuenta que la aceleración que interviene es la de la gravedad, nos queda: d- Es evidente que, debido a la consideración anterior, un cuerpo tendrá la misma masa en todo el universo, dado que es una característica propia del cuerpo. Sin embargo ese mismo cuerpo no pesará lo mismo en todo el universo, pues el peso depende de la aceleración de la gravedad y esta depende del planeta en que el cuerpo se encuentre, inclusive, si el cuerpo se encuentra lejos de todo planeta, no pesará pero seguirá teniendo masa pues habrá que aplicarle una fuerza para acelerarlo. e- El principio de masa es válido también cuando actúan varias fuerzas sobre el cuerpo pues, éstas fuerzas sumadas, darán como resultado una fuerza a la que se le aplicará el principio. Diagramas de cuerpo libre: Cuando sobre un cuerpo actúan más de una fuerza, aplicar el segundo principio de Newton tiene sus secretos. Comprendamos que esta ecuación es vectorial y por lo tanto, puede suceder que las fuerzas actuantes lo hagan en distintas direcciones. Gracias al principio de independencia de Galileo, podemos descomponer los movimientos en varias direcciones y por lo tanto, las causas de éstos (Las fuerzas) también. Esto hacemos cuando confeccionamos un diagrama de cuerpo libre. Veamos un ejemplo: Supongamos que varias fuerzas actúan sobre un cuerpo como indica la figura. Colocaremos el cuerpo sobre un sistema de coordenadas y descompondremos toda fuerza que no se encuentre sobre los ejes coordenados, hallando una componente en el eje X y otra en el eje Y. En este caso y debido al sistema adoptado la única fuerza que habrá que descomponer es F1.
- 1718. La ecuación a aplicar es: F = m.a Y las componentes de F1 en los ejes son: F1x = F1.cos F2x = F1.sen Aplicamos el segundo principio de Newton para cada eje: Eje X: Σ Fx = m.a F1x - F3 = m.a F1.cosα - F3 = m.a Obsérvese que F3 resta porque se encuentra en el lado negativo del eje X Eje Y: Σ Fy = m.a F1y - F2 = m.a F1.senα - F2 = m.a Como en el caso anterior, F2 resta porque su sentido es coincidente con en el lado negativo del eje Y EL PRINCIPIO DE ACCIÓN Y REACCIÓN Este principio, también conocido como principio de interacción, es quizás el más difícil de comprender. Principio de Acción y Reacción: Si un cuerpo ejerce una fuerza sobre otro, éste aplica otra fuerza igual pero de sentido contrario sobre el primero. A la primera se la denomina acción y a la segunda reacción. Consideraciones: a- Las fuerzas son la consecuencia de la interacción entre dos cuerpos, es decir, si solo existiera un cuerpo en el universo, no existirían las fuerzas. b- Las fuerzas siempre aparecen de a pares, una sobre cada uno de los cuerpos que interactúan. c- Las fuerzas de acción y reacción tienen siempre el mismo módulo y son de sentido contrario, sin embargo, jamás pueden ponerse en equilibrio entre sí, pues actúan en cuerpos diferentes y para que dos fuerzas iguales y de sentido contrario se equilibren deben actuar sobre el mismo cuerpo.
- 1719. UNIDADES DE LA FUERZA SISTEMA M.K.S. ó S.I Su nombre proviene de las iníciales de sus tres unidades fundamentales: metro, kilogramo segundo. SISTEMA C.G.S. Su nombre también proviene de las iníciales de sus tres unidades fundamentales: centímetro, gramo, segundo. Nuevamente la unidad derivada será la de fuerza pero se denominará Dina. Sistema Técnico Este sistema tiene tres unidades fundamentales que son: La unidad de longitud, la unidad de tiempo y la unidad de fuerza. El kilogramo fuerza (Kgf), es la fuerza equivalente al peso de un cuerpo denominado kilogramo patrón construido con una aleación de platino e iridio y que está guardado en la oficina internacional de pesas y medidas en la ciudad de París. Equivalencia entre el N y el Kgf La equivalencia entre estas unidades surge de la propia definición de las mismas. Supongamos que el cuerpo patrón denominado kilogramo es el de la figura. Mientras que para el sistema Técnico el cuerpo pesa 1 Kgf, para el sistema MKS tiene 1Kg. de masa. Sistema técnico Sistema MKS P = 1 Kgf m = 1 Kg Si calculamos el peso en este sistema tenemos Por lo tanto la equivalencia es: 1 Kgf = 9,8 N Análogamente pueden deducirse todas las equivalencias que resumimos en este cuadro:
- 1720. Los principios de Newton y los movimientos. Cuando estudiamos cinemática dijimos que mas adelante explicaríamos el porque de cada movimiento. Pues ha llegado el momento de hacerlo. 1- M.R.U. Este movimiento lo explica el principio de inercia, para que aparezca, no debe actuar ninguna fuerza sobre el cuerpo o la suma de ellas debe ser cero. 2- M.R.U.V. La causa de este movimiento, será una fuerza constante (que puede ser resultante de mas de una fuerza aplicada), que tenga la misma dirección que el vector velocidad del cuerpo en cuestión. 3- Tiro horizontal y tiro oblicuo En este caso, solo actúa una fuerza en dirección vertical, el peso del proyectil, haciendo que verticalmente el movimiento sea uniformemente variado. En la dirección horizontal no hay fuerzas aplicadas, por lo tanto, en esta dirección no hay aceleración. 4-Movimiento circular uniforme (MCU) Este movimiento se produce cuando sobre un cuerpo actúa una fuerza de módulo constante que en todo momento tiene una dirección perpendicular al vector velocidad. Ejemplo 1: Un hombre pesa 70 kgf en la tierra. Calcular su masa y su peso en la tierra y en la luna en sistemas técnico y MKS. ( =9,8 m/s2, gL=1,67 m/s2) Solución: Si el cuerpo pesa en la tierra pesa 70 kgf (sistema técnico), su masa es70kg (sistema MKS). Por lo tanto:
- 1721. Ejemplo 2: Sobre un cuerpo que pesa 30 kgf que está apoyado en una superficie horizontal actúa una fuerza paralela al plano de 270 N. Calcular la aceleración que adquiere: Solución: Si el cuerpo pesa 30 kgf en la tierra tiene 30 kg de masa. Por lo tanto: FUERZAS ESPECIALES. Estudiaremos ahora algunas fuerzas que, por su importancia y frecuencia con que aparecen, merecen especial atención. a- Fuerza de reacción normal de apoyo (Normal) Esta fuerza, aparece siempre que un cuerpo está apoyado sobre una superficie y es consecuencia de la interacción entre el cuerpo y la superficie de apoyo. Su valor depende de las condiciones físicas en cada caso. Veamos algunos ejemplos. 1- Cuerpo apoyado sobre una superficie horizontal En este caso, la fuerza peso hace que el cuerpo aplique otra fuerza contra la superficie, por lo tanto y debido al principio de acción y reacción, la superficie de apoyo aplicará una fuerza igual y de sentido contrario sobre el cuerpo. Ésta es la fuerza de reacción normal de apoyo. En este caso, puede verse claramente que su módulo es igual al peso del cuerpo. Pero es importante tener claro que no siempre será así, es mas, éste es el único caso. En el dibujo, P es el peso del cuerpo, N’ la fuerza que el cuerpo le aplica a la superficie y N la fuerza normal. Si hacemos el diagrama de cuerpo libre para el cuerpo y aplicamos el segundo principio de Newton, nos queda: Como solo actúan fuerzas en Y: Y como en el eje Y la aceleración es cero, tenemos:
- 1722. La materia terrestre necesitaba para moverse de una fuerza que la impulsara constantemente, mientras que la materia celeste, se impulsaba por si misma y por ésta razón los cuerpos celestes se movían solos en el firmamento. Como sabemos, esta teoría tenía varios problemas: ƒ Algunos astros como la luna, se mantenían siempre a la misma distancia de la tierra y otros como el sol, parecían alejarse y acercarse periódicamente. ƒ La mayoría de las estrellas parecían cumplir con la ley de las esferas de cristal, pero existían algunos astros como mercurio, Venus, Marte y Júpiter que se movían caprichosamente en el espacio sin seguir ninguna ley sencilla. A estos se los denominó “planetas” que en griego significa errantes o vagabundos. Como hemos visto, en el siglo XVI, muchos pensadores dudaban ya del sistema de Ptolomeo y algunos como Copérnico, se habían animado a cambiar, colocando al sol como el centro del sistema solar y afirmando que la tierra era un planeta más que giraba alrededor del sol según circunferencias concéntricas con él. Posteriormente, Kepler, haciendo observaciones muy precisas, cambia la idea de órbitas circulares por órbitas elípticas y fundamenta que la luna sí se encuentra girando alrededor de la tierra. Galileo, coincide totalmente y utilizando su telescopio, descubre las lunas de Júpiter, que confirman las ideas de planetas y lunas girando alrededor de ellos. Pero faltaba una ley que explicara todos estos movimientos y unificara la mecánica. Fue Isaac Newton quien logró esta ley fabulosa, conocida hoy como ley de gravitación universal. Newton no creía que la materia celeste fuera distinta que la terrestre y se le ocurrió que la misma fuerza que hacía caer una manzana a la tierra era la responsable de que la luna curvara su trayectoria haciéndola girar alrededor de la tierra en un movimiento de caída constante. En ésta idea se puso a trabajar utilizando las observaciones de Kepler y Galileo. Luego de una labor soberbia de análisis de datos, compaginación e intuición física concluyó que: a- Los cuerpos se atraen por el solo hecho de poseer masa. b- Esta fuerza de atracción solo se hace notar cuando al menos uno de los cuerpos que interactúan es enormemente grande, como un planeta. c- No es necesario que los cuerpos estén en contacto para que esta fuerza actúe, es decir, es una fuerza de interacción a distancia. LEY DE GRAVITACIÓN “La fuerza de atracción entre dos cuerpos, tiene una dirección que coincide con la recta que los une y su módulo es directamente proporcional al producto de las masas e inversamente proporcional al cuadrado de las distancia que las separa”.
- 1723. La constante de proporcionalidad G entre las magnitudes depende del sistema de unidades adoptado y se conoce con el nombre de constante de gravitación universal. Su valor en el sistema internacional es: Ejemplo 4: Calcular el radio de la órbita de la luna teniendo en cuenta que la masa de la tierra es 5,98x1024 Kg. Solución: Observemos que la fuerza de gravitación sobre la luna en este caso, actúa como centrípeta, pues es la encargada de que la luna no continúe con MRU y curve su trayectoria girando alrededor de la tierra. Aplicamos para el cálculo de F, la ley de gravitación universal y el segundo principio de Newton: Como se trata de la misma fuerza podemos igualar las ecuaciones, cancelar la masa de la luna y despejar el radio de la órbita: La velocidad de traslación de la luna puede calcularse teniendo en cuenta el período de rotación que es de 28 días ( 2.419.200 s.):
- 1727. Contenidos Didácticos Energía 1 FUERZA Es la consecuencia de la existencia de la energía. A través de la fuerza se hace posible el cambio de estado de reposo o movimiento de los cuerpos, o de deformarlos temporal o permanentemente. Permite provocar aceleraciones positivas o negativas en los cuerpos. F = m . a Donde: F = fuerza en Newtones (N) m = masa del cuerpo en kg. a = aceleración positiva o negativa, en metros por segundo cuadrado (m/s2 ). El peso implica la fuerza mediante la cual un cuerpo es atraído por la acción de la gravedad. P = m . g P = peso del cuerpo en Newtones m = masa del cuerpo en kg. g = aceleración de la gravedad, 9.8 m/s2 . Clasificación • Fuerzas motoras Son las fuerzas que originan movimientos. • Fuerzas resistentes Son fuerzas contrarias a las anteriores, puesto que son aquellas que tienden a impedir los movimientos. Principio de Inercia y Principio de Acción y Reacción Principio de inercia Se denomina inercia a la propiedad que posee la materia que permite que los cuerpos no puedan modificar, por sí mismos, su estado de reposo o de movimiento uniforme. El principio de inercia implica que si un cuerpo se encuentra en reposo, sin estar sometido a la acción de ninguna fuerza, continúa en reposo; y si un cuerpo está en movimiento, no sometido a la acción de ninguna fuerza, continúa en movimiento. Este principio también expone que todo cuerpo, abandonado a sí mismo, posee aceleración nula. Principio de acción y reacción
- 1728. Contenidos Didácticos Energía Este principio propone que a toda fuerza que ejerce una acción, le corresponde otra fuerza igual y de sentido contrario denominada reacción. Este principio también se aplica a los cuerpos o sistemas en movimiento.
- 1729. Contenidos Didácticos Energía 2 TRABAJO Trabajo es el resultado del valor de una fuerza, aplicada sobre un cuerpo, por el valor del espacio recorrido por dicho cuerpo. Para que exista el trabajo debe cumplirse necesariamente con la condición de desplazamiento. Además, existirá trabajo siempre que una fuerza desplace su punto de aplicación. El trabajo se relaciona también con la energía, puesto que ésta es la capacidad que posee la materia de producir trabajo.
- 1730. Contenidos Didácticos Energía 3 POTENCIA Siempre que se produzca una transformación de energía en cualquier sistema, elemento mecánico o eléctrico se utiliza el concepto de potencia. Se denomina potencia a la cualidad que determina la mayor o menor rapidez en realizar un trabajo. Es la velocidad con la que se obtiene dicho trabajo. Se entiende por magnitud a la duración de cada uno de los distintos fenómenos físicos. La magnitud se mide a través del segundo. Se establece entonces, que potencia, es la cantidad de energía absorbida o de trabajo efectuado en la unidad de tiempo.
- 1731. Contenidos Didácticos Energía 4 ENERGÍA Es todo aquello que puede originar o dar existencia a un trabajo. Es la capacidad que posee la materia para producir calor, trabajo en forma de movimiento, luz, crecimiento biológico, etc. Por materia se entiende cualquier cuerpo sólido, líquido y gaseoso existente. Transformación de la Energía Las distintas manifestaciones o formas de energía pueden transformarse unas en otras. Para que estas transformaciones hayan podido realizarse, ha sido fundamental la creación por parte del hombre de maquinarias, que por sí solas no producirían energía. Una transformación posible de energía seria el caso de la energía potencial o de posición que posee una masa de agua estancada que se transforma en energía cinética cuando cae desde una altura cualquiera (energía hidráulica) por una tubería e incide sobre el rodete de una turbina hidráulica, haciéndola girar (energía mecánica).
- 1732. Contenidos Didácticos Energía 5 RENDIMIENTO El rendimiento puede ser expresado en función de la energía, el trabajo y la potencia. Rendimiento en función de la Energía Cuando se produce un proceso de transformación de energía, la cantidad lograda de la misma (energía útil) es menor a la cantidad inicial, absorbida por la maquinaria (energía total). Esto se debe a la pérdida de energía que tiene lugar durante la transformación (energía perdida). Energía total = energía útil + energía perdida Rendimiento = Energía útil / Energía total Energía útil = energía total – energía perdida Rendimiento = (energía total – energía perdida) / Energía Total por lo tanto: Rendimiento = (1 – energía perdida) / Energía Total Como consecuencia de la ecuación anterior, se deduce que el rendimiento será siempre un valor inferior a uno y que solo podrá obtenerse el valor 1 en la situación improbable de que no existiese perdida de energía alguna. El rendimiento más bajo ocurre cuando la energía térmica sufre una transformación en otra forma de energía. En cambio, los rendimientos mas elevados se logran al transformarse la energía eléctrica. Rendimiento en función del Trabajo y la Potencia Si nos referimos al trabajo: Rendimiento = Trabajo útil / Trabajo Total por lo tanto Rendimiento = (1 – Trabajo perdido) / Trabajo total El trabajo perdido puede originarse por rozamientos, calentamientos, fallas en los elementos constructivos. En el caso de la potencia: Rendimiento = Potencia útil / Potencia Total por lo tanto Rendimiento = (1 – potencia perdida) / Potencia Total El rendimiento expresado en tanto por ciento, se debe multiplicar el rendimiento por 100.
- 1733. Contenidos Didácticos Energía 6 CLASIFICACIÓN DE ENERGÍA La energía puede encontrarse de dos formas posibles, según cual sea el estado de reposo o movimiento de los cuerpos que la originan. Energía Potencial Por energía potencial o de posición se entiende aquella energía que poseen los cuerpos cuando se encuentran en reposo; es la energía almacenada en la materia. La energía de presión o gravitatoria es aquella contenida en las masas líquidas respecto a planos horizontales o puntos inferiores de referencia. Energía Cinética Se denomina energía cinética o de velocidad o de movimiento a la energía que proviene de los cuerpos en movimiento, o de las partes que constituyen a los mismos (moléculas).
- 1734. Contenidos Didácticos Energía 7 MANIFESTACIONES DE LA ENERGÍA La energía se manifiesta de diferentes maneras: Las fuentes más naturales e independientes, en las que no existe la intervención directa del hombre son las siguientes: • Energía solar: casi la totalidad de la energía proviene del sol y se manifiesta a través de radiaciones luminosas, caloríficas y electromagnéticas. • Energía química: se encuentra contenida en cuerpos combustibles • Energía bioquímica: está presente en el desarrollo de los seres vivos. En las siguientes fuentes de energía, el hombre debe participar necesariamente en el control de las mismas: • Energía hidráulica: esta energía se origina con el movimiento del agua. Este movimiento puede ser consecuencia de la caída de corrientes de agua o de las crecientes y bajadas de las mareas. • Energía térmica o calorífica: se origina a partir de la combustión de un cuerpo combustible. Es empleada en un radiador eléctrico. • Energía eólica: es aquella que tiene origen en los vientos.
- 1735. Contenidos Didácticos Energía 8 PRINCIPIOS DE LA ENERGÍA Principio de Conservación de la Energía Este principio establece que la energía ni se crea ni se destruye, solamente se transforma. Cualesquiera que sean las modificaciones de energía en el interior de un sistema, la cantidad total de energía en el mismo es constante. Principio de Degradación de la Energía Cuando se efectúa una transformación de energía de una forma u otra siempre surge energía térmica, aún cuando el objetivo sea otro. Se trata de una energía térmica no utilizable, pero igualmente cumple con el principio de conservación, debido a que no se produce destrucción de energía. La cantidad de energía que se obtiene en el modo deseado, es siempre menor al valor de la energía empleada en un principio. Ejemplos: Al transformarse la energía química potencial del carbón en energía calorífica, y posteriormente en energía mecánica en la turbina de vapor, está última energía constituye una porción débil de la primitiva. El remanente no ha desaparecido ni se ha destruido, sino que se ha transformado en energía térmica no útil. Esta se ha disipado en los diferentes elementos que componen la instalación. Un motor eléctrico que se encuentra conectado a la red, sufre un calentamiento. Esto se debe a que una parte de la energía eléctrica se transforma en calor, por lo que, el valor de la energía mecánica obtenida, no es igual al de la energía empleada en un principio. Si se trata de una transformación directa de energía eléctrica en calorífica, puede deducirse que existe una mínima degradación o pérdida.
- 1736. 6 „ MATEMÁTICAS B 1. Números racionales e irracionales Decimales periódicos Has visto en cursos anteriores que una fracción es un cociente entre dos números enteros. La división de esos dos números da lugar a una expresión decimal con un grupo de cifras que se repiten periódicamente, el llamado periodo, y que puede ser: x Decimal periódico puro. La representación de un número de este tipo es: ˆ 09,1...090909,1 11 12 ; el periodo es 09. x Decimal periódico mixto. 60,2...06666,2 15 31 ; el periodo es 6. x Decimal exacto. 125,0...125000,0 8 1 Fracción generatriz Todo decimal periódico puede expresarse en forma de fracción que llamaremos fracción generatriz del decimal en cuestión. En estos casos no es necesario aplicar la fórmula sino que resulta más sencillo proceder de la siguiente manera: x Decimal exacto Se divide por la unidad seguida de tantos ceros como cifras decimales hay. x Decimal periódico puro En el numerador se escribe la diferencia entre la parte entera seguida del periodo y la parte entera, en el denominador tantos nueves como cifras tiene el periodo. x Decimal periódico mixto En el numerador se escribe la parte entera seguida de las cifras hasta acabar el primer periodo menos la parte entera seguida de las cifras hasta comenzar el periodo, en el denominador tantos nueves como cifras tiene el periodo seguidos de tantos ceros como cifras hay entre la coma y el comienzo del periodo. Números reales 7 12 El resto siempre es menor que el divisor, luego a lo sumo en un número de pasos igual al divisor, el resto se va repetir y las cifras decimales del cociente también. x Decimal exacto x=71,52 2 cifras decimales se multiplica por 102 100x=7152 100 7152 x x Periódico puro x=853,11... Periodo con 1 cifra se multiplica por 10 10x=8531,11.. Restando: 9x=8531-853 9 7678 x x Periódico mixto x=4,9368368.. 1 cifra entre la coma y el periodo se multiplica por 10 10x=49,368368... Periodo con 3 cifras se multiplica por 103 10000x=49368,368... Restando: 9990x=49368-49 9990 49319 x
- 1737. MATEMÁTICAS B „ 7 2 no es un decimal periódico Si lo fuese se podría escribir en forma de fracción irreducible: s21 r21 q...qq p...pp m n 2 ˜˜˜ ˜˜˜ siendo p1,p2, ..., los factores primos de n; q1, q2,... los de m y todas las “p” distintas de las “q”. Elevando al cuadrado: 2 s 2 2 2 1 2 r 2 2 2 1 2 2 q...qq p...pp m n 2 ˜˜˜ ˜˜˜ 22 m2nŸ Luego n es divisible para 2, n=2t, por tanto m t2 2 Elevando de nuevo al cuadrado: 2222 t2mt4m2 Ÿ De donde se deduce que también m es divisible por 2, lo que es contradictorio con que m/n sea una fracción irreducible. Por lo que 2 no se puede escribir en forma de fracción y no es decimal periódico. Números racionales Los decimales exactos, periódicos puros y periódicos mixtos tienen en común que su parte decimal acaba siendo periódica (por lo que a todos ellos los llamaremos decimales periódicos). Además, hemos visto que pueden escribirse en forma de fracción o razón, por lo que a partir de ahora a los decimales periódicos los llamaremos números racionales. Los números racionales pueden representarse de forma ordenada sobre una línea recta, asignando a cada número un punto de la misma. Números irracionales Existen números que no pueden escribirse en forma de fracción o equivalentemente su parte decimal no es periódica. Estos números reciben el nombre de números irracionales. Números reales En las figuras adjuntas puedes ver cómo pueden representarse en la recta números irracionales procedentes de raíces cuadradas. Sin embargo, no todos los números irracionales pueden representarse mediante una técnica simple como ésta y hay que recurrir a métodos aproximados para lograrlo. Ahora, lo importante es que tenemos dos conjuntos numéricos: los decimales periódicos o racionales y los decimales no periódicos o irracionales. La unión de estos dos conjuntos es el conjunto de los números reales. Números reales
- 1738. 10 „ MATEMÁTICAS B Cálculo con aproximaciones El cálculo con aproximaciones está relacionado con el problema de la medida. Al medir longitudes usando una regla graduada en cm y mm, obtenemos dos aproximaciones, una por defecto y otra por exceso, y daremos como medida el valor más cercano o el que nos parezca mas probable. La cota de error será la diferencia entre estas aproximaciones o la mitad si tomamos el valor más probable. Si operamos con las medidas así obtenidas: 9 El error absoluto de la suma o resta de dos o más aproximaciones es la suma de los errores absolutos de todas ellas. 9 El error relativo del producto o cociente de dos o más aproximaciones es la suma de los errores relativos de cada una de ellas. Notación científica Las aproximaciones tienen un interés especial cuando se trabaja con números muy grandes o muy próximos a 0. En este caso utilizamos una notación especial denominada notación científica, llamada así porque es en el ámbito de la ciencia donde más suele utilizarse. Un número expresado en notación científica tiene la forma: x·10n , siendo x un nº decimal mayor que 1 y menor que 10, es decir con una sola cifra distinta de 0, en su parte entera. Para operar con números en notación científica basta aplicar las propiedades de las potencias. Números reales Con la calculadora Para introducir en la calculadora números en notación científica como: 9,0043 · 1013 Teclea 9 . 0043 EXP 13 Aparecerá: 9.0043 13 6,0743 · 10-18 Teclea 6 . 0743 EXP +/- 18 Aparecerá: 6.0743 -18 Si introduces: 900,43 · 1013 Teclea 900 . 43 EXP 13 Aparecerá: 900.43 13 Y pulsando = sale el nº en notación científica: 9.0043 15 Diámetro de la galaxia de Andrómeda: 9,4608·1017 km Tamaño de la bacteria del cólera 1,59·10-3 mm La galaxia de Andrómeda tiene un diámetro de 100000 años-luz y está situada a unos 2000000 de años-luz, ¿cuál es su diámetro y cuánto dista en km? Velocidad de la luz:300000 km/sg En un año: 300000·365·24·60·60= 9.460.800.000.000 km = 9,4608·1012 Diámetro de la galaxia (km): 105 ·9,4608·1012 =9,4608·1017 Distancia (km): 2·106 ·9,4608·1012 =1,8922·1019 ¿Cuántos átomos de oxígeno caben a lo largo de una bacteria? 7 3 102,1 1059,1 ˜ ˜ =1,325·104 ¿Cuántos núcleos de oxígeno caben a lo largo de un átomo? 12 7 1055,6 102,1 ˜ ˜ =0,1832·105 en notación científica =1,832·104 Diámetro del átomo de oxígeno: 1,2·10-7 mm Diámetro del núcleo: 6,55·10-12 mm Base: 3,4r 0,1 Error relativo: 0,1/3,4=0,03 Altura: 4,5r 0,1 Error relativo: 0,1/4,5=0,02 Perímetro: 15,8 r 0,4 Área: 15,3r (15,3·0,05)= =15,3 r 0,8 Aproximación por defecto: 3,20 Aproximación por exceso: 3,30 Valor más probable: 3,25 Cota de error: 3,25-3,20=0,05
- 1739. 12 „ MATEMÁTICAS B 4. La recta real Ordenación de números reales Todo número real queda representado por un punto de la recta y, recíprocamente, a todo punto de la recta le corresponde un número real. Observa en el gráfico como asignar un punto de la recta a un número irracional como S, mediante una sucesión de intervalos encajados. Esto permite definir una relación de orden en el conjunto de los números reales: 9 Dados dos números reales, a y b, diremos que a es menor que b, a b, si al representarlos a está a la izquierda de b. 9 También podemos decir que los números a la derecha del cero son los positivos y los de la izquierda son los negativos, y a es menor que b si la diferencia b - a es positiva. Valor absoluto y distancias La equivalencia entre puntos y números permite aplicar conceptos geométricos al cálculo, en particular la idea de distancia mediante el valor absoluto de un número. 9 Llamamos valor absoluto de un número real, a, al mayor de los números a y -a. El valor absoluto de a se representa así: |a|. El valor absoluto de un número representa la distancia del mismo al cero. Podemos generalizar esta idea: 9 La distancia entre dos números reales, a y b, es el valor absoluto de su diferencia: d(a,b)=|b-a|=|a-b| S = 3,141592353589793... De esta forma podemos acotar S entre dos números racionales, que ya sabemos representar, y que están cada vez más próximos. a=2,6828 |a|=2,6828 -a=-2,6828 |-a|=2,6828 Si a y b tienen el mismo signo la distancia entre a y b es la resta de los valores absolutos, y si el signo es distinto la suma. a=-4,2946 |a|=4,2946 b=2,5447 |b|=2,5447 d(a,b)=6,8393 a=3,0054 |a|=3,0054 b=4,2861 |b|=4,2461 d(a,b)=1,2807 Propiedades del valor absoluto 1) |a| t 0 2) |a|=|-a| 3) |a+b|d|a|+|b| 4) |a·b|=|a|·|b| 5) |b| |a| b a Números reales
- 1740. MATEMÁTICAS B „ 13 EJERCICIOS resueltos 1. Ordenar de menor a mayor: 6320)f30694)e 4605 5952091 )d 5560 8243924 )c1010314,6)b1097509,5)a 68 ˜˜ c f b e d a 2. El radio de una circunferencia es de 4 m. Calcula su longitud 2.1. Truncando el resultado primero a cm y luego a m. L = 2·S·r =24,88141381...m = 2488 cm = 24 m 2.2. Redondeando el resultado primero a cm y luego a m L = 2·S·r =24,88141381...m = 2488 cm = 25 m 3. Calcula el valor absoluto de los números a=-3 y b=5, y la distancia entre ellos. |a|=3, |b|=5, dist(a,b)=|b-a|=|5-(-3)|=|8|=8 4. Calcula |a+b| |a-b| |a·b| y |a/b| |a+b|=|-3+5|=|2|=2; |a-b|=|-3-5|=|-8|=8; |a·b|=|-3·5|=|-15|=15; |a/b|=|-3/5|=3/5 5. Indica qué puntos pertenecen al intervalo en cada caso: 5.1. Intervalo (-74,-52]. Puntos: a) –53 b) –74 c) 11 Respuesta: ninguno 5.2. Intervalo (-’,75]. Puntos: a) 32 b) 75 c) 76 Respuesta: a y b. Intervalo cerrado: Los extremos pertenecen al intervalo. [a,b]= `^ bxa/Rx dd Intervalo abierto: Los extremos no pertenecen al intervalo. (a,b)= `^ bxa/Rx Intervalo semiabierto: Un extremo pertenece al intervalo y otro no. (a,b]= `^ bxa/Rx d Entorno simétrico de a: (a-r,a+r)= `^ raxra/Rx Semirrecta acotada superiormente (- f,b]= `^ bx/Rx d Semirrecta acotada inferiormente (a,+ f)= `^ xa/Rx Intervalos: segmentos y semirrectas El concepto de intervalo está ligado a los conceptos geométricos de segmento y semirrecta: un intervalo acotado equivale a un segmento y un intervalo no acotado equivale a una semirrecta. 9 Dados dos números reales a y b, se llama intervalo de extremos a y b al conjunto de números reales comprendidos entre ambos. 9 La longitud del intervalo es la distancia(a,b)=|b-a| En los intervalos acotados dependiendo de que los extremos pertenezcan o no al mismo, se distinguen los intervalos cerrados, abiertos y semiabiertos (por la izquierda o por la derecha). Si se construye un intervalo abierto alrededor de un punto a se obtiene un entorno simétrico de a y de radio r, conjunto de números reales cuya distancia a “a” es menor que r. Un intervalo no acotado es el conjunto formado por todos los números mayores (o t), o menores (o d) que uno dado, a, la cota inferior o superior respectivamente. Se representan mediante una semirrecta y su longitud es infinita. Números reales a b Números reales R a R b Números realesNúmeros reales R a b Números realesNúmeros reales b Números realesNúmeros realesNúmeros reales R a Números reales a R R
- 1741. 16 „ MATEMÁTICAS B Recuerda lo más importante Los números reales El conjunto de números reales está formado por los números racionales y los números irracionales. x Un número racional es una fracción y todas sus equivalentes. Todo nº racional se puede expresar como un decimal periódico y viceversa. x Un número irracional es un número decimal ilimitado no periódico. Aproximaciones de un número real En la práctica es necesario usar aproximaciones, cuando trabajamos con números con infinitas cifras decimales. Usamos aproximaciones por defecto y por exceso, truncamientos y redondeos. Todos los números reales pueden expresarse como dos secuencias de números decimales que son aproximaciones por defecto y por exceso x El error absoluto es la diferencia positiva entre el valor exacto y el valor aproximado. x El error relativo es el cociente entre el valor aproximado y el valor exacto, suele expresarse en %. x La cota de error de una aproximación es el error absoluto máximo posible. La recta real El valor absoluto de un nº a, |a| es el nº prescindiendo del signo. La distancia entre dos puntos a y b es el valor absoluto de su diferencia |a-b|=|b-a| Intervalos: segmentos y semirrectas x Intervalo cerrado [a,b] x Intervalo abierto (a,b) x Intervalo semiabierto (a,b] ó [a,b) x Intervalo no acotado como [a,+f) ó (-f,a) Todos los números reales, tanto los racionales como los irracionales, se pueden representar mediante un punto de la recta y recíprocamente, a cada punto de la recta le corresponde un número real. Números reales Notación científica Los números muy grandes o muy pequeños se expresan en notación científica: x·10n Para operar con números en notación científica aplicamos las propiedades de las potencias.
- 1742. ÁLGEBRA: NIVEL MEDIO SUPERIOR FATORIZACIÓN DE POLINIMIOS AUTOR: PROFESOR JESÚS INFANTE MURILLO EDICIÓN: PROFESOR PABLO FUENTES RAMOS 4-1 FACTORIZACIÓN DE POLINOMIOS Hemos visto el problema de encontrar el producto, dados los factores. La factorización es encontrar los factores, dado el producto. Se llaman factores de una expresión algebraica aquellos que multiplicados entre sí dan como resultado la primera expresión. Ejemplo: sí; 65xx3)2)(x(x 2 ++=++ Tenemos que, 2x + y 3)(x + son factores de 65xx 2 ++ , así pues, factorizar unaexpresión algebraica es convertirla en el producto indicado. Existen diversos procedimientos para descomponer en factores un producto, los mencionaremos, sin perjuicio de que en algunos casos podamos combinar dos o más de estos procedimientos. 1. FACTORIZACIÓN POR FACTOR COMÚN. Cuando en los diversos términos de un polinomio participa un mismo factor, se dice que se le saca como factor común, para lo cual, se escribe e inmediatamente, después, dentro de un paréntesis se anotan los cocientes que resulten de dividir cada uno de los términos del polinomio entre el factor común. Ejemplos: Factorizar los siguientes polinomios: a) 2)a(a2aa 2 +=+ b) 3ab)10b(130ab10b 2 +=+ c) )3a15a(2a15a5a10a 232 ++=++ d) )y7bxx3abx(ab5ayxb35abx15axb5a 532254222423 −+=−+ e) )7a3bb5a6ab(2abb42a18abb30ab12a 3322442332 −+−=−+− f) )5x7x2x(1x15ax75ax105ax30ax15a 322252423222 −+−=−+− g) )x3aabx2(22axx66abx22a44ax 22n2n31n2n −+−=−+− ++ h) )yyxyy(xxyxyxyx 12m1nmn1nmn2mnnm2nnnm −−+−++ −−=−−
- 1743. ÁLGEBRA: NIVEL MEDIO SUPERIOR FATORIZACIÓN DE POLINIMIOS AUTOR: PROFESOR JESÚS INFANTE MURILLO EDICIÓN: PROFESOR PABLO FUENTES RAMOS 4-2 2. FACTORIZACIÓN POR PRODUCTOS NOTABLES. Como su nombre lo indica consiste en aplicar los productos notables ya conocidos. a). Factorización de una diferencia de cuadros. Se sabe que: b)b)(a(aba 22 −+=− ; por lo tanto una diferencia de cuadrados, es igual al producto de dos binomios conjugados. Ejemplos: 1) )2y)(3x2y(3x4y9x 2242 −+=−=− 222 )(2y(3x) 2) 4ab)4ab)(5x5xb16a25x 222 −+=−=− ((4ab)(5x) 22 3) 2)2)(x4)(x(x 16x 2 4 −++= =−+=−+=−=− ](2)4)[(x)(x4)4)(x(x(4))(x 22222222 4) − −+=−= 3 y 4 x 3 y 4 x 9 y 16 x 22 22 3 y 4 x b). Factorización de un cuadrado perfecto: Del desarrollo del binomio al cuadrado se tiene: 22 b2abab)(a ++=+ 2 y también 222 b2abab)(a +−=− Una cantidad es cuadrado perfecto cuando es el cuadrado de otra cantidad, así tenemos que 2 4a es cuadrado perfecto porqué es el cuadrado de 2a . Para factorizar un trinomio cuadrado perfecto, una vez que ha sido identificado como tal, con apoyo de los productos notables, se extrae raíz cuadrada al primero y tercer termino del trinomio separándose estas raíces por medio del signo del segundo termino y elevando este binomio al cuadrado. Ejemplos: 1) 1)1)(m(m1)(m12mm 22 ++=+=++ 2) 20xy25y4x 22 −+ . Ordenando y factorizando, se tiene: 5y)5y)(2x(2x5y)(2x25y20xy4x 222 −−=−=+− 3) )8ax)(18ax(1)8ax(1x64a16ax1 2222422 −−=−=+− 4) 2y)2y)(3x(3x2y)(3x4y12xy9x 222 −−=−=+−
- 1744. ÁLGEBRA: NIVEL MEDIO SUPERIOR FATORIZACIÓN DE POLINIMIOS AUTOR: PROFESOR JESÚS INFANTE MURILLO EDICIÓN: PROFESOR PABLO FUENTES RAMOS 4-3 5) y)y)(2x(2xy)(2xy4xy4x 222 ++=+=++ 6) ++=+=++ 2 1 x 2 1 x 2 1 x 4 1 xx 2 2 7) −−=−=+− 3b 4 a 3b 4 a 3b 4 a 9bab 2 3 16 a 2 2 2 8) −−=−=+− 3 b 2 1 3 b 2 1 3 b 2 1 9 b 3 b 4 1 22 c). Factorización de una suma o diferencia de cubos. Se sabe que: )babb)(a(aba 2233 +−+=+ y )babb)(a(aba 2233 ++−=− Ejemplos: 1). Factorizar: 33 216y8x + . Llevándolo al tipo de suma de cubos tenemos: )36y12xy6y)(4x(2x216y8x 2233 +−+=+=+ 33 (6y)(2x) 2). Factorizar: 44 192xyy81x − . Llevándolo al tipo de diferencia de cubos tenemos: )16y12xy4y)(9y3xy(3x 192xyy81x 22 44 ++−= =−=−=− ](4y)3xy[(3x))64y3xy(27x 3333 3). Factorizar: 827a 3 − . Se puede ver que es una diferencia de cubos, por lo que: 4)6a2)(9a(3a827a 23 ++−=−=− 33 (2)(3a) 4). Factorizar: 1x 3 + 1)x1)(x(x1x 23 +−+=+ 5). Factorizar: 12564x 3 + . 25)20x5)(16x(4x12564x 23 +−+=+=+ 33 (5)(4x) d). Factorización de cubos perfectos de binomios. Se ha visto que: 32233 b3abb3aab)(a +++=+ y que: 32233 b3abb3aab)(a −+−=− . Ejemplos: 1) 4a)4a)(14a)(1(14a)(164a48a12a1 332 +++=+=+++
- 1745. ÁLGEBRA: NIVEL MEDIO SUPERIOR FATORIZACIÓN DE POLINIMIOS AUTOR: PROFESOR JESÚS INFANTE MURILLO EDICIÓN: PROFESOR PABLO FUENTES RAMOS 4-4 2) )6b)(a6b)(a6b(a )6b(a2116bb108ab18aa 535353 35315103569 −−−= =−=−− + 3) −−−=−=+−− 2 b 3 2a 2 b 3 2a 2 b 3 2a 2 b 3 2a 2 ab 3 2a 8 b 27 8a 32233 b 3. FACTORIZACIÓN POR AGRUPAMIENTO. Algunas veces en un polinomio los términos no contienen ningún factor común, pero pueden ser separados en grupos de términos con factor común. Este método consiste en formar grupos, los más adecuados, para factorizar cada uno como más convenga en cada caso y lograr finalmente la factorización total de la expresión. Ejemplos: Factorizar: 1) bxax5b5a +++ . Agrupando los términos que tengan algún factor común se tiene: x)b)(5(a ++=+++ b)x(ab)5(a o también x)b)(5(a ++=+++ x)b(5x)a(5 2) b)a)(x(xabbxaxx 2 ++=+++=+++ a)b(xa)x(x 3) b)y)(8a(xby)8aybx8ax −+=+−+=−+− y)b(xy)8a(x 4) 2b)x)(a(p2bp2bxaxap −+=+−+=−−+ x)2b(px)a(p 5) c)bc)(ab(a c2bcba 222 −−++= =+−=++−=−−− 22222 c)(ba)c2bc(ba 6) b)yxb)(ayx(a2by2axyxba 2222 −−+++++−+=−+−+− =22 b)(yx)(a 7) b)11)(a(a1baba 2 −−+=+−−+=−−− 1)b(a1)1)(a(a 4. FACTORIZACIÓN DE UN TRIN0MIO DE LA FORMA ax 2 + bx + c Para factorizar el trinomio 3511x6x 2 −− se procede de acuerdo al siguiente procedimiento: Primero. Se buscan dos números que al sumarlos nos den el coeficiente del termino de primer grado (- 11) y que al multiplicarlos den el producto del coeficiente del término de segundo grado (6) por el término independiente (- 35) Es decir: 11nm −=+ y 21035)6(mn −=−= Como la suma: 1121)(10 −=−+ y la multiplicación: 21021)10( −=− , resulta que: 10m = y 21n −= .
- 1746. ÁLGEBRA: NIVEL MEDIO SUPERIOR FATORIZACIÓN DE POLINIMIOS AUTOR: PROFESOR JESÚS INFANTE MURILLO EDICIÓN: PROFESOR PABLO FUENTES RAMOS 4-5 Segundo. El término de primer grado (- 11x) se descompone como la suma de mx + nx: 356x356x 22 −−+=−− 21x10x11x Tercero. Se factoriza por agrupamiento la expresión anterior: 7)5)(2x(3x 3521x10x6x 2 −+=+−+= =−−++=−−+ 5)7(3x5)2x(3x 35)21x(10x)(6x 2 Por lo que: 7)5)(2x(3x3511x6x2 −+=−− Ejemplos. 1) Factorizar: 3x14x 2 −+ . Siguiendo los pasos descritos: 1nm =+ y 42mn −= . Por lo que: m = - 6 y n = 7. Entonces: 3)1)(7x(2x 3x14x 2 −+=+−+= =+−+=−+−=−+ 1)3(2x1)7x(2x 3)(6x7x)(14x37x6x14x 22 2) Factorizar: 36x9x 2 −+ . Siguiendo el procedimiento anterior: 6nm =+ y 27mn −= . Por tanto: m = -3 y n = 9 Entonces: 3)1)(3x(3x1)3(3x1)3x(3x39x3x9x36x9x 22 +−=−+−=−+−=−+ 3) Factorizar: 1124x4x 2 +− . De acuerdo al procedimiento empleado: 24nm −=+ y 44mn −= . Por tanto: m = - 2 y n = - 22 Entonces: 11)1)(2x(2x1)11(2x1)2x(2x1122x2x4x1124x4x 22 −−=−−−=+−−=+− Para el caso del trinomio de la forma: x 2 + bx + c en donde el coeficiente del término al cuadrado vale la unidad, también se procede en la misma forma.
- 1747. ÁLGEBRA: NIVEL MEDIO SUPERIOR FATORIZACIÓN DE POLINIMIOS AUTOR: PROFESOR JESÚS INFANTE MURILLO EDICIÓN: PROFESOR PABLO FUENTES RAMOS 4-6 Ejemplos: 1) Factorizar: 127xx 2 +− . m + n = - 7 y mn = 12. Por tanto: m = - 3 y n = - 4, entonces: 4)3)(x(x3)4(x3)x(x124x3xx127xx 22 −−=−−−=+−−=+− 2) Factorizar: 1213aa 2 ++ m + n = 13 y mn = 12. Por tanto: m = 1 y n = 12 12)1)(a(a1)12(a1)a(a1212aaa1213aa 22 ++=+++=++=++ + 3) Factorizar: 145xx 2 −− . m + n = - 5 y mn = - 14.Por tanto: m = + 2 y n = - 7 7)2)(x(x2)7(x2)x(x147x2xx145xx 22 −+=+−+=−−+=−− 5. FACTORIZACIÓN POR COMPLEMENTACIÓN DEL TRINOMIO CUADRADO PERFECTO. Algunas veces se puede factorizar un trinomio de segundo grado de la forma ax 2 + bx + c,si previamente se completa con él un trinomio cuadrado perfecto, este naturalmente bajo la hipótesis de que no lo es desde un principio. Se empieza por sacar como factor común el coeficiente de x2 únicamente en los términos en las que está contenida la literal x. Posteriormente se divide entre dos al coeficiente que le haya quedado a x elevado a la primer potencia y a lo que resulta, se eleva al cuadrado, ésta es la cantidad que debe sumarse para complementar el trinomio cuadrado perfecto y restarse también inmediatamente después, para que no haya alteraciones. Ejemplos: 1) Factorizar: 1124x4x 2 +− . De acuerdo a lo indicado tenemos: 119)96x4(x 2 +−+− . Los tres primeros sumandos dentro del paréntesis forman el trinomio cuadrado perfecto. Por lo que: 2222 (5)3)][(2(x253)4(x11363)4(x −−=−−=+−− Vemos que es una diferencia de cuadrados. 11)1)(2x(2x1124x4x 2 −−=−−+−=−−+−=+− 5)65)(2x6(2x5]3)5][2(x3)[2(x
- 1748. ÁLGEBRA: NIVEL MEDIO SUPERIOR FATORIZACIÓN DE POLINIMIOS AUTOR: PROFESOR JESÚS INFANTE MURILLO EDICIÓN: PROFESOR PABLO FUENTES RAMOS 4-7 2) Factorizar: 36x9x 2 −+ . 1)3)(3x(3x 36x9x 2 −+= =−+++=−+++= =−+=−−+=−−++=−+ 2)12)(3x1(3x2 3 1 x32 3 1 x3 (2) 3 1 x331 3 1 x93 9 1 9 1 x 3 2 x9 2 22 2 3) Factorizar: 3548x16x 2 +− 7)5)(4x(4x 3548x16x 2 −−= =−−+−=−−+−= =−−=−−=+−+−=+− 1)61)(4x6(4x1 2 3 x41 2 3 x4 1 2 3 x41 2 3 x1635 4 9 4 9 3xx16 22 2 6. RAZONES Y PROPORCIONES La razón es un número abstracto que expresa sólo la relación que hay entre dos magnitudes, por lo que carece de unidades. La razón es una fracción de dos magnitudesa y b, se escribe b a , o bien, a : b y se lee: a es a b. Ejemplos: 1) Sean dos engranes A y B de 10 y 15 dientes respectivamente la razón de A a B es: 15 10 , o sea 3 2 , o bien 2:3 que se lee 2 es a 3. La razón de B a A es. 10 15 , o sea 2 3 , o bien 3:2 que se lee 3 es a 2. 2) La razón peras12 pesos60 indica que una pera cuesta pesos$5.00 12 60 = . 3) En 25 aciertos de un tirador, en 100 disparos, la razón es: 4:1o 4 1 o 100 25
- 1749. ÁLGEBRA: NIVEL MEDIO SUPERIOR FATORIZACIÓN DE POLINIMIOS AUTOR: PROFESOR JESÚS INFANTE MURILLO EDICIÓN: PROFESOR PABLO FUENTES RAMOS 4-8 Proporciones. La igualdad de dos razones se llama proporción. Cuando se aplican las razones a problemas es frecuente encontrar situaciones en que dos razones son iguales. De modo que si b a y d c representan la misma razón, resulta la proporción d c b a = , que también puede escribirse como : a : b :: c : d y a : b = c : d y se lee a es a b como c es a d”. Las cantidades a, b, c y d se llaman términos de la proporción y sin importar que expresión se use, se dice que: a y d son los extremos; b y c son los medios Por otra parte se les conoce como: a y c antecedentes b y d consecuentes Propiedades de las proporciones. 1. En toda proporción, el producto de los extremos es igual al producto de los medios. Las razones b a y d c son iguales si bcad = , propiedad fundamental. 2. En toda proporción, los medios se pueden intercambiar. Si tenemos: d c b a = resulta: d b c a = . (1) 3. En toda proporción, la suma de los dos primeros términos es al segundo, como la suma de los dos últimos es al cuarto. Partiendo de: d c b a = . Sumándole la unidad a cada razón tendremos: d dc b ba + = + ∴+=+ 1 d c 1 b a (2) 4. En toda proporción la diferencia de los dos primeros términos es al segundo, como la diferencia de los dos últimos es al cuarto; Sea la proporción: d c b a = . Restando la unidad a cada razón se tiene: d dc b ba − = − ∴−=− 1 d c 1 b a (3) 5. En toda proporción, la diferencia de los dos primeros términos es a su adición, como la diferencia de los últimos es a su adición de ellos. Igualando los cocientes de los miembros respectivos de las dos proporciones anteriores: Igualando los primeros miembros:
- 1750. ÁLGEBRA: NIVEL MEDIO SUPERIOR FATORIZACIÓN DE POLINIMIOS AUTOR: PROFESOR JESÚS INFANTE MURILLO EDICIÓN: PROFESOR PABLO FUENTES RAMOS 4-9 1 ba ba = + − ∴== + −+ = − 1 b b ba ba ; b ba b ba (a) Igualando los segundos miembros: 1 dc dc = + − ∴== + −+ = − 1 d d dc dc ; d dc d dc (b) Igualando (a) y (b), nos da: dc dc ba ba + − = + − (4) Para obtener el valor de un término desconocido en una proporción, debemos aplicar la propiedad fundamental de éstas y efectuar las operaciones necesarias. Ejemplos: 1) Encuentre el valor de x si: 5 2 15 x = . Usando la propiedad fundamental, tenemos: 302(15)5x == Despejando: 6 5 30 x == 2) Encontrar los valores de a y b, si a - b = 12; c = 3 y d = 2. De acuerdo a la propiedad (3): d dc b ba − = − . Sustituyendo: 24b =∴== − = 2 b 12; 2 1 2 23 b 12 Sabemos que a - b = 12. Sustituimos b: 36a =+=∴=− 24121224a Comprobación: Según la propiedad (1): 3 2 24 36 == ; d c b a Variación directamente proporcional. Dadas dos cantidades, si a un aumento de una corresponde un aumento de la otra, o a una disminución de una corresponde una disminución de la otra, se dice que dichas cantidades son directamente proporcionales.
- 1751. ÁLGEBRA: NIVEL MEDIO SUPERIOR FATORIZACIÓN DE POLINIMIOS AUTOR: PROFESOR JESÚS INFANTE MURILLO EDICIÓN: PROFESOR PABLO FUENTES RAMOS 4-10 Sean x, y dos cantidades que varían en forma directamente proporcional; si a x1 le corresponde el valor y1, y a x2 le corresponde y2, se cumple la igualdad: 2 1 2 1 y y x x = Para expresar que las cantidades x, y son directamente proporcionales, se escribe; y ∝∝ x De acuerdo con la definición, se cumple que k x y = , donde k, es la constante de proporcionalidad. Para determinar la constante de proporcionalidad, basta conocer los valores correspondientes de x e y. Si y toma el valor y1; cuando x toma el valor x1, se tiene: k x y 1 1 = Ejemplo: Si la velocidad de un automóvil es constante, la distancia recorrida y el tiempo son directamente proporcionales, pues a mayor distancia recorrida corresponde mayortiempo, y a menor distancia menor tiempo Si la distancia recorrida es de 300 Km en 4 horas. ¿Qué distancia se recorrerá en 7 horas?. Representando por x a la distancia y por t al tiempo, se tiene: x1 = 300, t1 = 4 y t2 = 7 Como: 2 1 2 1 t t x x = . Sustituyendo valores tenemos: 7 4 x 300 2 = Despejando: km525 4 2100 x2 ==∴= 24x(300)(7) La constante de proporcionalidad en este caso está dada por k t x = , para encontrar su valor se sustituye x1 y t1, o x2 y t2 Para: 300x1 = y 4t1 = , se tiene: km75k 4 300 == , en donde k, es la velocidaddel automóvil.
- 1752. los términos. Los números pueden factorizarse en este caso si existe máximo común divisor (MCD) entre ellos. Cómo Factorizar: Hallar el MCD, tomar las letras comunes con el menor exponente. Abrir paréntesis y dividir cada término entre el factor común (restando los exponentes). • D[ E[ [ D[E
- 1753. • E E E E
- 1754. • D[E[ [DE
- 1755. 24 – 18 2⇐ 12 – 9 2 6 – 9 2 MCD = 2 . 3 = 6 3 – 9 3⇐ 1 – 3 3 1 Caso I Especial • [D
- 1756. D
- 1757. D
- 1758. [
- 1759. Cómo Reconocer: El factor común es un conjunto entre paréntesis. Cómo Factorizar: Tomar el paréntesis común y dividir cada término entre el común • DP
- 1760. P DP
- 1761. P
- 1762. P
- 1763. D
- 1764. • [DE
- 1765. DE [DE
- 1766. DE
- 1767. DE
- 1768. [
- 1769. Caso II: Factor común por agrupación • D[E[DE D[E[
- 1770. DE
- 1771. Cómo Reconocer: Son cuatro términos, a veces son seis u ocho términos Cómo Factorizar: Formar dos grupos y factorizar cada grupo como el caso I y luego el resultado factorizar como el caso I especial. [DE
- 1772. DE
- 1773. DE
- 1774. [
- 1775. • D[ [D[ D[ [
- 1776. D[
- 1777. [ D[
- 1778. D[
- 1779. D[
- 1780. [
- 1781. Caso III: Trinomio cuadrado perfecto • D DEE DE
- 1782. Cómo Reconocer: Siempre son tres términos. El primero y el tercero siempre son positivos y tienen raíz cuadrada. Cómo Factorizar: Sacar raíz cuadrada del primero, signo del segundo y raíz cuadrada del tercero. Asociar entre paréntesis y elevar al cuadrado. • [ [ [
- 1783. • [ [ [
- 1784. prueba: [
- 1785. [ • 2 363 2 5 2 255 4 ¸ ¹ · ¨ © § −=+− y x yxy x ( ) 33 55 2 2:prueba xyy x =¸ ¹ · ¨ © § Caso III Especial D
- 1786. D
- 1787. D
- 1788. D
- 1789. Cómo Reconocer: Son tres términos con paréntesis. El primero y el tercero siempre son positivos y tienen raíz cuadrada. Cómo Factorizar: Sacar raíz cuadrada del primero, signo del segundo y raíz cuadrada del tercero. Asociar entre corchetes y elevar al cuadrado. D
- 1790. D
- 1791. @ D D @ D@ Caso IV: Diferencia de cuadrados • D ² E D ² E
- 1792. D E
- 1793. Cómo Reconocer: Siempre son dos términos que tienen raíz cuadrada, siempre es una resta Cómo Factorizar: Abrir dos pares de paréntesis: uno con menos (-) y el otro con más (+). Sacar raíz cuadrada del primero y del segundo. Repetir lo mismo en los dos paréntesis. • [ ² [
- 1794. [ ²
- 1795. • ¸ ¹ · ¨ © § +¸ ¹ · ¨ © § −=− 336 2 4 5 4 5 16 25 y x y x y x Caso IV Especial • DE
- 1796. ² F DE
- 1797. F@DE
- 1798. F@ DEF@DEF@ Cómo Reconocer: Uno o los dos términos son conjuntos entre paréntesis y que tienen raíz cuadrada, el signo afuera de los parentesis es menos (-) Cómo Factorizar: Abrir dos pares de corchetes, uno con menos [-] y el otro con más [+]. Sacar raíz cuadrada de los dos términos. Repetir lo mismo en los dos corchetes. Eliminar paréntesis y reducir términos semejantes. • [ ²
- 1799. ² ² [
- 1800. [
- 1801. ² ²[
- 1802. @ [
- 1803. ²[
- 1804. @ [ ² ² [@ [ ² ² [@ [ ² @ [ @
- 1805. 2Factor com´un En los siguientes ejercicios se usar´a la ley de la distributividad del producto respecto a la suma a(b + c) = ab + ac Pasar del lado izquierdo al derecho de la igualdad se dice: “se distribuye a” Pasar del lado derecho al izquierdo de la igualdad se dice: “se factoriza a” 2.1. Ejercicios: factor com´un Ahora procedemos a efectuar ejemplos con un factor com´un. 1. Encontrar un factor com´un en 2a + 4 Paso 1 Buscamos el factor com´un de 2a y 4. Como el factor com´un de 2a y 4 es 2, procedemos a factorizarlo: 2a + 4 = 2 · a + 2 · 2 = 2(a + 2), 2. Encontrar un factor com´un en 3b + 6 4
- 1806. 3Un binomio como factor com´un En esta serie de problemas, debemos factorizar un binomio, que sin embargo sigue la misma idea que los anteriores problemas, es decir, se aplica la ley a(b + c) = ab + ac. 3.1. Ejercicios: binomio como factor com´un 1. Factorizar x(m + n) + y(m + n) Paso 1 Buscamos el factor com´un de x(m + n) y y(m + n), como el factor com´un de x(m + n) y y(m + n) es (m + n), podemos factorizarlo. x(m + n) + y(m + n) = (m + n)(x + y). 2. Factorizar a(x − y) + b(x − y) Paso 1 Buscamos el factor com´un de a(x − y) y b(x − y), como el factor com´un de a(x − y) y b(x − y) es (x − y),podemos factorizarlo. a(x − y) + b(x − y) = (x − y)(a + b). 3. Factorizar r(m + n) − s(m + n) Paso 1 Buscamos el factor com´un de r(m + n) y s(m + n), como el factor com´un de r(m + n) y s(m + n) es (m + n), podemos factorizarlo. r(m + n) − s(m + n) = (m + n)(r − s). 9
- 1807. 4Factorizaci´on completa En esta serie de problemas, debemos de aplicar los dos tipos de factorizaci´on anteriores. 4.1. Ejercicios: factorizaci´on completa Factorizar ax + bx − ay − by ax + bx − ay − by = x(a + b) − ay − by Factorizamos a x = x(a + b) − y(a + b) Factorizamos a y = (a + b)(x − y) Factorizamos a (a + b) Factorizar 2xy + y − 6x − 3 2xy + y − 6x − 3 = y(2x + 1) − 6x − 3 Factorizamos a y = y(2x + 1) − 3(2x + 1) Factorizamos a 3 = (2x + 1)(y − 3) Factorizamos a (2x + 1) Factorizar 3mn + 15n − 4m − 20 3mn + 15n − 4m − 20 = 3n(m + 5) − 4m − 20 Factorizamos a 3n = 3n(m + 5) − 4(m + 5) Factorizamos a 4 = (m + 5)(3n − 4) Factorizamos a (m + 5) Factorizar 2a2 + 6a − 3ab − 9b 2a2 + 6a − 3ab − 9b = 2a(a + 3) − 3ab − 9b Factorizamos a 2a = 2a(a + 3) − 3b(a + 3) Factorizamos a 3b = (a + 3)(2a − 3b) Factorizamos a (a + 3) Factorizar x + y2 − 3mx − 3my2 12
- 1808. 5Diferencia de cuadrados En esta serie de problemas, aplicaremos la f´ormula de diferencia de cuadrados a2 −b2 = (a + b)(a − b). Esta f´ormula puede ser f´acilmente comprobada al realizar la operaci´on (a + b)(a − b) = a2 − ab + ba − b2 = a2 − b2 . 5.1. Ejercicios: diferencia de cuadrados 1. Factorizar a2 − b2 a2 − b2 = (a + b)(a − b) Aplicando la diferencia de cuadrados 2. Factorizar x2 − y2 x2 − y2 = (x + y)(x − y) Aplicando la diferencia de cuadrados 3. Factorizar 4a2 − 9 4a2 − 9 = (2a)2 − (3)2 Re-escribiendo = (2a + 3)(2a − 3) Aplicando la diferencia de cuadrados 4. Factorizar 9b2 − 16 9b2 − 16 = (3b)2 − (4)2 Re-escribiendo = (3b + 4)(3b − 4) Aplicando la diferencia de cuadrados 5. Factorizar 16a4 − 9b6 16a4 − 9b6 = (4a2 )2 − (3b3 )2 Re-escribiendo = (4a2 + 3b3 )(4a2 − 3b3 ) Aplicando la diferencia de cuadrados 14
- 1809. 5.1. EJERCICIOS: DIFERENCIA DE CUADRADOS 15 6. Factorizar 25x2 y4 − 4z6 25x2 y4 − 4z6 = (5xy2 )2 − (2z3 )2 Re-escribiendo = (5xy2 + 2z3 )(5xy2 − 2z3 ) Aplicando la diferencia de cuadrados 7. Factorizar 49x2 b4 − 225 49x2 b4 − 225 = (7xb2 )2 − (15)2 Re-escribiendo = (7xb2 + 15)(7xb2 − 15) Aplicando la diferencia de cuadrados 8. Factorizar 1 4 a4 − b6 1 4 a4 − b6 = ( 1 2 a2 )2 − (b3 )2 Re-escribiendo = ( 1 2 a2 + b3 )( 1 2 a2 − b3 ) Aplicando la diferencia de cuadrados 9. Factorizar 4 49 a4 b6 − 1 16 4 49 a4 b6 − 1 16 = ( 2 7 a2 b3 )2 − ( 1 4 )2 Re-escribiendo = ( 2 7 a2 b3 + 1 4 )( 2 7 a2 b3 − 1 4 ) Aplicando la diferencia de cuadrados 10. Factorizar 9 16 x2 y4 − 25 36 a6 9 16 x2 y4 − 25 36 a6 = ( 3 4 xy2 )2 − ( 5 6 a3 )2 Re-escribiendo = ( 3 4 xy2 + 5 6 a3 )( 3 4 xy2 − 5 6 a3 ) Aplicando la diferencia de cuadradosAplicando la diferencia de cuadradosAplicando la diferencia de cuadradosAplicando la diferencia de cuadradosAplicando la diferencia de cuadradosAplicando la diferencia de cuadradosAplicando la diferencia de cuadradosAplicando la diferencia de cuadradosAplicando la diferencia de cuadradosAplicando la diferencia de cuadradosAplicando la diferencia de cuadradosAplicando la diferencia de cuadradosAplicando la diferencia de cuadradosAplicando la diferencia de cuadradosAplicando la diferencia de cuadradosAplicando la diferencia de cuadradosAplicando la diferencia de cuadradosAplicando la diferencia de cuadradosAplicando la diferencia de cuadradosAplicando la diferencia de cuadradosAplicando la diferencia de cuadrados 15
- 1810. 6Trinomio cuadrado perfecto En esta serie de problemas, aplicaremos la regla de un trinomio cuadrado perfecto. Se sabe que (a + b)2 = a2 + 2ab + b2 , entonces el lado izquierdo de la igualdad se llama trinomio cuadrado perfecto, ya que se puede escribir como un cuadrado de una suma. Cada ves que detectemos un trinomio cuadrado perfecto podemos aplicar esta igualdad. Para detectar si un trinomio es cuadrado perfecto, hay que tomar un t´ermino, ver que es un cuadrado (a2 ), obtener la ra´ız (a), verificar si esta ra´ız (a) esta en otro t´ermino (2ab), en tal caso verificar solo si la mitad de al cuadrado de la parte restante (2b), es precisamente el tercer t´ermino(b2 ). 6.1. Ejercicios: trinomio cuadrado perfecto 1. Factorizar x2 − 2xy + y2 a) x2 es el cuadrado de x. b) 2xy es el t´ermino donde aparece x. c) 2y es la parte restante a x del t´ermino anterior. d) y es la mitad de esa parte restante. e) y2 es el cuadrado de esa mitad. f) y2 es en efecto, el tercer t´ermino del trinomio. Por lo tanto el trinomio es cuadrado perfecto. x2 − 2xy + y2 = (x − y)2 El “-” es debido al signo en −2xy 16
- 1811. 6.1. EJERCICIOS: TRINOMIO CUADRADO PERFECTO 17 2. Factorizar x2 + 4x + 4 a) x2 es el cuadrado de x. b) 4x es el t´ermino donde aparece x. c) 4 es la parte restante a x del t´ermino anterior. d) 2 es la mitad de esa parte restante. e) 22 = 4 es el cuadrado de esa mitad. f) 4 es en efecto, el tercer t´ermino del trinomio. Por lo tanto el trinomio es cuadrado perfecto. x2 + 4x + 4 = (x + 2)2 El “+” es debido al signo en +4x 3. Factorizar y4 − 8y2 + 16 a) y4 es el cuadrado de y2 . b) 8y2 es el t´ermino donde aparece y2 . c) 8 es la parte restante a y2 del t´ermino anterior. d) 4 es la mitad de esa parte restante. e) 42 = 16 es el cuadrado de esa mitad. f) 16 es en efecto, el tercer t´ermino del trinomio. Por lo tanto el trinomio es cuadrado perfecto. y2 − 8y2 + 16 = (y2 + 4)2 El “-” es debido al signo en −8y2 4. Factorizar 4x2 + 12x + 9 a) 4x2 es el cuadrado de 2x. b) 12x = 6 · 2x es el t´ermino donde aparece 2x. c) 6 es la parte restante a 2x del paso anterior. d) 3 es la mitad de esa parte restante. e) 32 = 9 es el cuadrado de esa mitad. f) 9 es en efecto, el tercer t´ermino del trinomio. Por lo tanto el trinomio es cuadrado perfecto. 4x2 + 12x + 9 = (2x + 9)2 El “+” es debido al signo en 12x 17
- 1812. 7Factorizaci´on de trinomios Algunos trinomios pueden ser factorizados por simple inspecci´on de sus elementos. Si observamos que (x + a)(x + b) = x2 + (a + b)x + ab. Entonces, si podemos encontrar n´umeros a, b tales que su suma sea el coeficiente de x y su producto sea el tercer t´ermino de un trinomio de la forma x2 + (a + b)x + ab, podemos aplicar la anterior observaci´on para factorizar el trinomio. 7.1. Ejercicios: factorizaci´on de trinomios 1. Factorizar x2 + 4x + 3 a) 3 y 1 suman 4, b) 3 por 1 da 3, c) Por lo tanto x2 + 4x + 3 = (x + 3)(x + 1). 2. Factorizar x2 − 4x + 3 a) −3 y −1 suman −4, b) −3 por −1 da 3, c) Por lo tanto x2 + 4x + 3 = (x − 3)(x − 1). 3. Factorizar x2 + 3x − 10 a) 5 y −2 suman 3, 21
- 1813. 7.1. EJERCICIOS: FACTORIZACI ´ON DE TRINOMIOS 22 b) 5 por −2 da −10, c) Por lo tanto x2 + 3x − 10 = (x + 5)(x − 2). 4. Factorizar x2 − 2x − 8 a) 4 y −2 suman −2, b) 4 por −2 da −8, c) Por lo tanto x2 − 2x − 8 = (x + 4)(x − 2). 5. Factorizar x2 + x − 20 a) 5 y −4 suman 1, b) 5 por −4 da −20, c) Por lo tanto x2 + x − 20 = (x + 5)(x − 4). 6. Factorizar x2 − x − 12 a) −4 y 3 suman −1, b) −4 por 3 da −12, c) Por lo tanto x2 − x − 12 = (x − 4)(x + 3). 7. Factorizar x2 + 7x + 6 a) 6 y 1 suman 7, b) 6 por 1 da 6, c) Por lo tanto x2 + 7x + 6 = (x + 6)(x + 1). 8. Factorizar x2 − 2x − 24 a) −6 y 4 suman −2, b) −6 por 4 da −24, c) Por lo tanto x2 − 2x − 24 = (x − 6)(x + 4). 22
- 1814. MATEMÁTICAS APLICADAS UNIDAD I INTRODUCCIÓN A LAS MATEMÁTICAS 1.1.- EXPONENTES Y RADICALES 1) EXPONENTES Un exponente es un valor índice que me indica el número de veces que se va a multiplicar otro valor conocido como base. El exponente se coloca arriba y a la derecha del valor base. Por ejemplo: Xn X es el valor base y “n” es el exponente am a es el valor base y “m” es el exponente h0.5 h es el valor base y 0.5 es el exponente q2/3 q es el valor base y 2/3 es el exponente b-5 b es el valor base y -5 es el exponente -27 -2 es el valor base y 7 es el exponente Obsérvese pues que la base y exponente pueden ser cualquier valor, positivo o negativo, entero o fraccionario. Al conjunto de base y exponente también se le conoce como potencia, es decir, una potencia esta constituida de una base y un exponente. De los ejemplos anteriores: Xn es una potencia de base X y exponente n am es una potencia de base a y exponente m b-5 es una potencia de base b y exponente -5 Para la operación con potencias se deben seguir ciertas leyes, entre las más importantes destacan: Leyes de los exponentes 1) Producto de dos potencias de la misma base: cuando se multiplican dos potencias de la misma base, una forma de simplificar la operación es utilizar la misma base y sumar los exponentes. Por ejemplo: (xn ) (xm )= xn+m (h5 ) (h2 )= h5+2 = h7 a2/4 x a3/4 = a5/4 b-6 x b-3 = b-9 M.C. JESÚS ENRIQUE LÓPEZ AVENDAÑO PAGINA 1
- 1815. MATEMÁTICAS APLICADAS UNIDAD I INTRODUCCIÓN A LAS MATEMÁTICAS 2) Cociente de dos potencias de la misma base: cuando se dividen dos potencias de la misma base, una forma de simplificar la operación es utilizar la misma base y restar los exponentes. Por ejemplo: mn m n x x x − = 325 2 5 hh h h == − 336)3(6 3 6 −+−−−− − − === bbb b b 4 1 4 3 4 2 4/3 4/2 −− == aa a a 3) La potencia de una potencia: Se tiene una potencia elevada a otro exponente, en este caso se utiliza la base de la potencia y los exponentes se multiplican, por ejemplo: (xn )m = x nm (52 )4 = 52x4 = 58 = 390, 625 (8-2 )-3 = 8-2x-3 = 86 = 262,144 (a4 )5 = a4x5 = a20 (h2/5 )1/2 = h (2/5 x1/2) = h2/10 4) La potencia del producto de dos factores: el resultado se obtiene elevando cada factor al mismo exponente de la potencia y realizando la multiplicación correspondiente, por ejemplo: (xy)2 = (x2 )(y2 ) (5x)3 = (53 )(x3 ) = 125 x3 (a2 b)2 = (a2 )2 (b2 ) = (a2x2 )(b2 ) = a4 b2 5) La potencia del cociente de dos factores: el resultado se obtiene elevando cada factor al exponente correspondiente y realizando la división necesaria, por ejemplo: M.C. JESÚS ENRIQUE LÓPEZ AVENDAÑO PAGINA 2
- 1816. MATEMÁTICAS APLICADAS UNIDAD I INTRODUCCIÓN A LAS MATEMÁTICAS 2 22 y x y x =» ¼ º « ¬ ª 3 33 33 125 12555 − ===»¼ º «¬ ª x xxx ( ) 24 2 4 2 2222 − ===» ¼ º « ¬ ª ba b a b a b a 6.- Potencia de exponente igual a cero: cualquier base elevada a la cero es igual a 1, por ejemplo: X0 = 1 -b0 = 1 -20 = 1 -(2/3)0 = 1 1 02 =» ¼ º « ¬ ª b a 7.- Potencia de exponente igual a uno: cualquier base elevada a la uno es igual al mismo valor de la base, por ejemplo: » ¼ º « ¬ ª =» ¼ º « ¬ ª b a b a 212 x1 = x (a2 )1 = a2 (-5)1 = -5 » ¼ º « ¬ ª =» ¼ º « ¬ ª 3 2 1 3 2 b ax b ax M.C. JESÚS ENRIQUE LÓPEZ AVENDAÑO PAGINA 3
- 1817. MATEMÁTICAS APLICADAS UNIDAD I INTRODUCCIÓN A LAS MATEMÁTICAS 8.- Exponentes negativos: si existe una potencia con exponente negativo, éste puede hacerse positivo de la siguiente manera, si la potencia con exponente negativo se encuentra en el numerador, ésta se pasa al denominador con exponente positivo; y si la potencia con exponente negativo se encuentra en el denominador, ésta se pasa al numerador con exponente positivo. Por ejemplo: 2 2 2 2 x x =− 32 3 2 xy x y =− 1728)27)(64()3)(8( 3 8 32 3 2 ===− 9.- Exponentes fraccionarios: Los exponentes fraccionarios se encuentran ligados a los radicales de la siguiente manera: m nm n xx = 7995.599 5 45 4 == 3 23 2 xx = DD =2 1 33 1 aa = 8 58 5 RR = 2) RADICALES La radicación es la operación inversa a la potenciación. Se llama raíz enésima de un número “x” a otro número “y”, que elevado a la “n” da como resultado “x”. yxxy nn =Ÿ= yxn = n = índice x = radicando y = raíz = signo radical M.C. JESÚS ENRIQUE LÓPEZ AVENDAÑO PAGINA 4
- 1818. MATEMÁTICAS APLICADAS UNIDAD I INTRODUCCIÓN A LAS MATEMÁTICAS a) Equivalencias entre radicales y potencias de exponente fraccionario m n m n aa = b) Potencia de un radical ( ) m n m n n m aaa == c) Raíz de un radical nmnmn m aaa 1 == Ejercicios: 2 3 5 x x x = 5 10 15 y y y = 2 3 5 )1( )1( )1( i i i += + + xy yx yx =2 23 123 16)2( aa = 4 62 2 3 y x y x =» ¼ º « ¬ ª ( ) xy yx yx xy xy 8 8 )( 2 22 33 2 3 == m nm n xx = 33 13 2 2 1 yyy ==¸ ¸ ¹ · ¨ ¨ © § nn yy = 1 3 23 2 6464 = 3 3 1 3 1 27 1 27 1 27 == − Resuelva los siguientes ejercicios: 1.- Calcule el diámetro de una tubería si el área de la circunferencia es de 0.05 m2 , considere que la ecuación para el área es la siguiente: 4 2 D A π = π A D 42 = m A D 25.0 )05.0(44 === 1416.3π M.C. JESÚS ENRIQUE LÓPEZ AVENDAÑO PAGINA 5
- 1819. MATEMÁTICAS APLICADAS UNIDAD I INTRODUCCIÓN A LAS MATEMÁTICAS 2.- Calcule el valor de la velocidad del agua, considerando que las pérdidas por fruición son de 0.5 m (recuerde que la aceleración por gravedad es igual a 9.8 m/s2), utilice la siguiente ecuación: g v khf 2 2 = k hfg v **22 = s ms mm s m k hfg v 26.6 25.0 8.9 25.0 5.08.92 **2 2 2 2 == ¸ ¹ · ¨ © § ¸ ¹ · ¨ © § == 3.- Despeje el valor del radio hidráulico (r) en la siguiente ecuación para calcular la velocidad de un flujo de agua: 2 1 3 2 1 sr n v = 2 1 3 2 * s nv r = 2 3 2 1 2 3 2 1 ** ¸ ¸ ¹ · ¨ ¨ © § =¸ ¸ ¹ · ¨ ¨ © § = s nv s nv r 1.2.- RAZONES Y PROPORCIONES Al cociente entre dos números se le llama “razón” y a la igualdad de dos razones se le llama proporción. Una razón puede denotarse de las siguientes formas: “a” es a “b” a : b a/b donde “a” y “b” se llaman términos de la razón. Ejemplo En una granja de puercos existen 11 cerdos machos y 15 hembras: a) encuentre la razón de los machos respecto a las hembras b) encuentre la razón de las hembras respecto al total a) 11 es a 15 11:15 11/15 b) 15 es a 26 15:26 15/26 M.C. JESÚS ENRIQUE LÓPEZ AVENDAÑO PAGINA 6
- 1820. MATEMÁTICAS APLICADAS UNIDAD I INTRODUCCIÓN A LAS MATEMÁTICAS Una proporción es un tipo especial de ecuación que enuncia la igualdad entre dos razones, se puede escribir así: a:b = c:d “a” es a “b” como “c” es a “d” a/b = c/d Para evaluar una proporción se usa la multiplicación en cruz: Si d c b a = entonces ad = bc A y d se conocen como externos, mientras que b y c se conocen como medios. El producto de los medios es igual al producto de los externos. Las razones y proporciones se aplican en: a) La regla de tres b) La regla de la tortilla Regla de tres Si se conocen tres de los cuatros valores que aparecen en una proporción se puede encontrar el cuarto valor con facilidad. Ejercicio No. 1.- Determinar el valor de x en la siguiente proporción: 15 25 3 = x De acuerdo con el procedimiento para evaluar una proporción, la operación quedaría: Se multiplica cruzado (x)(15) = (3)(25) 15 x = 75 x = 75/15 =5 Ejercicio No. 2.- Si 0.454 kg es igual a 1 libra M.C. JESÚS ENRIQUE LÓPEZ AVENDAÑO PAGINA 7
- 1821. MATEMÁTICAS APLICADAS UNIDAD I INTRODUCCIÓN A LAS MATEMÁTICAS a) determinar el peso en libras de un lechón que pesa 7.5 kg x libra kg kg 1 5.7 454.0 = Se multiplica cruzado (0.454)(x) = (7.5)(1) 0.454 x = 7.5 x = 7.5/0.454 = 16.52 libras el lechón pesa 16.52 libras b) si un cerdo pesa 121 libras ¿A cuántos kilogramos es equivalente? libras libra x kg 121 1454.0 = Se multiplica cruzado (0.454)(121) = (1)(x) 54.934 = x 121 libras = 54.934 kg Ejercicio No. 3.- Un costal de 30 libras de fertilizante se utiliza para un lote de 2500 pies cuadrados a) ¿Cuántas libras se necesitan para cubrir un área de 16000 pies cuadrados? cuadradospies cuadradospies x libras 16000 250030 = Se multiplica cruzado (30)(16000) = (2500) (x) M.C. JESÚS ENRIQUE LÓPEZ AVENDAÑO PAGINA 8
- 1822. MATEMÁTICAS APLICADAS UNIDAD I INTRODUCCIÓN A LAS MATEMÁTICAS 480,000 = 2500 x x = 480000/2500 = 192 Se requieren 192 libras b) ¿Cuántos costales se necesitan? libras libras x tal 192 30cos1 = Se multiplica cruzado (1)(192) = (30)(x) 192 = 30 x x = 192/30 = 6.4 Se necesitan 6.4 costales Ejercicio No. 4.- Las instrucciones en una botella de insecticida dice “usar 5 ml de insecticida por cada galón de agua”, si el tanque de aplicación tiene una capacidad de 20 litros (1 galón = 3.785 lt), calcular cuanto insecticida debe aplicarse a un tanque. litros lt x ml 20 785.35 = Se multiplica cruzado (5)(20) = (3.785)(x) 100 = 3.785 x x = 100/3.785 = 26.4 Se necesitan 26.4 ml de insecticida M.C. JESÚS ENRIQUE LÓPEZ AVENDAÑO PAGINA 9
- 1823. MATEMÁTICAS APLICADAS UNIDAD I INTRODUCCIÓN A LAS MATEMÁTICAS Ejercicio No. 5.- Realice las siguientes conversiones de un sistema de unidades a otro. a) 520 millas a kilómetros (1 milla = 1.609 km) b) 28 centímetros a pulgadas (1 pulg = 2.54 cm) c) 16 pies a metros (1 pie = 0.3048 m) d) 8.5 metros a centímetros (1 m = 100 cm) e) 48 pulgadas a centímetros f) 8 galones a litros (1gal = 3.785 lt) Ejercicio No. 6.- Si 4 tractores terminan un trabajo en 10 días ¿en cuantos días lo harán 6 tractores? Ejercicio No. 7.- En una parcela experimental se siembra maíz en 2 hectáreas. Si se cosecha una superficie muestra en 200 m2 con una producción de 160 kg ¿Cuál será la producción en la superficie total? 1.3.- PORCENTAJES Es la relación de un número cualquiera con respecto a otro, de lo que se obtiene una fracción, que al multiplicar por cien se obtiene el porcentaje. Ejercicio No. 1.- De una parcela de 20 hectáreas se cosechan únicamente 18 ha ¿Qué porcentaje representa la superficie cosechada? 9.0 20 18 = forma de fracción %901009.0 20 18 == x forma porcentual Ejercicio No. 2.- Un agricultor tiene 200 ha, piensa sembrar diferentes cultivos, determine que porcentaje representa la superficie de cada cultivo. Maíz = 50 ha Frijol = 30 ha Tomate = 80 ha Chile = 40 ha Total = 200 ha %25100 200 50 == xMaíz %15100 200 30 == xFrijol M.C. JESÚS ENRIQUE LÓPEZ AVENDAÑO PAGINA 10
- 1824. MATEMÁTICAS APLICADAS UNIDAD I INTRODUCCIÓN A LAS MATEMÁTICAS %40100 200 80 == xTomate %20100 200 40 == xChile La suma total de porcentajes debe ser igual a 100% Ejercicio No. 3.- El garbanzo tiene un rendimiento de 2 ton/ha, si con buenas prácticas de cultivo se incrementa el rendimiento en 0.5 ton/ha ¿en que porcentaje se incrementó el rendimiento? %25100 2 5.0 =x el rendimiento se incrementó en un 25% Ejercicio No. 4.- El sorgo en temporal tiene un rendimiento de 3.5 ton/ha, si con el riego se incrementa el rendimiento en 80% ¿Cuál sería el nuevo rendimiento? haton /8.28.0*5.3 = el incremento es de 2.8 ton/ha que sumados a los 3.5 anteriores, el nuevo rendimiento es de 6.3 ton/ha. Una forma para obtener el resultado directamente, es multiplicar el rendimiento anterior por 1.80 3.5 x 1.80 = 6.3 Si el incremento fuera del 20% entonces sería 3.5 x 1.20 = 4.2 ton/ha Si el incremento fuera del 45% entonces sería 3.5 x 1.45 = 5.075 ton/ha Si el incremento fuera del 10% entonces sería 3.5 x 1.10 = 3.85 ton/ha Ejercicio No. 5.- El cultivo de garbanzo tiene un rendimiento promedio de 2 ton/ha, si una infección de rabia de garbanzo reduce el rendimiento en un 20%, ¿cual será el nuevo rendimiento? haton /4.02.0*2 = la disminución es de 0.4 ton/ha que restados a los 2 ton/ha del rendimiento anterior, el nuevo rendimiento es de 1.6 ton/ha. Ejercicio No. 6.- La recomendación para usar un fungicida dice que el producto se debe aplicar en una solución al 5%, si el tanque fumigador es de 20 litros ¿Qué cantidad de fungicida se debe agregar a la solución en un tanque? (20)(0.05) = 1 litro de fungicida para los 20 litros de solución M.C. JESÚS ENRIQUE LÓPEZ AVENDAÑO PAGINA 11
- 1825. ÁLGEBRA: NIVEL MEDIO SUPERIOR DEFINICIONES BÁSICAS, EXPONENTES Y RADICALES AUTOR: PROFESOR JESÚS INFANTRE MURILLO EDICIÓN: PROFESOR PABLO FUENTES RAMOS 2-1 DEFINICIONES BÁSICAS, EXPONENTES Y RADICALES 1. TERMINOLOGÍA Y NOTACIÓN A partir de los conocimientos de aritmética, se desarrollará un lenguaje mediante símbolos y términos, para elaborar una serie de técnicas de cálculo; el lenguaje y las técnicas, constituyen una rama importante de la matemática, el álgebra elemental, que estudia la cantidad, considerada del modo más general. Los métodos algebraicos usan letras para representar números indeterminados o incógnitas, en esto radica gran parte de la superioridad del álgebra sobre la aritmética. Notación algebraica Los símbolos usados en álgebra para representar cantidades son números y literales. Los números se emplean para representar cantidades conocidas mientras que las letras se emplean para representar toda clase de cantidades ya sean conocidas o desconocidas. Generalmente las cantidades conocidas se representan por las primeras letras del alfabeto y las desconocidas por las últimas letras del mismo. Fórmula algebraica Es la representación, por medio de letras, de una regla o un principio general. Signos del álgebra. Los signos utilizados en álgebra son de tres clases: operación, relación y agrupación. SIGNOS DE OPERACIÓN. En álgebra se verifican con las cantidades las mismas operaciones que en aritmética:suma, resta, multiplicación, división, elevación de potencias y extracción de raíces. Los signos que se utilizan para dichas operaciones son: a). Para la suma (+) b). Para la sustracción (-) c). Para la multiplicación (x) También en lugar del signo (x), suele colocarse un punto (.) entre los factores y a veces se indica entre paréntesis a los factores. Entre los factores literales, o entre un factor literal y uno numérico el signo normalmente se omite. d). Para la división (÷÷) También se indica la división separando el dividendo del divisor mediante una raya (-) horizontal. e). Elevación a potencia.
- 1826. ÁLGEBRA: NIVEL MEDIO SUPERIOR DEFINICIONES BÁSICAS, EXPONENTES Y RADICALES AUTOR: PROFESOR JESÚS INFANTRE MURILLO EDICIÓN: PROFESOR PABLO FUENTES RAMOS 2-2 El signo de elevación a potencia es el exponente, colocado arriba y a la derecha de una cantidad, el cual indica las veces que dicha cantidad llamada base, se toma como factor, cuando una letra o cantidad no tiene exponente, su exponente será la unidad. f). Extracción de raíces. El signo de raíz es n , llamado radical y dentro de él se escribe la cantidad a la cual se le extraerá raíz, esta cantidad recibe el nombre de subradical y la (n) recibe el nombre de índice del radical. signos de relación En álgebra hay tres signos que sirven para relacionar a las cantidades: 1. = igual a 2. mayor que 3. menor que Signos de agrupación Entre los signos de agrupación tenemos: 1. ( ) Paréntesis Circular 2. [ ] Paréntesis Rectangular o Corchetes 3. { } Llaves 4. || Barra o Vínculo EXPRESIÓN ALGEBRAICA. En el álgebra aparecen frecuentemente ciertas formas simbólicas llamadas expresiones algebraicas, en ellas se combinan de alguna manera números, letras, signos de agrupación y de operación. DEFINICIÓN: Una expresión algebraica es una combinación de un número limitado de variablesy números enlazados por signos de operación y en ocasiones por signos de agrupación. Ejemplos de expresiones algebraicas: 1). 3 48b5a 6). Pb6ab6ab5a 524334 =−− 2). cb)(a ++ 7). 2a 4acb x 2 −±− = b 3). 8A3xy5x 3 +− 8). 22R32R −−− 4). 32 2 wy w)5x(y + + 9). 3 ðh 3 4 V = 5). yx 1 yx 1 + + + 10). Rr)rðh(R 3 1 V 22 ++= Término algebraico Es una expresión algebraica que consta de uno o varios símbolos, no separados
- 1827. ÁLGEBRA: NIVEL MEDIO SUPERIOR DEFINICIONES BÁSICAS, EXPONENTES Y RADICALES AUTOR: PROFESOR JESÚS INFANTRE MURILLO EDICIÓN: PROFESOR PABLO FUENTES RAMOS 2-3 entre sí, por los signos positivo (+) o negativo (-). Ejemplos: a). 2 48b5a b). x (ab)c Los elementos de un término son: 1) El coeficiente. En forma general, podemos decir, que en el producto de dos factores, cualquiera de ellos se puede tomar como coeficiente del otro. Ejemplo: En 4xy, 4 es coeficiente de xy, x es coeficiente de 4y, y es coeficiente de 4x y 4y es coeficiente de x. En general dado un término (monomio) siempre se puede distinguir el coeficiente numérico y el coeficiente literal. El coeficiente numérico es el que se tiene en el producto de una cantidad numérica por una o varias letras. Ejemplos: En 4xy, 4 es el coeficiente numérico. En xy 3 4 , 3 4 es el coeficiente numérico. Cuando un término (cantidad) no tiene coeficiente, éste valdrá la unidad. Ejemplo: En V 3 W, se entiende que el coeficiente numérico es la unidad. Coeficiente Literal, es el que se tiene, cuando existe un producto de literales, de modo tal que, cualquiera letra puede ser coeficiente de la(s) otra(s). Ejemplo: En ab, a es coeficiente literal de b y b es el coeficiente literal de a. Es común llamar simplemente coeficiente al coeficiente numérico. 2) El signo. El signo, serán cantidades positivas aquellas que vayan precedidas de un signo (+), y negativas, las que vayan precedidas de un signo (-). Los términos que no vayan precedidos de un signo se tomarán como positivo (+). 3) La parte literal o base. La base o parte literal, la constituyen las letras que existan en el término. Ejemplo: En 5a2 bc3 , la parte literal es a2 bc3 . 4) El grado. El grado de un término puede ser de dos clases, absoluto y con relación a una letra.
- 1828. ÁLGEBRA: NIVEL MEDIO SUPERIOR DEFINICIONES BÁSICAS, EXPONENTES Y RADICALES AUTOR: PROFESOR JESÚS INFANTRE MURILLO EDICIÓN: PROFESOR PABLO FUENTES RAMOS 2-4 El absoluto; es la suma de los exponentes de sus factores literales que contiene. Ejemplo: Término Grado 4a 1ro 3ab 211 5x2 y 311 -x 4 yz 2 711 8x4 y3 z5 1211 Con relación a una letra es simplemente el exponente con que aparece dicha letra. Ejemplos: 1) El grado de 3a2 b3 con relación de a es 211 , con relación a b es 311 . 2) El grado de 16x 3 y 4 z con respecto a x es 311 ; con respecto a y es 411 y con respecto a z es 111 . Clases de términos 1. Término entero: Es aquel que no tiene divisor o denominador literal. Ejemplos: 22 b3a , 3 4a , 10 b5a 2 2. Término fraccionario: Es aquel que tiene un divisor o denominador literal. Ejemplos: 3b 4ax , x 5 , yx 1 + 3. Término racional: Es aquel que no tiene radical. Ejemplos: 4a , 3 x 1 , 4 5p 4. Término irracional: Es aquel que contiene radical. Ejemplos: 4ab , x1+ , 3 4 y 5. Términos homogéneos: Son aquellos que tienen el mismo valor absoluto en grado. Ejemplo: 32 bc3a y xw5z 4
- 1829. ÁLGEBRA: NIVEL MEDIO SUPERIOR DEFINICIONES BÁSICAS, EXPONENTES Y RADICALES AUTOR: PROFESOR JESÚS INFANTRE MURILLO EDICIÓN: PROFESOR PABLO FUENTES RAMOS 2-5 6. Términos heterogéneos: Son aquellos que no tienen el mismo grado absoluto. Ejemplos: bca 2 y xwz 4 CLASIFICACIÓN DE LAS EXPRESIONES ALGEBRAICAS 1. Monomio: Es una expresión algebraica que consta de un sólo término. Ejemplos: bca 2 , xwz 4 , 30 4ax , y2x 2 − , c 3 1 2. Binomio: Es una expresión algebraica que consta de dos términos. Ejemplos: 3 y x 4 + , y5xx 2 − , 2x 1 yx + ++ , ba + , yx − 3. Trinomio: Es una expresión algebraica que consta de tres términos. Ejemplos: yxa −+ , 5x2xx 23 ++ , 2x 4 1 5x 43 −− 4. Polinomio: Son aquellas expresiones algebraicas que constan de más de un término. Ejemplos: ba + , yxa −+ , x 7x2xx 23 +++
- 1830. ÁLGEBRA: NIVEL MEDIO SUPERIOR DEFINICIONES BÁSICAS, EXPONENTES Y RADICALES AUTOR: PROFESOR JESÚS INFANTRE MURILLO EDICIÓN: PROFESOR PABLO FUENTES RAMOS 2-6 GRADO DE UN POLINOMIO Puede ser absoluto o con relación a una letra. a) Grado absoluto de un polinomio. Cada uno de los términos (monomio) de un polinomio tiene asignado un grado, se tomará el mayor de los grados de los términos. Ejemplos: 3xx5xx 234 −+− Es de cuarto grado. 325423 y6xy8xy2x +− Es de noveno grado. 25x − Es de primer grado. 22 y2xyx ++ Es de segundo grado. b) Grado con relación a una letra. Cuando se tiene varias literales, puede obtenerse el grado con respecto a una de ellas y será la que tenga el mayor exponente en el polinomio, como se indica a continuación. Ejemplos: 1) a 6 + a 4 x 2 - a 2 x 4 , es de sexto grado en relación de la letra a y de cuarto grado con respecto a la letra x. 2) 2x 3 y 2 - 8x 4 y 5 + 6x 2 y 3 , es de cuarto grado con respecto a x y de quinto grado con respecto a y. 3) x3 + 3x2 y3 , es de tercer grado con respecto a x y de tercer grado con respecto a y. CLASES DE POLINOMIOS. a) Polinomio Entero. Es cuando ninguno de sus términos contiene literales en divisores o denominadores. b) Polinomio fraccionario. Es cuando alguno de sus términos tiene divisor o denominador literal. c) Polinomio Racional. Ninguno de sus términos tiene signo radical. d) Polinomio Irracional. Alguno de sus términos tiene un signo radical. e) Polinomio Homogéneo. Es aquel, en el cual todos sus términos tiene el mismo grado absoluto. f) Polinomio Heterogéneo. Es aquel, en el que al menos uno de sus términos no tiene el mismo grado absoluto. g) Polinomio Completo. Es aquel que contiene todos los exponentes sucesivos en orden descendente; desde el más alto hasta el más bajo que tenga la letra en el polinomio. Ejemplo:
- 1831. ÁLGEBRA: NIVEL MEDIO SUPERIOR DEFINICIONES BÁSICAS, EXPONENTES Y RADICALES AUTOR: PROFESOR JESÚS INFANTRE MURILLO EDICIÓN: PROFESOR PABLO FUENTES RAMOS 2-7 x 5 + x 4 - x 3 + x 2 - 3x h) Polinomio Ordenado con relación a una letra. Es aquel en el cual los exponentes de una letra escogida, llamada ordenatriz van aumentando o disminuyendo. Ejemplo: a 5 - 2a 4 b + 6a 3 b 2 - 5a 2 b 3 + 3ab 4 - b 5 i) Término independiente de un polinomio con respecto a una letra. Es aquel que no contiene a dicha letra, es decir, es el que está constituido por un número real. Ejemplos: 1) a3 + a2 + 3a - 5 ; el término independiente es -5 2) a3 - b3 + 5a2 b 4 7 + ; El término independiente es 4 7 EJERCICIOS. 1. Establezca qué clase de términos son los siguientes atendiendo al signo, si tiene o no denominador y si tiene o no radical. Término Solución a) 5a2 Es positivo, entero, racional. b) - 4a3 b Es negativo, entero, racional. c) 3 2a Es positivo, entero, racional. d) a 6 5b 2 − Es negativo, entero, irracional. e) 3 2 5b− ; Es negativo, entero, irracional. f) 6 a ; Es positivo, entero, irracional. g) b b4a 32 − ; Es negativo, fraccionario, irracional.
- 1832. ÁLGEBRA: NIVEL MEDIO SUPERIOR DEFINICIONES BÁSICAS, EXPONENTES Y RADICALES AUTOR: PROFESOR JESÚS INFANTRE MURILLO EDICIÓN: PROFESOR PABLO FUENTES RAMOS 2-8 2. Indique el grado absoluto de los siguientes términos: Término Solución a) 5a Primer grado. b) -6a2 b Tercer grado. c) a 2 b 2 Cuarto grado. d) -5a3 b4 c Octavo grado. e) 8x 5 x 6 Onceavo grado. f) 4m2 n3 Quinto grado. g) -xyz 5 Séptimo grado. 3. Escriba el grado de cada uno de los siguientes términos con respecto a cada uno de los factores literales. Término Soluciones a) -a3 b3 a: 3er grado; b: 211 grado b) -5x 4 y 3 x: 411 grado; y: 311 grado c) 6a 2 bx 3 a: 211 grado; b: 1 er grado; x: 3 er grado d) -4abcy 2 a: 1 er grado; b: 1 er grado; c: 1 er grado; y: 211 grado e) 10m 2 n 3 b 4 c 5 m: 211 grado; n: 3 er grado; b: 411 grado; c: 511 grado 4. En los siguientes términos escoger cuatro homogéneos y cuatro heterogéneos. Término Solución a) -4a 3 b 2 homogéneos. b) 6ab 3 heterogéneos. c) -x 5 homogéneos. d) 6x 4 y homogéneos. e) -2a 3 x 4 heterogéneos. f) -ab 5 heterogéneos. g) 4abcx 2 homogéneos. h) Q 3 b 5 c 2 x heterogéneos. 5. Escriba: Solución a). Dos términos enteros: 21 7xy ; 2 5ac 22 b). Dos términos fraccionarios: 20x 40ac ; 2c b4a 2 c). Dos términos enteros, positivos, racionales: 5 b9x ; 3 2a 3 d). Dos términos negativos, fraccionarios e irracionales: xy xyz4 ; a b6ab −− 6. Escriba un término de los siguientes grados absolutos. Término Solución a) 3 er grado 3a 2 m b) 511 grado -4a4 b c) 1111 grado 6abcd 5 x 3
- 1833. ÁLGEBRA: NIVEL MEDIO SUPERIOR DEFINICIONES BÁSICAS, EXPONENTES Y RADICALES AUTOR: PROFESOR JESÚS INFANTRE MURILLO EDICIÓN: PROFESOR PABLO FUENTES RAMOS 2-9 d) 1511 grado 7a 2 b 2 c 3 d 3 e 5 e) 2011 grado 10a5 b5 c3 d7 7. Diga el grado absoluto de los siguientes polinomios. Término Solución a) x3 + x2 + x 311 grado b) x 5 - 6x 4 y 3 - 4a 2 b - x 2 y 4 - 3y 6 711 grado 8. Atendiendo a si tiene o no denominador literal y a si tiene o no radical diga, de qué clase son los siguientes polinomios. Término Solución a) a 2 a 3 a 2 a 234 −+− Entero, racional b) d2cba +−+ Entero, irracional c) b 4 6b 2 a 4a +−+ Fraccionario, irracional 9. Escribir: Término Solución. a) Un polinomio de 3er grado absoluto: 3a2 b + 2a - 5b b) Un polinomio de 1511 grado absoluto: 3a10 b5 - 5x2 y3 + 6a4 c) Un trinomio de 211 grado con respecto a x : x2 + 2x - xy 10. En los siguientes polinomios decir cuales son completos y con respecto a que letra. Término Solución a) a4 - a2 + a - a3 completo con respecto a a b) 5x4 - 8x2 + x - 6 completo con respecto a x c) x4 y - x3 y2 + x2 y3 - y4 completo con respecto a y d) m 5 - m 4 + m 3 - m + 5 completo con respecto a m e) y 5 - by 4 + b 2 y 3 - b 3 y 2 + b 4 y completo con respecto a y y b 11. Ordenar los siguientes polinomios en orden descendente. Término Solución a) m2 + 6m - m3 + m4 m4 - m3 + m2 + 6m b) a 2 b 3 + a 4 b + a 3 b 2 - ab 4 a 4 b + a 3 b 2 + a 2 b 3 - ab 4 c) -x 8 y 2 + x 10 + 3x 4 y 6 - x 6 y 4 + x 2 y 8 x 10 - x 8 y 2 - x 6 y 4 + 3x 4 y 6 + x 2 y 8
- 1834. ÁLGEBRA: NIVEL MEDIO SUPERIOR DEFINICIONES BÁSICAS, EXPONENTES Y RADICALES AUTOR: PROFESOR JESÚS INFANTRE MURILLO EDICIÓN: PROFESOR PABLO FUENTES RAMOS 2-10 VALOR NUMÉRICO DE UNA EXPRESIÓN ALGEBRAICA Al proceso para determinar el número representado por una expresión algebraica, cuando se asignan valores específicos a sus literales se le llama evaluación de la expresión; el número obtenido de la evaluación se conoce como valor numérico de la expresión algebraica. Ejemplos 1) Calcular el valor numérico de cada expresión para los valores asignados a las literales. a) 3a b e) acb pnm b) 5a2 b3 c f) pn24m 32 c) b 2 mn g) 3 2 12bc4m d) 324 mba 3 2 h) 2 3 c 3 2 b 4 3 En donde: a = 1, b = 2, c = 3, m = 2 1 , n = 3 1 y p = 4 1 SOLUCIÓN Substituyendo en cada una de las expresiones dadas tenemos: a) 3(1) (2) = 6 b) 5(1)2 (2)3 (3) = (5) (1) (8) (3) = 120 c) 3 2 6 4 3 1 2 1 4 3 1 2 1 (2) 2 === d) 3 1 24 8 8 1 (1)(4) 3 2 2 1 (2)(1) 3 2 3 24 === e) 432 1 4 1 27 1 4 1 4 1 3 1 2 1 32 == f) 18 1 432 24 4 1 27 1 4 1 24 4 1 3 1 2 1 24 32 === g) 122(6)(24)(9)2(12)(2)(3) 2 1 4 33 2 === h) 1 72 72 18x4 24x3 3 18 3 24 (9) 3 2 (8) 4 3 (3) 3 2 (2) 4 3 2 3 ===== 2) Dada la expresión: x 3 +5x 2 y 2 - 2 (x - 3y), calcular para 2 1 x = e 3 1 y −=
- 1835. ÁLGEBRA: NIVEL MEDIO SUPERIOR DEFINICIONES BÁSICAS, EXPONENTES Y RADICALES AUTOR: PROFESOR JESÚS INFANTRE MURILLO EDICIÓN: PROFESOR PABLO FUENTES RAMOS 2-11 SOLUCIÓN Substituimos dichos valores y tenemos: 72 197 −= −+ =−+= =−+=+−+=−−−−+ 72 216109 3 36 5 8 1 2 3 2 26 5 8 1 1 2 1 2 9 1 4 1 5 8 1 3 1 3 2 1 2 3 1 2 1 5 2 1 223 3) Dada la expresión: 22 yx y 1 x 1 − + , calcular para x =-2 y y = 5 SOLUCIÓN Sustituyendo se tiene: 70 1 == − − = − − = − +− = −− + − 7(10) 1 21)(10)( 3 21 10 3 254 10 25 (5)2) 5 1 2 1 22 ( 4) Dada la siguiente expresión: b)a)(c(c 1 c)a)(b(b 1 c)b)(a(a 1 −− + −− + −− , calcular para: a = -3, b = 1 y c = 2 1 . SOLUCIÓN Sustituyendo se tiene: 0== −+ =−+= − ++= = − ++ −− = −+ + −+ + −−−− 14 0 14 871 7 4 2 1 14 1 4 7 1 2 4 1 2 28 1 2 1 2 7 1 2 1 4 1 2 7 4)( 1 1 2 1 3 2 1 1 2 1 13)(1 1 2 1 31)3( 1 5) Calcular el valor de x, a partir de la formula: 2a 4acbb x 2 −±− = , si a = 3, b = 8 y c = - 3 SOLUCIÓN Sustituyendo se tiene: 6 108 6 1008 6 36648 2(3) 3)4(3)(88 x 2 ±− = ±− = +±− = −−±− = De donde:
- 1836. ÁLGEBRA: NIVEL MEDIO SUPERIOR DEFINICIONES BÁSICAS, EXPONENTES Y RADICALES AUTOR: PROFESOR JESÚS INFANTRE MURILLO EDICIÓN: PROFESOR PABLO FUENTES RAMOS 2-12 3 1 6 108 x1 = +− = y 3 6 108 x2 −= −− = TÉRMINOS SEMEJANTES Y SU REDUCCIÓN. Dos o más términos son semejantes cuando tienen la misma parte literal afectada, con los mismos exponentes, sin importar el coeficiente: Ejemplos: son términos semejantes: a) 2a y a; -2b y 8b; x m+1 y 3x m+1 b) -3xy y 2xy, 3 1 xy y xy c) x5 y x , 7a2 b3 c4 y –4a2 b3 c4 d) 22 yx c2ab y 22 y3x c2ab En cambio: 4ab y 5a 2 b, no son términos semejantes puesto que, aunque tienen la misma parte literal no tienen los mismos exponentes. Los términos semejantes pueden reducirse entresi. Reducción de términos semejantes Es una operación que tiene por objeto convertir en un sólo término dos o más términos semejantes. En la reducción de términos semejantes existen los siguientes tres casos: Primero: Reducción de dos o más términos semejantes del mismo signo. La suma de dos o más términos semejantes con signos iguales, es otro término semejante cuyo coeficiente es igual a la suma de sus coeficientes numéricos precedidos del signo común que tienen todos los términos, y a continuación se escribe la parte literal. Ejemplos: a) 2a + 3a = 5a b) -5b - 7b = -12b c) -a 2 - 9a 2 = - 10a 2 d) - 4am+1 - 7a m+1 = - 11a m+1 e) ab 6 7 6 4ab3ab ab 3 2 ab 2 1 = + =+ f) 5xy + 8xy =13xy g) xy 3 1 xy 3 2 xy 3 1 −=− Segundo: Reducción de dos términos semejantes de diferente signo. La suma de dos términos semejantes con signos diferentes es otro termino semejante, se restan los coeficientes, poniendo delante de esta diferencia el signo del termino mayor y a continuación se escribe la parte literal. Ejemplos:
- 1837. ÁLGEBRA: NIVEL MEDIO SUPERIOR DEFINICIONES BÁSICAS, EXPONENTES Y RADICALES AUTOR: PROFESOR JESÚS INFANTRE MURILLO EDICIÓN: PROFESOR PABLO FUENTES RAMOS 2-13 a) 2a - 3a = - a b) 18x - 11x = 7x c) -20ab + 11ab = - 9ab d) - 8ax + 13ax = 5ax e) ab 6 7 6 4ab3ab ab 3 2 ab 2 1 = + =+ f) 5xy + 8xy = 13xy g) xyxy 3 2 xy 3 1 −=−− Tercero: Reducción de más de dos términos semejantes de diferente signo. Se reducen a uno sólo todos los términos con signo positivo, también se reducen a uno sólo todos los términos con signo negativo, y a los dos términos obtenidos se les aplica, el enunciado del caso anterior. Ejemplos: a) 5a - 8a + a - 6a + 21a = 27a - 14a = 13a b) - 3x + 2x - 5x + 7x - 4x = 9x - 12x = - 3x USO Y ELIMINACIÓN DE SIGNOS DE AGRUPACIÓN Se usan paréntesis ( ), corchetes [ ] y llaves { }; para agrupar operaciones e indicar el orden preciso en el cual se deben efectuar éstas. Las cantidades o números agrupados se deben considerar como un todo. Ejemplos: En, 5 + (2 3); indica que la multiplicación 2 3 se efectúa primero y el producto se suma con 5, dando por resultado 11, es decir que:. 5+ (2 ) = 5 + 6 = 11 Por lo general se omite el signo de multiplicación próximo a un signo de agrupación. Ejemplo: En 4 (3 + 8) = 4(3 + 8) = 4(11) = 44 Al realizar las operaciones donde a veces es necesario colocar o eliminar paréntesis o signos de agrupación, podemos aplicar las reglas siguientes: Primero: Si existen signos de agrupación contenidos dentro de otro, eliminar el más interior.
- 1838. ÁLGEBRA: NIVEL MEDIO SUPERIOR DEFINICIONES BÁSICAS, EXPONENTES Y RADICALES AUTOR: PROFESOR JESÚS INFANTRE MURILLO EDICIÓN: PROFESOR PABLO FUENTES RAMOS 2-14 Ejemplos a) [(7 4) + (8 - 5)] - (16 - 4) + (42 ÷÷ 6) = (28 + 3) - 12 + 7 = 31 - 12 + 7 = 38 - 12 = 26 b) 2 - {3 -[(5 + 1)-(3 - 0)] - 5(1 + 2) + (- 2)(6 - 3)} = 2 – [3 –(6 – 3)-5(3) (- 2)(3)] = = 2 – (3 - 3 - 15 – 6) = 2 – (- 21) = 2 + 21 = 23 Segundo: En una sucesión de sumas, restas, multiplicaciones y divisiones, efectuar primero las multiplicaciones y divisiones, luego las sumas y restas, todo de izquierda a derecha. Ejemplo: 5 6 - 3 7 + 24 ÷÷ 8 = 30 - 21 + 3 = 33 - 21 = 12 Como lo muestran los ejemplos anteriores, los signos de agrupación precedidos de un signomás (+), pueden colocarse o ser removidos sin cambiar los signos de la expresión. Si lo que precede al signo de agrupación es un signo(-), los signos de todos los términos deben cambiarse al retirar el paréntesis. Convencionalmente, cuando a un signo de agrupación no le antecede ningún signo, se entiende que éste es un signo más (+). 2. EXPONENTES Y RADICALES. Potencias: La notación exponencial se usa para multiplicaciones repetidas del mismo número. Por ejemplo: a a, se escribe a 2 , que se lee a cuadrada o a a la segunda potencia. En general, si n es un número entero positivo, se tendrá: an = a a a a a...a, n factores. Se lee; a a la potencia n o a a la enésima potencia. A la letra a se le llama base y a la letra n el exponente de a. Ejemplo: 3 3 3 3 3 3 3 3 3 = 3 9 , en donde, 3 es la base y 9 el exponente. PROPIEDADES DE LOS EXPONENTES. 1. mnmn aaa + = Para multiplicar exponentes con la misma base, se suman sus exponentes. 2. nmmn a)(a = Para elevar una potencia a otra potencia, se multiplican dichos exponentes. 3. nnn ba(ab) = Queda incluido en el caso 2. 4. 0)(b b a b a n nn ≠= , Queda incluido en caso 2
- 1839. ÁLGEBRA: NIVEL MEDIO SUPERIOR DEFINICIONES BÁSICAS, EXPONENTES Y RADICALES AUTOR: PROFESOR JESÚS INFANTRE MURILLO EDICIÓN: PROFESOR PABLO FUENTES RAMOS 2-15 1. Para la división, m n a a , se tienen los siguientes casos: a) Si, n m, tenemos: mn m n a a a − = b) Si, n m, tenemos: 0apara a a nmm n 1 a ≠− = c) Si, n = m, se tiene: 1 aa n n m n aa == Demostraremos este último caso: como, n =m, se tiene: 0nn n n aa a a == − . Igualando resultados, se tiene que: 1a 0 = . Lo que significa que toda expresión elevada a cero potencia vale la unidad. Ejemplo: (8a3 b4 c - 5b2 + 6y5 )0 = 1 De la misma forma, en el ejemplo siguiente tenemos: 232 3 5 3 253 5 3 a 1 aa a a a aa a a == == −− Igualando resultados podemos expresarlos como: 2 2 a 1 a = − . Por lo que en forma general será: n n a 1 a = − Según esto, toda expresión con exponente negativo es igual a un quebrado que tiene como numerador la unidad y como denominador la misma expresión, pero con exponente de signo contrario. Ejemplos: a) 3 3 x 1 x − = b) 42 42 7)5(2x 7)(2x 5 += + − c) 32 2 2 32 3 2 32 ba1 3a a ba1 3 b a 1 3 ba 3 + = + == + + − OPERACIONES CON EXPONENTES. Aplicando las definiciones y propiedades correspondientes se dan las principales operaciones. a) Multiplicación. 1282222 74343 === + 55555 14343 === +−−
- 1840. ÁLGEBRA: NIVEL MEDIO SUPERIOR DEFINICIONES BÁSICAS, EXPONENTES Y RADICALES AUTOR: PROFESOR JESÚS INFANTRE MURILLO EDICIÓN: PROFESOR PABLO FUENTES RAMOS 2-16 b) División. 555 5 5 134 3 4 === − 9333 3 3 2424)(2 4 2 ==== +−−−− − − c) Potencia de una potencia. 62x332 33)(3 == 102x552 44)4( −=−=− Simplificación de exponentes Ejemplos: a) 73434 aa))(a(a == + b) 8553325332 b6ab6a)b)(2ab(3a == ++ c) 6 9 32 33 3 2 3 8y x )(2y )(x 2y x == 2 2 2 2 2 22 x y y 1 x 1 y x y x == = − −− d) 224 8 3 6 4 5 4 3 3 1 3 5 4 5 3 1 4 3 3 5 yxyxyxyxyx === ++ Radicación Radicación es la operación inversa a la potenciación, es decir, la operación para encontrar la raíz de un número. Si n bx = ; Podemos encontrar el valor de x extrayendo raíz enésima de b.Enla expresión anterior, al símbolo se le llama radical. A n se le llama índice de la raíz a b se le llama radicando o subradical. Sí el índice de la raíz no se indica, se sobre entiende que es 2. Ejemplo: En el termino 4 2 57− : signo (-), coeficiente 7; subradical 52 y orden 4. Sí el índice del radical es par y el subradical es positivo el resultado tendrá dos raíces, una positiva y otra negativa. Ejemplo: En 416 ±=± , ya que: 164)4)((4)( 2 =++=+ y 164)4)((4)( 2 =−−=− Sí el índice del radical es par y el subradical es negativo la raíz no es un número real, ya que no existe número positivo ni negativo que elevado a una potencia par de un número negativo; por lo que se dice que es imaginario por no tener raíz en los números reales. Ejemplo: 16− , no tiene solución de números reales ya que, (-4) 2 = (-4) (-4) = +16 Si el índice de la raíz es impar y el subradical es positivo o negativo, se tendrá como resultado una sola raíz, afectada del mismo signo del subradical. Ejemplo: 3273 −=− ; ya que (-3) (-3) (-3) = - 27 En general, para extraer raíz enésima de un término, basta extraer de dicha raíz a su coeficiente y dividir entre el índice n del radical todos y cada uno de los exponentes del subradical.
- 1841. ÁLGEBRA: NIVEL MEDIO SUPERIOR DEFINICIONES BÁSICAS, EXPONENTES Y RADICALES AUTOR: PROFESOR JESÚS INFANTRE MURILLO EDICIÓN: PROFESOR PABLO FUENTES RAMOS 2-17 Ejemplos: a) n 1 n aa = b) n m n m aa = c) 2 1 aa = d) 3 4 3 4 mm = Según lo anterior, todo exponente fraccionario expresa en su numerador la elevación a una potencia y en su denominador la extracción de una raíz. Ejemplos: a) 3 23 2 aa = b) 5 35 3 aa = PROPIEDADES DE LOS RADICALES 1) n 1 n aa = 2) aaa n n n n == 3) n 1 nnn (ab)baab == 4) n 1 n 1 n n n b a b a b a == 5) nn n axa.x = 6) nk 1 n.kn k aaa == Operaciones con radicales Las operaciones que se pueden efectuar con radicales aplicando las propiedades correspondientes, son las siguientes. 1) Supresión de factores del subradical. Ejemplos: a) 28(2)864(2)128 2 === b) 3a5abab25(3)ab75a 2223 == c) 3 3 3 33 3 3 33 3 3 4 4 b2b aa bb2 aa b(2)b2 a2a 16b 2a −−−− ===
- 1842. ÁLGEBRA: NIVEL MEDIO SUPERIOR DEFINICIONES BÁSICAS, EXPONENTES Y RADICALES AUTOR: PROFESOR JESÚS INFANTRE MURILLO EDICIÓN: PROFESOR PABLO FUENTES RAMOS 2-18 2) Introducción de coeficientes dentro del radical. Ejemplos: a) 333 33 408(5)(5)252 === b) 3 33 33 333 y324xy27(12)x12yx312y3x === c) 19y 9y 1 19y 9y 1 13y 2 2 2 2 −=−=− 3) Suprimir los radicales del denominador de una fracción. Ejemplos a) 15 5 1 25 15 55 53 5 3 == ⋅ ⋅ = o también: 15 5 1 25 15 55 53 5 3 5 3 ==== b) )26( 4 3 4 )263( 26 )263( )2()6( )263( 26 26 26 3 26 3 22 += + = = − + = − + = + + − = − c) 7b 7b 2(7b) 7b 7b 7b 7b 1 7b 1 === d) yx 5y5x y)(x y)5(x yx yx yx 5 2 yx 5 + + = + + = + + + = + A este procedimiento se le conoce como racionalización del denominador. Racionalizar consiste en quitar signos de radical, ya sea en el denominador o numerador, según convenga. 4) Simplificar o cambiar el orden de un radical. Ejemplos: a) 36 981 ===== 3 1 6 2 6 1 26 1 99)(9(81) b) 24 2 6x36x ===== 2 1 2 1 4 2 4 2 4 1 24 1 24 1 22 x6x6)(x)(6)x(6 c) 36 93 2xyy8x ===== 2 1 36 3 36 326 933 )(2xy)(2xy)(2xyyx2 5) Cambiar dos o más radicales al mismo orden.
- 1843. ÁLGEBRA: NIVEL MEDIO SUPERIOR DEFINICIONES BÁSICAS, EXPONENTES Y RADICALES AUTOR: PROFESOR JESÚS INFANTRE MURILLO EDICIÓN: PROFESOR PABLO FUENTES RAMOS 2-19 Ejemplos: a) Cambiar las expresiones siguientes a radicales del mismo orden: 2 , 3 12 , 4 30 . Procedimiento: Lo primero que hacemos es buscar el mínimo común múltiplo (m.c.m.) de los índices de los radicales 2, 3 y 4. Es decir: m.c.m. (2, 3, 4) = 3 x 4 = 12 Segundo: dividimos el m.c.m. entre el índice de cada radical: 12 ÷÷ 2 = 6, 12 ÷÷ 3 = 4 y 12 ÷÷ 4 = 3 Tercero: multiplicamos tanto el índice del radical como exponentes de cada subradical por el cociente respectivo, como se muestra en seguida. 122 642 == 12 6 2 , 123 2073612 == 12 4 12 y 124 2700030 == 12 3 30 b) Cambiar las expresiones siguientes a radicales del mismo orden: 3 xy y x . Primero: m.c.m. (3, 2) = 6 Segundo: 6 ÷÷ 3 = 2 y 6 ÷÷ 2 = 3 Tercero: 6 223 yxxy = y 6 3 xx = c) Cambiar las expresiones siguientes a radicales del mismo orden: 5 3x y 3 2xy . Primero: m.c.m. (5, 3) = 15 Segundo: 15 ÷÷ 5 = 3 y 15 ÷÷ 3 = 5 Tercero: 15 35 27x3x == 15 3 )(3x y 15 553 y32x2xy == 15 5 (2xy) 6) Adición y sustracción de radicales. Para poder sumar radicales, es necesario que estos sean semejantes, es decir, que tengan los mismos índices y subradicales, en cuyo caso basta sumar algebraicamente sus coeficientes y multiplicar esa suma por el radical común. Ejemplo: 2425222 =+− Se puede dar el caso, de tener que sumar radicales que aparentemente no sean semejantes, en cuyo caso se hace la reducción a su más simple expresión.
- 1844. Tema 2 Vectores Sistemas de coordenadas „ Se utilizan para describir la posición de un punto en el espacio „ Un sistema de coordenadas consiste en „ un punto de referencia que llamaremos origen „ ejes específicos con escalas y etiquetas „ instrucciones de cómo designar un punto relativo al origen y a los ejes
- 1845. Sistema de coordenadas cartesianas en el plano „ También llamado sistema de coordenadas rectangular „ los ejes x- e y- se cortan en el origen „ Los puntos se designan (x,y) Sistema de coordenadas polares en el plano „ Es necesario definir un origen y una línea de referencia „ El punto se define como la distancia r desde el origen en dirección del ángulo T, en dirección antihorario desde la línea de referencia „ Los puntos se denotan como (r,T)
- 1846. Equivalencia entre coordenadas cartesianas y polares en el plano „ Se basa en formar un triángulo rectángulo a partir de r y T „ x = r cos T „ y = r sin T De coordenadas cartesianas a coordenadas polares „ r es la hipotenusa y T es un ángulo „ T se toma en sentido antihorario desde el eje X positivo 2 2 tan y x r x y T
- 1847. Coordenadas esféricas „ Radio r: distancia hasta P desde el origen. „ Ángulo LJ: ángulo entre el vector de posición de P y el eje Z. (como la latitud). „ Ángulo azimutal ij: ángulo entre la proyección del vector de posición de P y el eje X. (como la longitud) P Coordenadas cilíndricas „ Radio s: distancia hasta P desde el eje Z. „ Ángulo azimutal ij: ángulo entre la proyección del vector de posición de P y el eje X. (como la longitud) „ Coordenada z: componente del vector de posición de P a lo largo del eje Z (igual que la coordenada z). P
- 1848. Vectores y Escalares „ Una magnitud escalar está determinada completamente por un único número con las unidades apropiadas y no tiene dirección, ni sentido. „ Una magnitud vectorial está determinada completamente por un número con las unidades apropiadas (módulo), una dirección y un sentido Ejemplo de vector „ Una partícula viaja de A a B a lo largo del camino representado por la línea roja discontinua „ esta es la distancia que ha recorrido y es un escalar „ El desplazamiento es la línea negra continua de A a B „ El desplazamiento es independiente del camino que tomemos entre ambos puntos „ El desplazamiento es un vector
- 1849. Igualdad de dos vectores „ Dos vectores son iguales si tienen el mismo módulo, la misma dirección y el mismo sentido „ Todos los vectores que se muestran son iguales Suma gráfica de vectores „ Dibujar los vectores del final de uno al origen del otro „ La resultante se dibuja desde el origen del primer vector hasta el final del último
- 1850. Suma gráfica de vectores (2) „ Cuando se tienen muchos vectores, se repite el proceso hasta que se incluyen todos ellos „ La resultante se dibuja desde el origen del primer vector hasta el final del último Propiedades de la suma de vectores (1) „ Propiedad conmutativa: „ La suma es independiente del orden de los vectores A B B A G G G G
- 1851. Propiedades de la suma de vectores (2) „ Propiedad asociativa: „ Cuando sumamos tres o más vectores, la suma es independiente de la forma en que los vectores se agrupan. ( ) ( )A B C A B C G GG G G G Suma de vectores (final) „ Cuando se suman vectores todos ellos deben tener las mismas unidades. „ Todos los vectores deben tener las mismas magnitudes „ Por ejemplo, no se puede sumar un desplazamiento a una velocidad
- 1852. Diferencia de vectores „ Es un caso especial de suma de vectores „ Para calcular A – B, se hace A+(-B) „ Continuar con el procedimiento standard de suma de vectores Multiplicar o dividir un vector por un escalar „ El resultado de la multiplicación o de la división es un vector. „ El módulo del vector se multiplica o divide por el escalar. „ Si el escalar es positivo, la dirección y sentido del resultado son los mismos que los del vector original. „ Si el escalar es negativo, la dirección del resultado es la misma que la del vector original, pero su sentido es opuesto.
- 1853. Componentes de un vector „ Un vector se puede expresar matemáticamente mediante sus componentes „ Es útil utilizar las componentes rectangulares „ Éstas son las proyecciones en los ejes X, Y y Z Vectores unitarios „ Un vector unitario es un vector sin unidades cuyo módulo es exactamente la unidad. Se utilizan para especificar dirección y sentido. „ Por ejemplo, dado un vector a, podemos hallar un vector unitario en la dirección y sentido de a, sin más que escribir: a u a G G G
- 1854. Vectores unitarios (2) „ Los símbolos representan a los vectores unitarios en un sistema de coordenadas rectangular „ Forman un conjunto de vectores unitarios perpendiculares dos a dos kˆand,jˆ,iˆ Vectores unitarios (2) „ Para hallar las componentes de un vector, se proyecta éste en las tres direcciones X, Y y Z, hallando Ax, Ay y Az y escribiendo el vector: GG G G x y zA A i A j A k
- 1855. Suma de vectores utilizando vectores unitarios „ Tomemos R = A + B „ así pues, „ Rx = Ax + Bx , Ry = Ay + By y Rz = Az + Bz etc.
- 1860. ˆ ˆ ˆ ˆˆ ˆ ˆ ˆ ˆ ˆ ˆ ˆ x y z x y z x x y y z z x y z A A A B B B A B A B A B R R R R i j k i j k R i j k R i j k 2 2 2 1 tan x x y z x R R R R R R T Producto escalar de dos vectores „ El producto escalar de dos vectores se escribe A . B „ Se define como: „ A . B = A B cos T „ T es el ángulo entre A y B „ ¡Es un escalar !
- 1861. Propiedades del producto escalar „ Propiedad conmutativa „ A . B = B . A „ Propiedad distributiva „ A . (B + C) = A . B + A . C Producto escalar de vectores unitarios „ „ Utilizando la expresión de A y B en sus componentes 0kˆjˆkˆiˆjˆiˆ 1kˆkˆjˆjˆiˆiˆ ˜˜˜ ˜˜˜ zzyyxx zyx zyx BABABABA kˆBjˆBiˆBB kˆAjˆAiˆAA ˜
- 1862. UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE INGENIERÍA DIVISIÓN DE CIENCIAS BÁSICAS COORDINACIÓN DE MATEMÁTICAS Abril de 2011 1 de 8 SISTEMA DE COORDENADAS CARTESIANAS Definición El sistema de coordenadas cartesianas en el plano está constituido por dos rectas perpendiculares que se intersecan en un punto “O” al que se le llama “el origen”. Una de las rectas se acostumbra representarla en posición horizontal y se le da el nombre de eje X o eje de las abscisas; a la otra recta, vertical, se le denomina eje Y o eje de las ordenadas, y ambas constituyen los dos ejes de coordenadas rectangulares, los cuales dividen al plano en cuatro partes llamadas cuadrantes. Y Segundo Primer cuadrante cuadrante O X Tercer Cuarto cuadrante cuadrante Figura 1. El plano cartesiano El nombre de “cartesiano” es en honor del filósofo francés René Descartes (1596-1650) ya que fue él quien planteó de manera formal la idea de resolver problemas geométricos por medio del álgebra, a partir de un sistema de coordenadas rectangulares.
- 1863. UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE INGENIERÍA DIVISIÓN DE CIENCIAS BÁSICAS COORDINACIÓN DE MATEMÁTICAS Abril de 2011 2 de 8 En este sistema de coordenadas, la posición de un punto P en el plano queda determinada mediante una pareja de números reales
- 1864. ,x y de los cuales el primero, x , representa la distancia del punto P al eje coordenado Y, en tanto que el segundo, y , representa la distancia del punto P al eje X. Esto se representa en la forma: Y x
- 1865. ,P x y y X Figura 2. Posición de un punto en el plano La distancia de un punto al eje Y se le llama abscisa del punto, la distancia de un punto al eje X se le llama ordenada del punto. Las abscisas (valores de x ) son positivas en el primero y en el cuarto cuadrante, en tanto que son negativas en el segundo y en el tercer cuadrante. Las ordenadas (valores de y ) son positivas en el primero y en el segundo cuadrante, en tanto que son negativas en el tercero y en el cuarto cuadrante. Las abscisas son nulas
- 1866. 0x para todos los puntos contenidos en el eje Y. Las ordenadas son nulas
- 1867. 0y para todos los puntos contenidos en el eje X. Para representar puntos de coordenadas conocidas se trazan los ejes de coordenadas y se establece una escala adecuada sobre cada uno de ellos. Dichas escalas pueden ser iguales o distintas. 0
- 1868. 100 „ MATEMÁTICAS 2º ESO 1. Ecuaciones: ideas básicas Igualdades y ecuaciones. Utilizamos ecuaciones cuando tratamos de averiguar una cierta cantidad, desconocida, pero de la que sabemos que cumple cierta condición. La cantidad desconocida se llama incógnita y se representa por x (o cualquier otra letra) y la condición que cumple se escribe como una igualdad algebraica a la que llamamos ecuación. Resolver una ecuación es encontrar el o los valores de la o las incógnitas con los se cumple la igualdad. Ejemplo Situaciones que se expresan con ecuaciones Aún no hemos resuelto el problema, nuestro primer paso es plantear y escribirlo en forma de ecuación. Ejemplo Se reparten 40 € para dos personas, de manera que uno recibe 10 € más que el otro. ¿Cuánto recibe cada uno? Llamamos “x” al dinero que recibe la 1º persona, la que recibe menos. ¿Cuánto recibe entonces la 21 persona? La segunda persona recibiría “x+10”. Entre las dos se reparten en total 40 €, entonces la suma de “x” y “x+10” debe ser 40. Escribimos la ecuación: x+ (x+10) = 40 o agrupando: 2x + 10 = 40 Elementos de una ecuación. Miembros: Son las expresiones que aparecen a cada lado de la igualdad. El de la izquierda se llama 1er miembro. El de la derecha se llama 2º miembro. Términos son los sumandos que forman los miembros. Incógnitas: Son las letras que aparecen en la ecuación. Soluciones: Son los valores que deben tomar las letras para que la igualdad sea cierta. Grado de una ecuación: Es el mayor de los grados de los monomios que forman los miembros. Ecuaciones
- 1869. MATEMÁTICAS 2º ESO „ 101 Ejemplos Los términos son: 3x, –5, 7, –2x Los términos son: 3x2 , 48 En el segundo ejemplo, observa que si x toma otro valor (por ej: 6, – 12, 5/2,...) la igualdad no se cumple y por tanto no son soluciones. Ecuaciones equivalentes. Se llaman ecuaciones equivalentes a las que tienen las mismas soluciones. x Si se suma o resta una cantidad, o expresión, a los dos miembros de una ecuación se obtiene otra equivalente. Regla práctica: “lo que está sumando pasa restando, o viceversa”. x Si se multiplican o dividen los dos miembros de una ecuación por un número, o expresión, se obtiene otra equivalente. Regla práctica: “lo que está multiplicando pasa dividiendo, o viceversa”. Ejemplos Ecuaciones
- 1870. 104 „ MATEMÁTICAS 2º ESO 2. Reglas para resolver una ecuación Ecuación sin denominadores. Para este tipo de ecuaciones seguimos los siguientes pasos: 1º Agrupar los monomios que lleven la incógnita (“las x”) en un miembro de la ecuación y los términos independientes en el otro miembro. 2º Despejar la incógnita: Dejar la incógnita sola en un miembro de la ecuación. Ejemplos Sin paréntesis Con paréntesis Ecuación con denominadores. En el caso de haber denominadores hay que tratarlos antes, hacemos: 1º Se calcula el mínimo común múltiplo de todos los denominadores de la ecuación. 2º Se reduce a común denominador: cada término se transforma en una fracción equivalente cuyo denominador sea el mínimo común múltiplo de todos los denominadores. 3º Se eliminan los denominadores (Explicación: al multiplicar ambos miembros por el denominador común se obtiene una ecuación equivalente). 4º Se resuelve la ecuación, ya sin denominadores. Ejemplo Con denominadores y sin paréntesis Ecuaciones
- 1871. MATEMÁTICAS 2º ESO „ 105 Resolución general de ecuaciones de primer grado. En el caso general podemos encontrar paréntesis y denominadores. Debemos primero trabajar con ellos. Teniendo en cuenta los apartados anteriores seguiremos los siguientes pasos: 1º Quitar paréntesis. 2º Quitar denominadores. 3º Agrupar los monomios que llevan la incógnita en un miembro y los términos independientes en el otro. 4º Despejar la incógnita. Ejemplo Ejemplo Sea la ecuación siguiente, resuélvela explicitando paso a paso. Nuestro primer paso es quitar paréntesis, recordamos que el número delante del paréntesis, el 2, multiplica a todo el interior de éste. Ahora debemos quitar denominadores. Buscamos el m.c.m de los denominadores, de esta forma los hacemos iguales a través de fracciones equivalentes. Una vez que tenemos los denominadores iguales, los podemos quitar para quedarnos sólo con los numeradores, ya que si los denominadores son iguales, entonces los numeradores deben ser iguales. Ten cuidado con los signos delante de la fracción, mira que le ha pasado al término: se convierte en queda: Agrupamos los monomios a un lado y los números al otro. Despejamos la x o incógnita. Ecuaciones
- 1872. 112 „ MATEMÁTICAS 2º ESO Ecuaciones: ideas básicas x Cuando tratamos de averiguar una cierta cantidad, la incógnita, que sabemos que cumple una condición, representamos la cantidad desconocida por x (o cualquier otra letra) y la condición que cumple se escribe como una igualdad algebraica a la que llamamos ecuación. x Resolver una ecuación es encontrar el o los valores de la o las incógnitas con los que se cumple la igualdad. x Miembros: Son las expresiones que aparecen a cada lado de la igualdad. El de la izquierda se llama 1er miembro. El de la derecha se llama 2º miembro. x Términos: son los sumandos que forman los miembros. x Soluciones: Son los valores que deben tomar las letras para que la igualdad sea cierta. x Grado de una ecuación: Es el mayor de los grados de los monomios que forman los miembros. Ecuaciones equivalentes. Resolución de ecuaciones. Para resolver ecuaciones de primer grado x Se llaman ecuaciones equivalentes a las que tienen las mismas soluciones. x Si se suma o resta una cantidad o expresión a los dos miembros de una ecuación se obtiene otra equivalente. x Si se multiplican o dividen los dos miembros de una ecuación por un número (o una expresión algebraica) se obtiene otra equivalente. Reglas prácticas: “lo que está sumando pasa restando y lo que está restando pasa sumando” “lo que está multiplicando pasa dividiendo y lo que está dividiendo pasa multiplicando” Para resolver ecuaciones, los pasos a seguir son: x Quitar paréntesis. x Quitar denominadores. x Agrupar los monomios que llevan la incógnita en un miembro y los términos independientes en el otro. x Despejar la incógnita. Para resolver problemas, después de comprender el enunciado: x Establecer con precisión cuál será la incógnita. x Expresar como una ecuación la relación contenida en el enunciado. x Resolver la ecuación. x Interpretar la solución de la ecuación en el contexto del enunciado. x Comprobar que la solución obtenida cumple las condiciones del enunciado. Ecuaciones
- 1873. ECUACIONES DE PRIMER GRADO CON UNA INCÓGNITA Recordar: x Una ecuación es una igualdad algebraica en la que aparecen letras (incógnitas) con valor desconocido. x El grado de una ecuación viene dado por el exponente mayor de la incógnita. En este tema trabajamos con ecuaciones lineales (de grado 1) con una incógnita. x Solucionar una ecuación es encontrar el valor o valores de las incógnitas que transforman la ecuación en una identidad. x Dos ecuaciones son equivalentes si tienen las mismas soluciones. x Para conseguir ecuaciones equivalentes, sólo se puede aplicar alguna de las siguientes propiedades: Propiedad 1: Sumar o restar a las dos partes de la igualdad una misma expresión. Propiedad 2: Multiplicar o dividir las dos partes de la igualdad por un número diferente de cero. Ejercicios de autoaprendizaje: 1. Resolvemos algunas ecuaciones: Procedimiento para resolver una ecuación de 1r grado: x Eliminar denominadores: multiplicando ambas partes de la ecuación por el mínimo común múltiplo de los denominadores. (Propiedad 2) x Eliminar paréntesis. (Propiedad distributiva) x Transposición de términos. Conseguir una ecuación de la forma bxa ˜ . (Propiedad 1). x Despejar la incógnita. (Propiedad 2). x Comprobar la solución. a)
- 1875. 7x4425x23 lo primero que hacemos será las operaciones de los paréntesis 7x8815x6 sumamos los términos en x y los términos independientes 77x2 transponemos los términos 77x2 Ÿ 0x2 despejamos la incógnita Ÿ 0x Comprobación: Al sustituir en la ecuación 0x , transforma la ecuación en identidad:
- 1877. 704425023 ˜˜ Ÿ 74253 ˜˜ b) 3 x29 2 6 3x 4 Ÿ Multiplicamos ambas partes de la ecuación por el mínimo común múltiplo de los denominadores ¸ ¹ · ¨ © § ˜¸ ¹ · ¨ © § ˜ 3 x29 26 6 3x 46 Ÿ
- 1879. x292123x24 eliminamos los paréntesis x418123x24 Ÿ x430x21 transponemos los términos 2130xx4 Ÿ 9x3 despejamos la incógnita Ÿ 3x Comprobación:



























![7HRUtD GH ELRJpQHVLV )XH SURSXHVWD SRU 5HGGL TXLHQ D ILQDOHV GHO
VLJOR ;9,, KL]R XQ H[SHULPHQWR SDUD GHPRVWUDU OD IDOVHGDG GH OD
WHRUtD GH OD JHQHUDFLyQ HVSRQWiQHD /OHJy D OD FRQFOXVLyQ GH TXH OD
YLGD VyOR SXHGH RULJLQDUVH D SDUWLU GH OD YLGD
/D SXJQD HQWUH ODV WHRUtDV DQWHULRUHV JHQHUDFLyQ HVSRQWiQHD
ELRJpQHVLV](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-28-320.jpg)



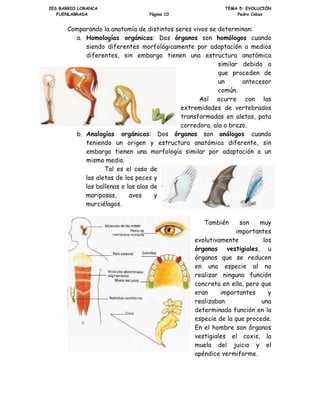
![,(6 %$55,2 /25$1$ 7(0$ (92/8,Ð1
)8(1/$%5$'$ 3iJLQD 3HGUR RERV
UDGLDFLyQ XOWUDYLROHWD ORV UDRV FyVPLFRV ODV GHVFDUJDV HOpFWULFDV
DFWXDURQ VREUH ORV JDVHV GH OD DWPyVIHUD FUHDQGR PROpFXODV
RUJiQLFDV VHQFLOODV FRPSOHMDV DOJXQDV GH ODV FXDOHV VHUtDQ
LQHVWDEOHV VH GHVWUXLUtDQ PLHQWUDV TXH RWUDV FRPR DPLQRiFLGRV
D]~FDUHV iFLGRV JUDVRV DOFRKROHV DGHKtGRV WHUSHQRV RWURV VHUtDQ
HVWDEOHV SHUGXUDUtDQ HVWH KHFKR IXH GHPRVWUDGR SRU 0LOOHU 8UH
HQ HO ODERUDWRULR](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-33-320.jpg)
![/DV PROpFXODV PiV SHVDGDV FDHQ SRU VX SHVR D ORV PDUHV
SULPLWLYRV GRQGH VXIUHQ OD SROLPHUL]DFLyQ FUHDQ SROtPHURV
SURWHtQDV iFLGRV QXFOHLFRV JO~FLGRV«](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-34-320.jpg)


![/D HYROXFLyQ GHO SURWRELRQWH RULJLQD OD SULPHUD FpOXOD TXH
UHDOL]D ODV WUHV IXQFLRQHV YLWDOHV GH QXWULFLyQ UHODFLyQ
UHSURGXFFLyQ (VWD FpOXOD VHUtD XQ SURFDULRWD KHWHUyWURIR DQDHURELR
TXH VH DOLPHQWDED GHO PHGLR
/D SREODFLyQ GHO SURFDULRWD DXPHQWy FRPHQ]y D HVFDVHDU HO
DOLPHQWR SURGXFLpQGRVH OD SULPHUD FULVLV HFROyJLFD $OJXQRV
DSUHQGHQ D DWDFDU D VXV VHPHMDQWHV DSDUHFLHQGR DVt ORV FDUQtYRURV
SHUR HO DOLPHQWR VHJXtD HVFDVHDQGR DOJXQRV GH HVWRV DSUHQGLHURQ D
XVDU OD OX] PHGLDQWH OD FORURILOD FUHiQGRVH DVt ORV SULPHURV
SURFDULRWDV DXWyWURIDV TXH SURGXFtDQ PDWHULD RUJiQLFD D SDUWLU GH
PDWHULD LQRUJiQLFD SHUR TXH HOLPLQDEDQ R[tJHQR FRPR SURGXFWR
UHVLGXDO HO FXDO DO DFXPXODUVH HQ OD DWPyVIHUD WUDQVIRUPy OD
DWPyVIHUD UHGXFWRUD HQ R[LGDQWH SURGXFLpQGRVH DVt OD VHJXQGD](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-37-320.jpg)




![7(25Ì$6 62%5( /$ (92/8,Ð1
7LHQHQ SRU REMHWR HO HVWXGLR GH ODV FDXVDV GH ORV FDPELRV WHPSRUDOHV
GH ORV RUJDQLVPRV HV GHFLU LQWHQWDQ H[SOLFDU
x /D HVSHFLDFLyQ
x /D FUHDFLyQ GH QXHYRV WLSRV GH RUJDQL]DFLyQ
x /D DSDULFLyQ GH DGDSWDFLRQHV
/DV SULQFLSDOHV WHRUtDV HYROXWLYDV VH FODVLILFDQ HQ
)LMLVWDV
6RQ ODV TXH LQGLFDQ TXH ODV HVSHFLHV VRQ LQPXWDEOHV GHVGH VX FUHDFLyQ
HV GHFLU VRQ FUHDFLRQLVWDV )XH GHIHQGLGD SRU /LQQHR XYLHU TXLHQ LQGLFy
TXH ODV HVSHFLHV SRVHHQ LQGLYLGXRV TXH SURFHGHQ XQRV GH RWURV HV GHFLU TXH
VH SDUHFHQ D VXV SDGUHV XYLHU SRVWXOy OD WHRUtD GH ODV FUHDFLRQHV
VXFHVLYDV LQWHUFDODGDV FRQ OD LQFLGHQFLD GH FDWDFOLVPRV TXH GHVWUXHQ WRGD
OD YLGD SUHH[LVWHQWH SRU OR TXH 'LRV FUHD RWURV VHUHV YLYRV QXHYRV WDPELpQ
VH OODPDQ FDWDVWURILVWDV](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-42-320.jpg)

![,(6 %$55,2 /25$1$ 7(0$ (92/8,Ð1
)8(1/$%5$'$ 3iJLQD 3HGUR RERV
KDQ REOLJDGR D OD IRUPDFLyQ GH QXHYDV HVSHFLHV D OD DSDULFLyQ GH QXHYRV
WLSRV GH RUJDQL]DFLyQ 3DUD H[SOLFDU ODV FDXVDV TXH SURYRFDQ HO FDPELR VH
KDQ GDGR GLYHUVDV WHRUtDV
/DPDUFNLVPR
)XH GDGD SRU /DPDUFN SDUD pO HO PRWRU GH OD HYROXFLyQ HV OD
DGDSWDFLyQ DO PHGLR 6XSRQH TXH WRGRV ORV RUJDQLVPRV WLHQGHQ D XQD
PDRU FRPSOHMLGDG HVWUXFWXUDO VXSRQH
D 8QD HVSHFLH SURFHGH GH RWUD SRU FDPELR HQ OD SULPHUD
E (V HO PHGLR OD FDXVD GHO FDPELR HQ OD HVSHFLH SULPHUD TXH KDFH
DSDUHFHU FDUDFWHUHV TXH QR HVWDEDQ DQWHV FDUiFWHU DGTXLULGR](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-44-320.jpg)

![7HRUtD GH OD VHOHFFLyQ QDWXUDO
)XH GDGD SRU 'DUZLQ :DOODFH GH IRUPD LQGHSHQGLHQWH SDUD HOORV
OD FDXVD R PRWRU GH OD HYROXFLyQ HV OD VHOHFFLyQ QDWXUDO 6XSRQH
D /XFKD SRU OD H[LVWHQFLD (V GHFLU HQ OD SREODFLyQ VH SURGXFHQ
PiV LQGLYLGXRV TXH ORV TXH HO PHGLR SXHGH VRSRUWDU SHUR VH
PDQWLHQH HVWH Q~PHUR GH LQGLYLGXRV SRUTXH OD PDRUtD GH HOORV
PXHUHQ DQWHV GH DOFDQ]DU OD FDSDFLGDG UHSURGXFWRUD DO QR
FRQVHJXLU DOLPHQWR
E 9DULDELOLGDG LQWUDHVSHFtILFD +D YDULDFLRQHV LQGLYLGXDOHV HQWUH
ORV LQGLYLGXRV GH XQD PLVPD HVSHFLD TXH KDFHQ TXH DOJXQRV GH HOORV
HVWpQ PHMRU DGDSWDGRV DO PHGLR TXH RWURV /RV PHMRU DGDSWDGRV
FRQVHJXLUiQ PHMRU HO DOLPHQWR SRGUiQ DFFHGHU D OD UHSURGXFFLyQ
GHMDQGR GHVFHQGHQFLD PLHQWUDV TXH ORV SHRU DGDSWDGRV R PXHUHQ
DQWHV GH DOFDQ]DU OD PDGXUH] VH[XDO R VL OD DOFDQ]DQ QR WLHQHQ
DFFHVR D OD UHSURGXFFLyQ SRU OR TXH VXV JHQHV GHVDSDUHFHQ GH OD
SREODFLyQ (V GHFLU HO SURFHVR HYROXWLYR HV JUDGXDO FRQWLQXR
F 6HOHFFLyQ QDWXUDO (V GHFLU HV HO PHGLR DPELHQWH TXLHQ VHOHFFLRQD
D ORV LQGLYLGXRV TXH HVWiQ PHMRU DGDSWDGRV D pO HV GHFLU
VHOHFFLRQD ORV FDUDFWHUHV PiV EHQHILFLRVRV ORV JHQHV GH ORV TXH
GHSHQGHQ HVWRV FDUDFWHUHV HQ GHWULPHQWR GH ORV QR VHOHFFLRQDGRV
/D VHOHFFLyQ QDWXUDO DFXPXOD HVWRV FDPELRV ORV JHQHV
UHVSRQVDEOHV](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-46-320.jpg)



![0HFDQLVPRV GH OD HYROXFLyQ /D YDULDELOLGDG JHQpWLFD HQ OD
SREODFLyQ VH FRQVLJXH SRU PXWDFLyQ UHFRPELQDFLyQ
UHRUJDQL]DFLyQ GH ODV PXWDFLRQHV DFXPXODGDV GXUDQWH HO SURFHVR
GH PHLRVLV /D JUDQ GLYHUVLGDG JHQpWLFD FUHDGD GD D OD SREODFLyQ OD
SRVLELOLGDG GH XQD JUDQ DGDSWDELOLGDG D XQ PHGLR DPELHQWH
FDPELDQWH SRU OR WDQWR OH GD PDRU SUREDELOLGDG GH VREUHYLYLU](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-50-320.jpg)


![$LVODPLHQWR UHSURGXFWLYR FRPR UHVSRQVDEOH GH OD IRUPDFLyQ GH
QXHYDV HVSHFLHV R HVSHFLDFLyQ
'HILQH OD SREODFLyQ FRPR FRQMXQWR GH LQGLYLGXRV VHPHMDQWHV HQWUH Vt
FRQ JHQHV FRPXQHV FDSDFHV GH UHSURGXFLUVH HQWUH HOORV GDU XQD
GHVFHQGHQFLD IpUWLO
7HRUtD GHO HTXLOLEULR SXQWXDGR GH (OGUHGJH R VDOWDFLRQLVWD
6XSRQH TXH D YHFHV OD HYROXFLyQ VH SURGXFH D VDOWRV SRU DFXPXOR GH
PXWDFLRQHV SXQWXDOHV TXH VH PDQLILHVWDQ GH JROSH DO HQFRQWUDUVH FRQ XQ
PHGLR DPELHQWH IDYRUDEOH D HOODV
7HRUtD QHXWUDOLVWD GH .LPXUD
6XSRQH TXH OD PXWDFLyQ SXHGH SURGXFLU JHQHV QHXWURV SDUD XQD
GHWHUPLQDGD SREODFLyQ TXH QR LQIOXHQ HQ OD VXSHUYLYHQFLD GH OD HVSHFLH
SHUR TXH DO WUDQVPLWLUVH SXHGHQ PDQLIHVWDUVH KDFLHQGR TXH DSDUH]FDQ
QXHYDV HVSHFLHV
0($1,6026 '( (92/8,Ð1
/DV FDUDFWHUtVWLFDV PDQLIHVWDGDV SRU XQ LQGLYLGXR H LQFOXVR VX
FRPSRUWDPLHQWR GHSHQGHQ GH OD VHFXHQFLD GH DPLQRiFLGRV GH VXV SURWHtQDV
HQ ~OWLPR WpUPLQR GH OD VHFXHQFLD GH QXFOHyWLGRV HQ VXV iFLGRV QXFOHLFRV
HV GHFLU GH OD VHFXHQFLD GH EDVHV GH ORV JHQHV SRU HOOR OD HYROXFLyQ VLHPSUH
FRQOOHYD XQ FDPELR HQ HVWD LQIRUPDFLyQ DOPDFHQDGD HQ ORV iFLGRV QXFOHLFRV
JHQ JHQ
$'1
Ļ Ļ
SURWHtQD SURWHtQD
Ļ HYROXFLyQ
JHQ](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-53-320.jpg)






![,(6 %$55,2 /25$1$ 7(0$ (92/8,Ð1
)8(1/$%5$'$ 3iJLQD 3HGUR RERV
Q~PHUR GH GLIHUHQFLDV HQWUH VXV $'1 GH PRGR TXH FXDQWD PiV
GLIHUHQFLD KDD PDRU YD D VHU VX VHSDUDFLyQ HQ OD HYROXFLyQ
E 0XWDFLRQHV UHJXODGRUDV TXH DIHFWDQ D ODV SURWHtQDV TXH UHJXODQ OD
H[SUHVLyQ GH ORV JHQHV HVWUXFWXUDOHV (VWH HV HO PHFDQLVPR TXH
UHJXOD OD IRWRPRUIRJpQHVLV HV GHFLU OD OX] DFWLYD D JHQHV YHJHWDOHV
FRQWURODQGR HO FUHFLPLHQWR GH OD SODQWD OD IORUDFLyQ HO Q~PHUR GH
KRMDV«
F 9DULDELOLGDG JHQpWLFD 3RU YDULDELOLGDG HQWHQGHPRV HO Q~PHUR GH
DOHORV GLIHUHQWHV TXH SUHVHQWD XQD SREODFLyQ SDUD XQ GHWHUPLQDGR
FDUiFWHU /D YDULDELOLGDG DOWD HQ XQD SREODFLyQ GHWHUPLQD VX HYROXFLyQ
D TXH HQ ORV GLVWLQWRV DPELHQWHV VH SRWHQFLDUi XQR GH HOORV HQ
GHWULPHQWR GH ORV RWURV KDFLHQGR TXH DSDUH]FDQ GLYHUVDV UD]DV R
HVSHFLHV FRQ HO SDVR GH ORV DxRV 3RU HOORV OD UHSURGXFFLyQ VH[XDO
IXHQWH GH JUDQ YDULDELOLGDG](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-60-320.jpg)
![HV PX LPSRUWDQWH FRPR PHFDQLVPR GH
HYROXFLyQ DO SURGXFLUVH HQ HOOD OD UHFRPELQDFLyQ JHQpWLFD
G $GDSWDFLyQ (V RWUR PHFDQLVPR TXH IDYRUHFH OD HYROXFLyQ SRUTXH XQ
RUJDQLVPR VH DGDSWDUi PHMRU D XQ DPELHQWH FXDQWD PiV YDULDELOLGDG
KDD HQ HVH DPELHQWH +D FDUDFWHUHV QR DGDSWDWLYRV TXH HYROXFLRQDQ
DO PLVPR WLHPSR TXH XQ FDUiFWHU DGDSWDWLYR SURGXFLpQGRVH OD
FRHYROXFLyQ R DGDSWDFLyQ GH GRV RUJDQLVPRV TXH FRPSOHPHQWDQ VX
VXSHUYLYHQFLD ODV IORUHV HYROXFLRQDQ HQ VX PRUIRORJtD GHSHQGLHQGR
GHO DJHQWH SROLQL]DGRU](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-61-320.jpg)
![H (YROXFLyQ ILOpWLFD $QWH XQ PHGLR DPELHQWH FDPELDQWH HO VHU YLYR
SURGXFH FDPELRV HQ VXV GHVFHQGLHQWHV SDUD TXH VH DGDSWHQ
SDXODWLQDPHQWH DO PLVPR RULJLQiQGRVH DVt QXHYDV HVSHFLHV VLQ
DXPHQWDU HO Q~PHUR GH HOODV 7DO KHFKR RFXUULy FRQ ORV PDVWRGRQWHV
TXH HYROXFLRQDURQ D HOHIDQWHV
I (VSHFLDFLyQ 5XSWXUD HQ OD HYROXFLyQ ILOpWLFD TXH VXSRQH OD DSDULFLyQ
GH QXHYDV HVSHFLHV WDQWR HQ PRUIRORJtD FRPR HQ Q~PHUR /D
HVSHFLDFLyQ VH UHDOL]D HQ GRV IDVHV](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-62-320.jpg)

![,QWHUUXSFLyQ GHO LQWHUFDPELR GH
PDWHULDO JHQpWLFR FRQ RWURV PLHPEURV GH
OD SREODFLyQ (O SURFHVR HV JUDGXDO
UHYHUVLEOH KDVWD XQ GHWHUPLQDGR SXQWR
/D LQWHUUXSFLyQ VH SXHGH FRQVHJXLU SRU
x (VSHFLDFLyQ DORSiWULGD 6L ODV
SREODFLRQHV TXHGDQ DLVODGDV
JHRJUiILFDPHQWH ORV JUXSRV GLYHUJHQ
JHQpWLFDPHQWH GLVPLQXH OD
YDULDELOLGDG GH KtEULGRV (M ODV
HVSHFLHV GH SLQ]RQHV GHO DUFKLSLpODJR
GH ODV *DOiSDJRV
x (VSHFLDFLyQ VLPSiWULGD 6RQ
PHFDQLVPR GH DVLODPLHQWR HFROyJLFR
HWROyJLFR«](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-64-320.jpg)


![GHELGR D OD DGDSWDFLyQ D GLIHUHQWHV
PHGLRV DPELHQWHV OR TXH FRQGLFLRQD OD FUHDFLyQ GH QXHYDV HVSHFLHV PX
VHPHMDQWHV HQWUH Vt SHUR GLIHUHQWHV HQ DOJXQRV FDUDFWHUHV (O SURFHVR VH
GHQRPLQD UDGLDFLyQ HYROXWLYD R HYROXFLyQ GLYHUJHQWH FRPR RFXUULy FRQ ORV
SLQ]RQHV GH ODV *DOiSDJRV TXH VRQ PX VHPHMDQWHV HQWUH Vt SHUR TXH VH
GLIHUHQFLDQ HQ HO WLSR GH SLFRV TXH SRVHHQ DGDSWDGRV D ORV WLSRV GH
DOLPHQWDFLyQ TXH KD HQ ODV GLVWLQWDV LVODV 7DPELpQ VH VXHOHQ FDPELRV
VHPHMDQWHV HQ GLVWLQWDV HVSHFLHV GHELGR D OD SUHVLyQ GHO PHGLR TXH RULJLQD
VHUHV YLYRV VHPHMDQWHV HQ DOJXQR GH VXV FDUDFWHUHV SHUR GH GLVWLQWDV
HVSHFLHV HVWH SURFHVR VH GHQRPLQD HYROXFLyQ FRQYHUJHQWH](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-67-320.jpg)
![,(6 %$55,2 /25$1$ 7(0$ (92/8,Ð1
)8(1/$%5$'$ 3iJLQD 3HGUR RERV
/D PDFURHYROXFLyQ HV HO GHVDUUROOR GH JUDQGHV FDPELRV GLIHUHQFLDOHV
HQ ODV SREODFLRQHV GHELGR
D XQ DFXPXOR GH
PXWDFLRQHV HQ OD
SREODFLyQ SUHH[LVWHQWH
TXH KDFH TXH VH IRUPHQ
SREODFLRQHV PX
GLIHUHQWHV HQWUH Vt FRPR
RFXUULy HQ OD HYROXFLyQ GH
UHSWLOHV KDFLD DYHV
PDPtIHURV
358(%$6 '( /$ (92/8,Ð1
/DV SUXHEDV GH OD HYROXFLyQ VH FODVLILFDQ HQ GRV JUDQGHV JUXSRV
3UXHEDV FOiVLFDV 6RQ ODV XWLOL]DGDV SRU 'DUZLQ SRVWHULRUHV SDUD
H[SOLFDUOD HYROXFLyQ GH ODV HVSHFLHV SXHGHQ VHU
3UXHEDV GH PRUIRORJtD DQDWRPtD FRPSDUDGD
6H REVHUYD TXH HVSHFLHV GH KiELWDWV DLVODGRV PRQWDxDV LVODV
RFHiQLFDV](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-68-320.jpg)
![WLHQHQ LQGLFLRV PRUIROyJLFRV GH WHQHU XQD HVSHFLH
DQFHVWUDO FRP~Q SRUTXH VRQ PX VLPLODUHV HQ PRUIRORJtD VH
GLIHUHQFLDQ VyOR HQ DOJXQRV FDUDFWHUHV TXH VH H[SOLFDQ FRPR
FRQVHFXHQFLD GH OD DGDSWDFLyQ DO PHGLR DPELHQWH GRQGH YLYHQ 7DO HV
HO FDVR GH ORV 3LQ]RQHV GH ODV *DOiSDJRV PX VLPLODUHV HQWUH Vt
VLPLODUHV D ORV SLQ]RQHV JUDQtYRURV WHUUHVWUHV GHO (FXDGRU KHFKR
TXH VH H[SOLFD DGPLWLHQGR TXH HQ HO SDVDGR HO SLQ]yQ GHO (FXDGRU
HPLJUy D ODV LVODV DTXt VH DGDSWy D ODV GLVWLQWDV FRQGLFLRQHV GH ODV
GLVWLQWDV LVODV](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-69-320.jpg)
![,(6 %$55,2 /25$1$ 7(0$ (92/8,Ð1
)8(1/$%5$'$ 3iJLQD 3HGUR RERV
RPSDUDQGR OD DQDWRPtD GH GLVWLQWRV VHUHV YLYRV VH GHWHUPLQDQ
D +RPRORJtDV RUJiQLFDV 'RV yUJDQRV VRQ KRPyORJRV FXDQGR
VLHQGR GLIHUHQWHV PRUIROyJLFDPHQWH SRU DGDSWDFLyQ D PHGLRV
GLIHUHQWHV VLQ HPEDUJR WLHQHQ XQD HVWUXFWXUD DQDWyPLFD
VLPLODU GHELGR D
TXH SURFHGHQ GH
XQ DQWHFHVRU
FRP~Q
$Vt RFXUUH FRQ ODV
H[WUHPLGDGHV GH YHUWHEUDGRV
WUDQVIRUPDGDV HQ DOHWDV SDWD
FRUUHGRUD DOD R EUD]R
E $QDORJtDV RUJiQLFDV 'RV yUJDQRV VRQ DQiORJRV FXDQGR
WHQLHQGR XQ RULJHQ HVWUXFWXUD DQDWyPLFD GLIHUHQWH VLQ
HPEDUJR WLHQHQ XQD PRUIRORJtD VLPLODU SRU DGDSWDFLyQ D XQ
PLVPR PHGLR
7DO HV HO FDVR GH
ODV DOHWDV GH ORV SHFHV
ODV EDOOHQDV R ODV DODV GH
PDULSRVDV DYHV
PXUFLpODJRV
7DPELpQ VRQ PX
LPSRUWDQWHV
HYROXWLYDPHQWH ORV
yUJDQRV YHVWLJLDOHV X
yUJDQRV TXH VH UHGXFHQ
HQ XQD HVSHFLH DO QR
UHDOL]DU QLQJXQD IXQFLyQ
FRQFUHWD HQ HOOD SHUR TXH
HUDQ LPSRUWDQWHV
UHDOL]DEDQ XQD
GHWHUPLQDGD IXQFLyQ HQ OD
HVSHFLH GH OD TXH SURFHGH
(Q HO KRPEUH VRQ yUJDQRV
YHVWLJLDOHV HO FR[LV OD
PXHOD GHO MXLFLR HO
DSpQGLFH YHUPLIRUPH](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-70-320.jpg)
![,(6 %$55,2 /25$1$ 7(0$ (92/8,Ð1
)8(1/$%5$'$ 3iJLQD 3HGUR RERV
3UXHEDV SDOHRQWROyJLFDV
/D 3DOHRQWRORJtD HV OD FLHQFLD TXH VH RFXSD GHO HVWXGLR GH ORV
IyVLOHV QRV KD DSRUWDGR PXFKDV SUXHEDV TXH UHODFLRQDQ ORV VHUHV
YLYRV GHO SDVDGR FRQ ORV
DFWXDOHV SHUPLWLpQGRQRV
HVWDEOHFHU OtQHDV GH HYROXFLyQ
DO FRPSUREDU TXH DOJXQRV
yUJDQRV WLHQHQ XQD HYROXFLyQ
SURJUHVLYD
$Vt RFXUUH FRQ OD
HYROXFLyQ GH ORV FDEDOORV GHVGH
(RKLSSXV FRQ FXDWUR GHGRV HQ
OD SDWD D (TXXV FRQ XQ GHGR
SRU XQD DGDSWDFLyQ D OD
FDUUHUD
3UXHEDV ELRJHRJUiILFDV
6H UHILHUHQ DO KHFKR GH TXH KD VHUHV YLYRV TXH VRQ H[FOXVLYRV
GH XQD GHWHUPLQDGD ]RQD SRUTXH KD KDELGR XQD EDUUHUD
ELRJUHRJUiILFD TXH KD LPSHGLGR VX H[SDQVLyQ FRPR RFXUUH FRQ HO
FDQJXUR R HO NRDOD GRV PDUVXSLDOHV GH $XVWUDOLD ~QLFRV HQ HO PXQGR
SRU HVWDU HVWD WLHUUD DLVODGD GHO UHVWR GH FRQWLQHQWHV
7DPELpQ ODV SUXHEDV ELRJHRJUiILFDV QRV LQIRUPDQ GH OD
SUR[LPLGDG GH FRQWLQHQWHV VHSDUDGRV HQ OD DFWXDOLGDG FRPR RFXUUH
FRQ ORV FDPpOLGRV DIULFDQRV GURPHGDULR FDPHOOR](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-71-320.jpg)

![SRU OR TXH VHUtD OD VHSDUDFLyQ GH ORV
FRQWLQHQWHV OD FDXVD GH OD HVSHFLDFLyQ VH TXH SURGXFH HQ HOORV
3UXHEDV HPEULROyJLFDV
6H EDVD HQ HO HVWXGLR GH ORV HPEULRQHV SDUD H[WUDHU
VHPHMDQ]DV R GLIHUHQFLDV HYROXWLYDV
$Vt VH REVHUYD TXH ORV HPEULRQHV GH
ORV YHUWHEUDGRV VRQ PX VHPHMDQWHV
HQWUH Vt KDVWD XQ GHWHUPLQDGR
PRPHQWR LQGLFDQGR FRQ HOOR HO RULJHQ
FRP~Q GH ORV PLVPRV 3RU HOOR VH GLFH
TXH HO GHVDUUROOR HPEULRQDULR X
RQWRJHQLD HV UHIOHMR GHO GHVDUUROOR
HYROXWLYR R ILORJHQLD](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-73-320.jpg)
![,(6 %$55,2 /25$1$ 7(0$ (92/8,Ð1
)8(1/$%5$'$ 3iJLQD 3HGUR RERV
3UXHEDV DFWXDOHV (VWiQ EDVDGDV HQ ELRORJtD PROHFXODU VRQ
,QPXQROyJLFDV
XDQGR XQD SDUWtFXOD H[WUDxD R DQWtJHQR SHQHWUD HQ XQ VHU YLYR
pVWH SURGXFH XQD UHDFFLyQ GHIHQVLYD IUHQWH D pO SURGXFLHQGR XQDV
SURWHtQDV HVSHFtILFDV R DQWLFXHUSR TXH VH XQHQ DO DQWtJHQR SDUD
QHXWUDOL]DUOR $ OD UHDFFLyQ VH OD GHQRPLQD ´UHDFFLyQ DQWtJHQR
DQWLFXHUSRµ 6H FRPSUXHED TXH ODV UHDFFLRQHV DQWtJHQRDQWLFXHUSR
VRQ WDQWR PiV YLUXOHQWDV FXDQWR PiV DOHMDGDV ILORJHQpWLFDPHQWH HVWiQ
ODV HVSHFLHV
6HFXHQFLDFLyQ GH SURWHtQDV
$O FRPSDUDU OD PLVPD SURWHtQD GH GRV HVSHFLHV GLVWLQWDV
SRGHPRV VDEHU VL HVWiQ PiV R PHQRV HPSDUHQWDGDV GHSHQGLHQGR GH
ODV GLIHUHQFLDV TXH KDD HQWUH HOODV (V PX XWLOL]DGD OD FRPSDUDFLyQ
GH KHPRJORELQD PLRJORELQD HQ DQLPDOHV OD FRPSDUDFLyQ GH
SLJPHQWRV IRWRVLQWHWL]DGRUHV HQ SODQWDV
+LEULGDFLyQ
/DV GRV KHEUDV GH ODV PROpFXODV GH $'1 SXHGHQ VHSDUDUVH EDMR
GHWHUPLQDGDV FRQGLFLRQHV IHQyPHQR GHQRPLQDGR GHVQDWXUDOL]DFLyQ
(VWD SURSLHGDG VH XWLOL]DGD SDUD FRPSDUDU HO JUDGR GH DSDUHDPLHQWR
KLEULGDFLyQ](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-74-320.jpg)
![GH $'1V GH HVSHFLHV GLVWLQWDV DO PH]FODU $'1
GHVQDWXUDOL]DGR GH GLFKDV HVSHFLHV SXGLHQGR H[WUDHU FRQFOXVLRQHV
VREUH VX SUR[LPLGDG HYROXWLYD GHSHQGLHQGR GHO JUDGR GH
DSDUHDPLHQWR GH VXV $'1V UHVSHFWLYRV D TXH D PDRU DSDUHDPLHQWR
PDRU SUR[LPLGDG HQ OD HYROXFLyQ](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-75-320.jpg)















































































































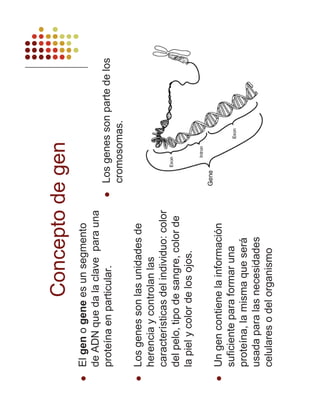


























































![%,2(/(0(1726 %,202/e8/$6
4. Clasificación
- Ver cuadro.
5. Enzimas
a. Concepto
- Biocatalizadores. Proteínas globulares que aceleran las reacciones bioquímicas (unas 10
7
veces).
Cada reacción que se produce en el organismo es catalizada por un enzima.
- Pueden ser holo- o heteroproteínas. En este último caso, la parte constituida por aminoácidos se
denomina Apoenzima (no activo), el grupo prostético se denomina cofactor y la unión de ambos es el
Holoenzima (activo).
- Los reactivos sobre los cuales actúan los enzimas se conocen como sustratos.
b. Propiedades
- Gran poder catalítico: son muy activas. Una pequeña cantidad de enzima es capaz de catalizar la
transformación de una gran cantidad de sustrato. Además aceleran mucho las reacciones (del orden
de 10
7
veces).
- No se gastan ni alteran durante la catálisis: son reutilizables.
- Altamente específicos: presentan especificidad de sustrato y de acción. Como el resto de las proteí-
nas son además característicos de cada especie.
c. Características de la actividad enzimática
- Reducen la energía de activación. Permiten que las reacciones bioquímicas transcurran rápidamente
y a bajas temperaturas (compatible con el mantenimiento de estructuras complejas).
- Poseen un centro activo. Zona de la molécula donde se une el sustrato. Al unirse enzima y sustrato
forman el complejo enzima-sustrato que luego se separará en enzima (listo para actuar otra vez) y
producto(s).
E + S → ES → E + P
Dos modelos para explicar la unión entre enzima y sustrato: la llave y la cerradura (formas com-
plementarias de centro activo y sustrato) y encaje inducido (la forma del centro activo se adapta a
la del sustrato cuando se produce la unión). No son incompatibles; pueden darse los dos modelos,
dependiendo del grado de especificidad del enzima.
- Presentan saturación con el sustrato. Alcanzan una vmáx, para una determinada concentración de
sustrato, cuando el enzima está trabajando a su máximo rendimiento (todos los centros activos están
ocupados en un instante determinado).
- Muchos enzimas requieren de cofactores: moléculas no proteicas que se unen al centro activo del
enzima y realizan o colaboran en la realización de la reacción. Los cofactores pueden ser:
Activadores inorgánicos: iones metálicos.
Coenzimas: moléculas orgánicas complejas.
d. Factores que influyen en la actividad enzimática
Temperatura
- La velocidad de las reacciones catalizadas enzimáticamente aumenta al aumentar la temperatura
hasta alcanzar su máxima actividad para una temperatura conocida como temperatura óptima. Por
encima de esa temperatura el enzima se hace inestable y se desnaturaliza, perdiendo su activi-
dad.
pH
- Cada enzima tiene un pH óptimo para el cual la actividad es máxima.
Inhibidores
- Los inhibidores son sustancias que impiden o reducen la actividad de un enzima. Pueden ser:
Irreversibles. Unión covalente. Algunos venenos inhiben así a ciertos enzimas.
Reversibles. No se altera el enzima, sólo se impide su acción. Tienen interés en la regulación de la
actividad enzimática.
Inhibición competitiva. El inhibidor se une al centro activo. La inhibición dependerá de las con-
centraciones relativas de enzima e inhibidor: si [S][I] el enzima estará activo; si [I][S] estará in-
activo)
Inhibición no competitiva. El inhibidor se une a un lugar distinto del centro activo (enzimas alosté-
ricos). El que el enzima esté activo o no depende de la concentración del inhibidor y es indepen-
diente de la concentración del sustrato.
e. Regulación de la actividad enzimática
- Dada su gran poder catalítico es importante regular la actividad de los enzimas para evitar su acción
cuando no son necesarios los productos que generan. Además, como las reacciones no catalizadas
son muy lentas, la regulación de la actividad enzimática es la mejor manera de regular el metabolis-
mo.
- El principal mecanismo de regulación de la actividad enzimática es la retroinhibición. Consiste en que
el producto final de una ruta metabólica actúa inhibiendo al primer enzima que interviene en la mis-
ma, bloqueando el proceso completo cuando la concentración del producto es elevada. En las rutas
ramificadas el producto final de cada ramificación actúa inhibiendo el primer enzima que interviene
en dicha ramificación.](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-247-320.jpg)













![3/5
4.- El agua es el líquido que más sustancias disuelve (disolvente universal).
Esta propiedad, tal
vez la más importante
para la vida, se debe
a su capacidad para
formar puentes de H,
además de con otras
moléculas de agua
como se dijo
anteriormente, con
otras sustancias
polares (grupos -OH
de alcoholes y
azúcares, grupos -NH2
de aminoácidos, proteínas, ácidos nucleicos, etc.), pues se disuelven cuando
interaccionan con las moléculas del agua.
5.- El agua posee un elevado calor específico. Se denomina calor específico a
la capacidad de almacenar energía para un aumento determinado de la temperatura: el
agua puede absorber grandes cantidades de calor, mientras que, proporcionalmente, su
temperatura sólo se eleva ligeramente. Del mismo modo, su temperatura desciende con
más lentitud que la de otros líquidos a medida que va liberando energía al enfriarse. Esta
propiedad permite que el contenido acuoso de las células sirva de protección a las
sensibles moléculas orgánicas ante los cambios bruscos de temperatura. Además, el calor
que se desprende en los procesos metabólicos no se acumula en los lugares donde se
produce, sino que se difunde en el medio acuoso y se disipa finalmente hacia el medio
externo.
6.- El agua posee una elevada fuerza de cohesión entre sus moléculas. Los
puentes de H mantienen a las moléculas de agua
fuertemente unidas, formando una estructura compacta
que la convierte en un líquido casi incompresible. Gracias a
esta propiedad algunos seres vivos utilizan el agua como
esqueleto hidrostático.
7.- El agua posee una elevada fuerza de
adhesión. Esta fuerza está también en relación con los
puentes de H que se establecen entre las moléculas de
agua y otras moléculas polares y es responsable, junto con
la cohesión, del llamado fenómeno de la capilaridad, es
decir, el ascenso de agua a través de las paredes de un capilar (delgado tubo de vidrio).
Los seres vivos van renovando continuamente su contenido en agua,
ingiriéndola con la alimentación y perdiéndola con la respiración como vapor y con la
excreción (orina, sudor, etc.)
2.3. SALES MINERALES: PROPIEDADES E IMPORTANCIA BIOLÓGICA
En todos los seres vivos, animales y vegetales, se encuentran siempre
determinadas cantidades de sales minerales. Se clasifican en función de su solubilidad en
agua. Las sustancias salinas insolubles en agua forman estructuras sólidas que suelen
cumplir funciones de protección y sostén y que están muy extendidas en todos los seres
vivos. Los Crustáceos y los Moluscos presentan caparazones de carbonato cálcico
(CO3Ca) mientras que en la Diatomeas son de sílice (SiO2). El esqueleto interno de los
Vertebrados presenta una parte mineral formada por la asociación de varios
componentes minerales, sobre todo carbonato y fosfato cálcico [(PO4)2Ca3]. Además, el
esmalte de los dientes presenta fluoruro cálcico (F2Ca).
En cuanto a las sales minerales solubles en agua, éstas se encuentran
disociadas en sus iones correspondientes, que son los responsables de su actividad
biológica. Los principales iones son:](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-261-320.jpg)
![4/5
Ÿ Cationes: Na+
, K+
, Mg2+
, Ca2+
y amonio (NH4
+
).
Ÿ Aniones: Cl-
, fosfatos (PO4
3-
, PO4H2
-
, PO4H2
-
), sulfato (SO4
2-
), nitrato (NO3
-
) y carbonatos (CO3
2-
, CO3H-
).
Los iones minerales realizan múltiples funciones en el organismo, destacando
las siguientes:
1.3.1.- Regulación de los fenómenos osmóticos: cuando dos disoluciones
salinas de distinta concentración se ponen en contacto a través de una membrana
semipermeable (llamada así porque permite el paso de agua pero no de los iones
disueltos en ella) las dos disoluciones tienden a equilibrar sus concentraciones y, como
los iones no pueden atravesar la membrana, es el agua de la disolución más diluida la
que va pasando a la más concentrada. Este trasiego de agua cesa cuando ambas
disoluciones adquieren la misma concentración. La disolución más concentrada recibe el
nombre de hipertónica respecto a la menos concentrada que es la hipotónica; en el
momento del equilibrio se dice que las dos disoluciones son isotónicas. Este fenómeno se
conoce con el nombre de ósmosis y el paso del agua a través de la membrana
semipermeable genera una presión llamada presión osmótica. Esta será mayor cuanto
mayor sea la diferencia en la concentración de las dos disoluciones. Los seres vivos
mantienen en sus células una presión osmótica constante gracias a las sales minerales,
fenómeno llamado homoósmia, y son muy sensibles a las variaciones de la misma, lo
cual acarrea serios trastornos. Por esta razón toda disolución que se ponga en contacto
directo con las células de un organismo debe ser isotónica con respecto a la disolución
salina de su interior, ya que las membranas celulares se comportan como
semipermeables. Existen dos ejemplos típicos que demuestran la importancia de los
fenómenos osmóticos en el mantenimiento de la integridad celular:
1.- Las células vegetales poseen una gran vacuola que comprime el
citoplasma contra la pared celular. Al ponerlas en contacto con una solución salina
hipertónica respecto del líquido de la vacuola, el agua de ésta fluye hacia el exterior de la
célula y, como consecuencia, la vacuola se reduce de tamaño arrastrando al citoplasma,
que puede llegar a separarse de la pared celular. Este fenómeno se denomina
plasmólisis. Por el contrario, si la solución que se pone en contacto con la célula es
hipotónica, la corriente de agua se establece hacia el interior, comprimiendo el
citoplasma contra la pared celular. Este caso se llama turgencia.
2.- Repitiendo la misma experiencia con glóbulos rojos, como éstos carecen
de pared celular vegetal, al ponerlos en contacto con una solución hipertónica,
disminuyen de volumen y se arrugan al salir agua al exterior. Si los ponemos en contacto
con una solución hipotónica, el agua pasa al interior y el glóbulo rojo se dilata, pudiendo
llegar a estallar rompiéndose su membrana. Este caso extremo se llama hemolisis.
1.3.2.- Regulación del equilibrio ácido-base: En los seres vivos existe siempre
una cierta cantidad de hidrogeniones (H+
) y de iones hidroxilo (OH-
) que proceden de:
a) La disociación del agua que proporciona los dos iones: H2O H+
+
OH-
b) La disociación de cuerpos con función ácida que proporcionan H+
: ClH
Cl-
+ H+
c) La disociación de cuerpos con función básica que proporcionan OH-
:NaOH
Na+
+ OH-
Los hidrogeniones tienen carácter ácido, mientras que los hidroxiliones lo
tienen alcalino. Por lo tanto la acidez o alcalinidad del medio interno de un organismo
dependerá de la proporción en que se encuentren los dos iones. Así será neutro cuando
[H+
]=[OH-
], ácido cuando [H+
][OH-
] y alcalino cuando [H+
][OH-
]. Para que los
fenómenos vitales puedan desarrollarse con normalidad es necesario que la
concentración de H+, que se expresa en valores de pH sea más o menos constante y
próxima a la neutralidad, es decir, pH=7. Sin embargo, en las reacciones que tienen
lugar durante el metabolismo se están liberando productos tanto ácidos como básicos
que tenderán a variar dicha neutralidad si no fuera porque los organismos disponen de
unos mecanismos químicos que se oponen automáticamente a las variaciones de pH.
Estos mecanismos se denominan sistemas amortiguadores o sistemas tampón, y en ellos
intervienen de forma fundamental las sales minerales. Lo más corriente es que el pH](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-262-320.jpg)






![/D PROpFXOD GHO DJXD HV XQ GLSROR 'HELGR D OD HOHFWURQHJDWLYLGDG GHO R[tJHQR
ORV HOHFWURQHV GH ORV KLGUyJHQRV VH GHVSOD]DQ KDFLD pVWH FDUJiQGRVH QHJDWLYDPHQWH HO
SROR GH OD PROpFXOD TXH RFXSD HO R[tJHQR DSDUHFLHQGR GRV SRORV SRVLWLYRV HQ ORV
KLGUyJHQRV
(QWUH ORV GLSRORV VH HVWDEOHFHQ IXHU]DV GH DWUDFFLyQ GHQRPLQDGDV SXHQWHV GH
KLGUyJHQR GH IRUPD TXH VH IRUPDQ PDFURPROpFXODV GH KDVWD PROpFXODV FRH[LVWLHQGR
pVWDV FRQ PROpFXODV DLVODGDV OR TXH GHWHUPLQD TXH HO DJXD SUHVHQWH PDRU SHVR
PROHFXODU VH SUHVHQWH HQ HVWDGR OtTXLGR $Vt VH IRUPD XQD HVWUXFWXUD RUGHQDGD
UHVSRQVDEOH GHO FRPSRUWDPLHQWR FDUDFWHUtVWLFR GHO DJXD DVt FRPR GH VXV SURSLHGDGHV
ItVLFDV TXtPLFDV
3URSLHGDGHV ItVLFR TXtPLFDV GHO DJXD
$FFLyQ GLVROYHQWH 6H OH FRQVLGHUD HO GLVROYHQWH XQLYHUVDO D TXH HV FDSD]
HVWDEOHFHU LQWHUDFFLRQHV FRQ LRQHV R PROpFXODV SRODUHV SURYRFDQGR VX GLVSHUVLyQ R
GLVROXFLyQ /DV PROpFXODV GH DJXD VH GLVSRQHQ DOUHGHGRU GH ORV LRQHV SRVLWLYRV FRQ OD
SDUWH QHJDWLYD GH VX PROpFXOD KDFLD HOORV HQ HO FDVR GH ORV LRQHV QHJDWLYRV
HQIUHQWDQGR VX SDUWH SRVLWLYD FRQVLJXLHQGR DVt DWUDHUORV 6H IRUPD DVt XQD FDSD GH
VROYDWDFLyQ DOUHGHGRU GH ORV PLVPRV TXH ORV LQGHSHQGL]D GLVSHUVD HQ HO VHQR DFXRVR
DSD GH VROYDWDFLyQ HQ WRUQR D XQ LyQ SRVLWLYR](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-269-320.jpg)
![/D FDSDFLGDG GLVROYHQWH HV OD UHVSRQVDEOH GH GRV IXQFLRQHV
+DFH GHO DJXD HO PHGLR LGHDO SDUD TXH VH GHVDUUROOHQ ODV UHDFFLRQHV GHO PHWDEROLVPR
HQ HO LQWHULRU FHOXODU
6H FRQVWLWXH FRPR XQ HILFD] PHGLR GH WUDQVSRUWH GH VXVWDQFLDV DSRUWH GH
QXWULHQWHV HOLPLQDFLyQ GH GHVHFKRV
(OHYDGD IXHU]D GH FRKHVLyQ HQWUH VXV PROpFXODV /RV SXHQWHV GH KLGUyJHQR
PDQWLHQHQ ODV PROpFXODV GH DJXD IXHUWHPHQWH XQLGDV IRUPDQGR XQD HVWUXFWXUD FRPSDFWD
TXH OD FRQYLHUWH HQ XQ OtTXLGR FDVL LQFRPSUHQVLEOH $O QR SRGHU FRPSULPLUVH SXHGH
WHQHU OD IXQFLyQ HQ DOJXQRV DQLPDOHV GH HVTXHOHWR KLGURVWiWLFR FRPR RFXUUH HQ
DOJXQRV JXVDQRV SHUPLWH GDU YROXPHQ D ODV FpOXODV 7DPELpQ H[SOLFD OD IXQFLyQ
PHFiQLFD DPRUWLJXDGRUD TXH HMHUFH HQ ODV DUWLFXODFLRQHV OtTXLGR VLQRYLDO](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-270-320.jpg)
![(OHYDGD IXHU]D GH DGKHVLyQ 6H GHEH DO HVWDEOHFLPLHQWR GH SXHQWHV GH
KLGUyJHQR HQWUH ODV PROpFXODV GH DJXD RWUDV PROpFXODV SRODUHV HV UHVSRQVDEOH MXQWR
FRQ OD FRKHVLyQ GHO OODPDGR IHQyPHQR GH OD FDSLODULGDG XDQGR VH LQWURGXFH XQ
FDSLODU WXER GH SHTXHxR GLiPHWUR](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-271-320.jpg)
![HQ XQ UHFLSLHQWH FRQ DJXD pVWD DVFLHQGH SRU HO
FDSLODU FRPR VL WUHSDVH DJDUUiQGRVH SRU ODV SDUHGHV KDVWD DOFDQ]DU XQ QLYHO VXSHULRU DO
GHO UHFLSLHQWH $ HVWH IHQyPHQR VH GHEH HQ SDUWH OD DVFHQVLyQ GH OD VDYLD EUXWD GHVGH ODV
UDtFHV KDVWD ODV KRMDV D WUDYpV GH ORV YDVRV OHxRVRV
*UDQ FDORU HVSHFtILFR (O FDORU HVSHFtILFR VH GHILQH FRPR OD FDQWLGDG GH FDORU
QHFHVDULD SDUD HOHYDU ž OD WHPSHUDWXUD GH JU GH DJXD (VWR KDFH TXH HO DJXD
DOPDFHQH R OLEHUH XQD JUDQ FDQWLGDG GH FDORU DO FDOHQWDUVH R DO HQIULDUVH OR TXH SHUPLWH
TXH HO DJXD DFW~H FRPR DPRUWLJXDGRU WpUPLFR HYLWDQGR EUXVFDV DOWHUDFLRQHV GH OD
WHPSHUDWXUD HYLWDQGR GH HVWD IRUPD TXH SRU HMHPSOR DOJXQDV PROpFXODV FRPR ODV
SURWHtQDV PX VHQVLEOHV D ORV FDPELRV WpUPLFRV VH DOWHUHQ $Vt VH PDQWLHQH OD
WHPSHUDWXUD FRQVWDQWH )XQFLyQ WHUPRUUHJXODGRUD](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-272-320.jpg)
![(OHYDGR FDORU GH YDSRUDFLyQ (O FDORU GH YDSRUL]DFLyQ HV HO TXH VH QHFHVLWD
VXPLQLVWUDU DO DJXD SDUD TXH FDPELH GHO HVWDGR OtTXLGR DO JDVHRVR HYDSRUL]DFLyQ](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-273-320.jpg)
![3DUD
HOOR HV QHFHVDULR URPSHU ORV SXHQWHV GH KLGUyJHQR SRU OR TXH VH QHFHVLWD VXPLQLVWUDU HO
FDORU VXILFLHQWH SDUD HOOR 'H DKt TXH HO DJXD FDPELH GH HVWDGR D ORV ž (O VXGRU TXH
VHJUHJDQ ORV VHUHV YLYRV SHUPLWH DFXPXODU HO H[FHVR GH FDORU GHO RUJDQLVPR DO
HYDSRUDUVH HOLPLQDUOR FRQ SRFD SpUGLGD GH DJXD DFWXDQGR DVt FRPR UHJXODGRU
WpUPLFR
(OHYDGD WHQVLyQ VXSHUILFLDO /DV PROpFXODV GH OD VXSHUILFLH GHO DJXD
H[SHULPHQWDQ IXHU]DV GH DWUDFFLyQ KDFLD HO LQWHULRU GHO OtTXLGR (VWR IDYRUHFH TXH GLFKD
VXSHUILFLH RSRQJD XQD JUDQ UHVLVWHQFLD D VHU WUDVSDVDGD RULJLQD XQD ³SHOtFXOD
VXSHUILFLDO´ TXH SHUPLWH SRU HMHPSOR HO GHVSOD]DPLHQWR VREUH HOOD GH DOJXQRV
RUJDQLVPRV
'HQVLGDG (O DJXD HQ HVWDGR OtTXLGR HV PDV GHQVD TXH HQ HVWDGR VyOLGR (VWR
SHUPLWH OD YLGD DFXiWLFD HQ FOLPDV IUtRV D TXH DO GHVFHQGHU OD WHPSHUDWXUD VH IRUPD
XQD FDSD GH KLHOR HQ OD VXSHUILFLH TXH IORWD SURWHJH DO DJXD OtTXLGD TXH TXHGD EDMR
HOOD
)XQFLRQHV GHO DJXD HQ ORV VHUHV YLYRV](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-274-320.jpg)
!['HULYDQ GH ODV SURSLHGDGHV ItVLFRTXtPLFDV DQWHULRUPHQWH H[SOLFDGDV
)XQFLyQ GH GLVROYHQWH XQLYHUVDO UHODFLRQDGD FRQ VX HVWUXFWXUD GLSRODU
)XQFLyQ HVWUXFWXUDO
)XQFLyQ WUDQVSRUWDGRUD HQ UHODFLyQ WDPELpQ FRQ VX HVWUXFWXUD GLSRODU VX HOHYDGD
IXHU]D GH DGKHVLyQ
)XQFLyQ WHUPRUUHJXODGRUD FRQGLFLRQDGD SRU VX JUDQ FDORU HVSHFtILFR FDORU GH
YDSRUL]DFLyQ
)XQFLyQ DPRUWLJXDGRUD UHODFLRQDGD FRQ OD HOHYDGD IXHU]D GH FRKHVLyQ HQWUH VXV
PROpFXODV
)XQFLyQ UHDFWLYD OR TXH HVWi UHODFLRQDGR FRQ VX HVWUXFWXUD GLSRODU
/26 )/8Ë'26 (1 /26 6(5(6 9,926
(O HVWXGLR GH ODV GLVROXFLRQHV HV IXQGDPHQWDO SDUD FRPSUHQGHU OD PDRU SDUWH GH ORV
SURFHVRV ELROyJLFRV TXH RFXUUHQ HQ HO LQWHULRU GH ORV VHUHV YLYRV
/RV IOXLGRV SUHVHQWHV HQ ORV VHUHV YLYRV FRQVWDQ GH XQD IDVH GLVSHUVDQWH TXH HV DFXRVD
GH XQD IDVH GLVSHUVD R VROXWR IRUPDGD SRU SDUWtFXODV GH SHTXHxR WDPDxR
6HJ~Q HO WDPDxR GH ODV SDUWtFXODV GH OD IDVH GLVSHUVD VH SXHGHQ FODVLILFDU HQ
'LVROXFLRQHV YHUGDGHUDV 6L HO WDPDxR HV LQIHULRU D QP /DV SDUWtFXODV
GLVXHOWDV VRQ LRQHV PROpFXODV DLVODGDV R SHTXHxDV DJUXSDFLRQHV TXH QR VHGLPHQWDQ
'LVSHUVLRQHV FRORLGDOHV 6L HO WDPDxR HVWi HQWUH QP /DV SDUWtFXODV QR
VHGLPHQWDQ SHUR UHIOHMDQ UHIUDFWDQ OD OX] TXH LQFLGH VREUH HOODV
8Q GH ORV SURFHVRV ItVLFRTXtPLFRV PiV LPSRUWDQWHV TXH WLHQHQ OXJDU HQ ODV GLVROXFLRQHV
YHUGDGHUDV HV OD yVPRVLV
Ï6026,6
/D yVPRVLV HV XQ SURFHVR ItVLFRTXtPLFR FRQVLVWHQWH HQ HO SDVR GHO GLVROYHQWH GH XQD
GLVROXFLyQ QR GHO VROXWR](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-275-320.jpg)
![D WUDYpV GH XQD PHPEUDQD VHPLSHUPHDEOH (O SDVR GHO
GLVROYHQWH VH UHDOL]D VLHPSUH GHVGH OD VROXFLyQ PiV GLOXLGD KLSRWyQLFD](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-276-320.jpg)




![x /$6 6$/(6 0,1(5$/(6
/DV VDOHV PLQHUDOHV VH SXHGHQ HQFRQWUDU HQ ORV VHUHV YLYRV HQ WUHV IRUPDV
6XVWDQFLDV PLQHUDOHV SUHFLSLWDGDV FRQVWLWXHQ HVWUXFWXUDV VyOLGDV LQVROXEOHV
FRQ QDWXUDOH]D HVTXHOpWLFD IRUPDQGR WDQWR H[RHVTXHOHWRV FRPR HQGRHVTXHOHWRV 3RU
HMHPSOR HO FDUERQDWR GH FDOFLR IRVIDWR GH FDOFLR OD VtOLFH HWF
6DOHV PLQHUDOHV GLVXHOWDV /DV VXVWDQFLDV PLQHUDOHV DO GLVROYHUVH HQ HO PHGLR
LQWHUQR DFXRVR GDQ OXJDU D DQLRQHV FDWLRQHV (VWRV LRQHV PDQWLHQHQ FRQVWDQWH HO JUDGR
GH VDOLQLGDG GHQWUR GHO RUJDQLVPR DXGDQ D PDQWHQHU HO JUDGR GH DFLGH] S+](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-281-320.jpg)
![OR TXH
HV LPSUHVFLQGLEOH SDUD HO FRUUHFWR GHVDUUROOR GH ODV UHDFFLRQHV PHWDEyOLFDV FHOXODUHV (O
PHGLR LQWHUQR GH ORV RUJDQLVPRV SUHVHQWD XQDV FRQFHQWUDFLRQHV LyQLFDV FRQVWDQWHV GH
KHFKR FXDOTXLHU YDULDFLyQ SURYRFD DOWHUDFLRQHV LPSRUWDQWHV HQ OD GLQiPLFD FHOXODU /D
PDRU R PHQRU SUHVHQFLD GH VDOHV HQ HO PHGLR LQWHUQR FHOXODU GHWHUPLQD TXH VH
SURGX]FDQ IHQyPHQRV RVPyWLFRV TXH UHJXOHQ ODV FRQFHQWUDFLRQHV D DPERV ODGRV GH OD
PHPEUDQD FHOXODU FRQ OR TXH VH UHJXOD OD SUHVLyQ RVPyWLFD HO YROXPHQ FHOXODU
3DUD HYLWDU ODV YDULDFLRQHV GH S+ TXH FDXVDUtDQ WUDVWRUQRV JUDYHV HQ DOJXQRV
SURFHVRV PHWDEyOLFRV OD SpUGLGD GH OD FDSDFLGDG IXQFLRQDO GH PXFKDV HQ]LPDV
DOJXQDV VDOHV PLQHUDOHV GLVXHOWDV FXPSOHQ HVWD IXQFLyQ IRUPDQGR GLVROXFLRQHV WDPSyQ
R DPRUWLJXDGRUDV TXH FRPSHQVDQ HO H[FHVR R HO GpILFLW GH LRQHV HQ HO PHGLR
PDQWHQLHQGR FRQVWDQWH HO S+ (VWDV GLVROXFLRQHV HVWiQ IRUPDGDV SRU XQ iFLGR GpELO VX
EDVH FRQMXJDGD TXH DFW~DQ FRPR GDGRUHV R UHFHSWRUHV GH + UHJXODQGR DVt HO S+ D
TXH HO S+ ORJ +](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-282-320.jpg)
![8Q HMHPSOR HV HO VLVWHPD WDPSyQ IRVIDWR
+32 +32 +
6DOHV PLQHUDOHV
DVRFLDGDV D PROpFXODV
RUJiQLFDV QRUPDOPHQWH
DSDUHFHQ DVRFLDGDV D SURWHtQDV R OtSLGRV
6H UHFRPLHQGD FRQVXOWDU
KWWSZZZRXWXEHFRPZDWFKY 82Z%ZF/$ IHDWXUH UHODWHG
KWWSZZZRXWXEHFRPZDWFKY VGL-W'5-4(F IHDWXUH UHODWHG
$FLGLILFD
1HXWUDOL]D](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-283-320.jpg)


![/D PROpFXOD GHO DJXD HV XQ GLSROR 'HELGR D OD HOHFWURQHJDWLYLGDG GHO R[tJHQR
ORV HOHFWURQHV GH ORV KLGUyJHQRV VH GHVSOD]DQ KDFLD pVWH FDUJiQGRVH QHJDWLYDPHQWH HO
SROR GH OD PROpFXOD TXH RFXSD HO R[tJHQR DSDUHFLHQGR GRV SRORV SRVLWLYRV HQ ORV
KLGUyJHQRV
(QWUH ORV GLSRORV VH HVWDEOHFHQ IXHU]DV GH DWUDFFLyQ GHQRPLQDGDV SXHQWHV GH
KLGUyJHQR GH IRUPD TXH VH IRUPDQ PDFURPROpFXODV GH KDVWD PROpFXODV FRH[LVWLHQGR
pVWDV FRQ PROpFXODV DLVODGDV OR TXH GHWHUPLQD TXH HO DJXD SUHVHQWH PDRU SHVR
PROHFXODU VH SUHVHQWH HQ HVWDGR OtTXLGR $Vt VH IRUPD XQD HVWUXFWXUD RUGHQDGD
UHVSRQVDEOH GHO FRPSRUWDPLHQWR FDUDFWHUtVWLFR GHO DJXD DVt FRPR GH VXV SURSLHGDGHV
ItVLFDV TXtPLFDV
3URSLHGDGHV ItVLFR TXtPLFDV GHO DJXD
$FFLyQ GLVROYHQWH 6H OH FRQVLGHUD HO GLVROYHQWH XQLYHUVDO D TXH HV FDSD]
HVWDEOHFHU LQWHUDFFLRQHV FRQ LRQHV R PROpFXODV SRODUHV SURYRFDQGR VX GLVSHUVLyQ R
GLVROXFLyQ /DV PROpFXODV GH DJXD VH GLVSRQHQ DOUHGHGRU GH ORV LRQHV SRVLWLYRV FRQ OD
SDUWH QHJDWLYD GH VX PROpFXOD KDFLD HOORV HQ HO FDVR GH ORV LRQHV QHJDWLYRV
HQIUHQWDQGR VX SDUWH SRVLWLYD FRQVLJXLHQGR DVt DWUDHUORV 6H IRUPD DVt XQD FDSD GH
VROYDWDFLyQ DOUHGHGRU GH ORV PLVPRV TXH ORV LQGHSHQGL]D GLVSHUVD HQ HO VHQR DFXRVR](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-286-320.jpg)
![DSD GH VROYDWDFLyQ HQ WRUQR D XQ LRQ SRVLWLYR
/D FDSDFLGDG GLVROYHQWH HV OD UHVSRQVDEOH GH GRV IXQFLRQHV
+DFH GHO DJXD HO PHGLR LGHDO SDUD TXH VH GHVDUUROOHQ ODV UHDFFLRQHV GHO PHWDEROLVPR
HQ HO LQWHULRU FHOXODU
6H FRQVWLWXH FRPR XQ HILFD] PHGLR GH WUDQVSRUWH GH VXVWDQFLDV DSRUWH GH
QXWULHQWHV HOLPLQDFLyQ GH GHVHFKRV
(OHYDGD IXHU]D GH FRKHVLyQ HQWUH VXV PROpFXODV /RV SXHQWHV GH KLGUyJHQR
PDQWLHQHQ ODV PROpFXODV GH DJXD IXHUWHPHQWH XQLGDV IRUPDQGR XQD HVWUXFWXUD FRPSDFWD
TXH OD FRQYLHUWH HQ XQ OtTXLGR FDVL LQFRPSUHQVLEOH $O QR SRGHU FRPSULPLUVH SXHGH
WHQHU OD IXQFLyQ HQ DOJXQRV DQLPDOHV GH HVTXHOHWR KLGURVWiWLFR FRPR RFXUUH HQ
DOJXQRV JXVDQRV SHUPLWH GDU YROXPHQ D ODV FpOXODV 7DPELpQ H[SOLFD OD IXQFLyQ
PHFiQLFD DPRUWLJXDGRUD TXH HMHUFH HQ ODV DUWLFXODFLRQHV OtTXLGR VLQRYLDO](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-287-320.jpg)
![(OHYDGD IXHU]D GH DGKHVLyQ 6H GHEH DO HVWDEOHFLPLHQWR GH SXHQWHV GH
KLGUyJHQR HQWUH ODV PROpFXODV GH DJXD RWUDV PROpFXODV SRODUHV HV UHVSRQVDEOH MXQWR
FRQ OD FRKHVLyQ GHO OODPDGR IHQyPHQR GH OD FDSLODULGDG XDQGR VH LQWURGXFH XQ
FDSLODU WXER GH SHTXHxR GLiPHWUR](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-288-320.jpg)
![HQ XQ UHFLSLHQWH FRQ DJXD pVWD DVFLHQGH SRU HO
FDSLODU FRPR VL WUHSDVH DJDUUiQGRVH SRU ODV SDUHGHV KDVWD DOFDQ]DU XQ QLYHO VXSHULRU DO
GHO UHFLSLHQWH $ HVWH IHQyPHQR VH GHEH HQ SDUWH OD DVFHQVLyQ GH OD VDYLD EUXWD GHVGH ODV
UDtFHV KDVWD ODV KRMDV D WUDYpV GH ORV YDVRV OHxRVRV
*UDQ FDORU HVSHFtILFR (O FDORU HVSHFtILFR VH GHILQH FRPR OD FDQWLGDG GH FDORU
QHFHVDULD SDUD HOHYDU ž OD WHPSHUDWXUD GH JU GH DJXD (VWR KDFH TXH HO DJXD
DOPDFHQH R OLEHUH XQD JUDQ FDQWLGDG GH FDORU DO FDOHQWDUVH R DO HQIULDUVH OR TXH SHUPLWH
TXH HO DJXD DFW~H FRPR DPRUWLJXDGRU WpUPLFR HYLWDQGR EUXVFDV DOWHUDFLRQHV GH OD
WHPSHUDWXUD HYLWDQGR GH HVWD IRUPD TXH SRU HMHPSOR DOJXQDV PROpFXODV FRPR ODV
SURWHtQDV PX VHQVLEOHV D ORV FDPELRV WpUPLFRV VH DOWHUHQ $Vt VH PDQWLHQH OD
WHPSHUDWXUD FRQVWDQWH )XQFLyQ WHUPRUUHJXODGRUD](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-289-320.jpg)
![(OHYDGR FDORU GH YDSRUDFLyQ (O FDORU GH YDSRUL]DFLyQ HV HO TXH VH QHFHVLWD
VXPLQLVWUDU DO DJXD SDUD TXH FDPELH GHO HVWDGR OtTXLGR DO JDVHRVR HYDSRUL]DFLyQ](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-290-320.jpg)
![3DUD
HOOR HV QHFHVDULR URPSHU ORV SXHQWHV GH KLGUyJHQR SRU OR TXH VH QHFHVLWD VXPLQLVWUDU HO
FDORU VXILFLHQWH SDUD HOOR 'H DKt TXH HO DJXD FDPELH GH HVWDGR D ORV ž (O VXGRU TXH
VHJUHJDQ ORV VHUHV YLYRV SHUPLWH DFXPXODU HO H[FHVR GH FDORU GHO RUJDQLVPR DO
HYDSRUDUVH HOLPLQDUOR FRQ SRFD SpUGLGD GH DJXD DFWXDQGR DVt FRPR UHJXODGRU
WpUPLFR
(OHYDGD WHQVLyQ VXSHUILFLDO /DV PROpFXODV GH OD VXSHUILFLH GHO DJXD
H[SHULPHQWDQ IXHU]DV GH DWUDFFLyQ KDFLD HO LQWHULRU GHO OtTXLGR (VWR IDYRUHFH TXH GLFKD
VXSHUILFLH RSRQJD XQD JUDQ UHVLVWHQFLD D VHU WUDVSDVDGD RULJLQD XQD ³SHOtFXOD
VXSHUILFLDO´ TXH SHUPLWH SRU HMHPSOR HO GHVSOD]DPLHQWR VREUH HOOD GH DOJXQRV
RUJDQLVPRV
'HQVLGDG (O DJXD HQ HVWDGR OtTXLGR HV PDV GHQVD TXH HQ HVWDGR VyOLGR (VWR
SHUPLWH OD YLGD DFXiWLFD HQ FOLPDV IUtRV D TXH DO GHVFHQGHU OD WHPSHUDWXUD VH IRUPD
XQD FDSD GH KLHOR HQ OD VXSHUILFLH TXH IORWD SURWHJH DO DJXD OtTXLGD TXH TXHGD EDMR
HOOD](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-291-320.jpg)
![)XQFLRQHV GHO DJXD HQ ORV VHUHV YLYRV
'HULYDQ GH ODV SURSLHGDGHV ItVLFRTXtPLFDV DQWHULRUPHQWH H[SOLFDGDV
)XQFLyQ GH GLVROYHQWH XQLYHUVDO UHODFLRQDGD FRQ VX HVWUXFWXUD GLSRODU
)XQFLyQ HVWUXFWXUDO
)XQFLyQ WUDQVSRUWDGRUD HQ UHODFLyQ WDPELpQ FRQ VX HVWUXFWXUD GLSRODU VX HOHYDGD
IXHU]D GH DGKHVLyQ
)XQFLyQ WHUPRUUHJXODGRUD FRQGLFLRQDGD SRU VX JUDQ FDORU HVSHFtILFR FDORU GH
YDSRUL]DFLyQ
)XQFLyQ DPRUWLJXDGRUD UHODFLRQDGD FRQ OD HOHYDGD IXHU]D GH FRKHVLyQ HQWUH VXV
PROpFXODV
)XQFLyQ UHDFWLYD OR TXH HVWi UHODFLRQDGR FRQ VX HVWUXFWXUD GLSRODU
/26 )/8Ë'26 (1 /26 6(5(6 9,926
(O HVWXGLR GH ODV GLVROXFLRQHV HV IXQGDPHQWDO SDUD FRPSUHQGHU OD PDRU SDUWH GH ORV
SURFHVRV ELROyJLFRV TXH RFXUUHQ HQ HO LQWHULRU GH ORV VHUHV YLYRV
/RV IOXtGRV SUHVHQWHV HQ ORV VHUHV YLYRV FRQVWDQ GH XQD IDVH GLVSHUVDQWH TXH HV DFXRVD
GH XQD IDVH GLVSHUVD R VROXWR IRUPDGD SRU SDUWtFXODV GH SHTXHxR WDPDxR
6HJ~Q HO WDPDxR GH ODV SDUWtFXODV GH OD IDVH GLVSHUVD VH SXHGHQ FODVLILFDU HQ
'LVROXFLRQHV YHUGDGHUDV 6L HO WDPDxR HV LQIHULRU D QP /DV SDUWtFXODV
GLVXHOWDV VRQ LRQHV PROpFXODV DLVODGDV R SHTXHxDV DJUXSDFLRQHV TXH QR VHGLPHQWDQ
'LVSHUVLRQHV FRORLGDOHV 6L HO WDPDxR HVWi HQWUH QP /DV SDUWtFXODV QR
VHGLPHQWDQ SHUR UHIOHMDQ UHIUDFWDQ OD OX] TXH LQFLGH VREUH HOODV
8Q GH ORV SURFHVRV ItVLFRTXtPLFRV PiV LPSRUWDQWHV TXH WLHQHQ OXJDU HQ ODV GLVROXFLRQHV
YHUGDGHUDV HV OD yVPRVLV
Ï6026,6
/D yVPRVLV HV XQ SURFHVR ItVLFRTXtPLFR FRQVLVWHQWH HQ HO SDVR GHO GLVROYHQWH GH XQD
GLVROXFLyQ QR GHO VROXWR](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-292-320.jpg)
![D WUDYpV GH XQD PHPEUDQD VHPLSHUPHDEOH (O SDVR GHO
GLVROYHQWH VH UHDOL]D VLHPSUH GHVGH OD VROXFLyQ PiV GLOXtGD KLSRWyQLFD](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-293-320.jpg)




![x /$6 6$/(6 0,1(5$/(6
/DV VDOHV PLQHUDOHV VH SXHGHQ HQFRQWUDU HQ ORV VHUHV YLYRV HQ WUHV IRUPDV
6XVWDQFLDV PLQHUDOHV SUHFLSLWDGDV FRQVWLWXHQ HVWUXFWXUDV VyOLGDV LQVROXEOHV
FRQ QDWXUDOH]D HVTXHOpWLFD IRUPDQGR WDQWR H[RHVTXHOHWRV FRPR HQGRHVTXHOHWRV 3RU
HMHPSOR HO FDUERQDWR GH FDOFLR IRVIDWR GH FDOFLR OD VtOLFH HWF
6DOHV PLQHUDOHV GLVXHOWDV /DV VXVWDQFLDV PLQHUDOHV DO GLVROYHUVH HQ HO PHGLR
LQWHUQR DFXRVR GDQ OXJDU D DQLRQHV FDWLRQHV (VWRV LRQHV PDQWLHQHQ FRQVWDQWH HO JUDGR
GH VDOLQLGDG GHQWUR GHO RUJDQLVPR DXGDQ D PDQWHQHU HO JUDGR GH DFLGH] S+](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-298-320.jpg)
![OR TXH
HV LPSUHVFLQGLEOH SDUD HO FRUUHFWR GHVDUUROOR GH ODV UHDFFLRQHV PHWDEyOLFDV FHOXODUHV (O
PHGLR LQWHUQR GH ORV RUJDQLVPRV SUHVHQWD XQDV FRQFHQWUDFLRQHV LyQLFDV FRQVWDQWHV GH
KHFKR FXDOTXLHU YDULDFLyQ SURYRFD DOWHUDFLRQHV LPSRUWDQWHV HQ OD GLQiPLFD FHOXODU /D
PDRU R PHQRU SUHVHQFLD GH VDOHV HQ HO PHGLR LQWHUQR FHOXODU GHWHUPLQD TXH VH
SURGX]FDQ IHQyPHQRV RVPyWLFRV TXH UHJXOHQ ODV FRQFHQWUDFLRQHV D DPERV ODGRV GH OD
PHPEUDQD FHOXODU FRQ OR TXH VH UHJXOD OD SUHVLyQ RVPyWLFD HO YROXPHQ FHOXODU
3DUD HYLWDU ODV YDULDFLRQHV GH S+ TXH FDXVDUtDQ WUDVWRUQRV JUDYHV HQ DOJXQRV
SURFHVRV PHWDEyOLFRV OD SpUGLGD GH OD FDSDFLGDG IXQFLRQDO GH PXFKDV HQ]LPDV
DOJXQDV VDOHV PLQHUDOHV GLVXHOWDV FXPSOHQ HVWD IXQFLyQ IRUPDQGR GLVROXFLRQHV WDPSyQ
R DPRUWLJXDGRUDV TXH FRPSHQVDQ HO H[FHVR R HO GpILFLW GH LRQHV HQ HO PHGLR
PDQWHQLHQGR FRQVWDQWH HO S+ (VWDV GLVROXFLRQHV HVWiQ IRUPDGDV SRU XQ iFLGR GpELO VX
EDVH FRQMXJDGD TXH DFW~DQ FRPR GDGRUHV R UHFHSWRUHV GH + UHJXODQGR DVt HO S+ D
TXH HO S+ ORJ +](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-299-320.jpg)
![8Q HMHPSOR HV HO VLVWHPD WDPSyQ IRVIDWR
+32 +32 +
6DOHV PLQHUDOHV
DVRFLDGDV D PROpFXODV
RUJiQLFDV QRUPDOPHQWH
DSDUHFHQ DVRFLDGDV D SURWHtQDV R OtSLGRV
6H UHFRPLHQGD FRQVXOWDU
KWWSZZZRXWXEHFRPZDWFKY 82Z%ZF/$ IHDWXUH UHODWHG
$FLGLILFD
1HXWUDOL]D](https://image.slidesharecdn.com/guiatematicanaturalesydelasalud20151-160226005225/85/Guia-tematica-300-320.jpg)