Isoenzimas
- 1. CARACTERÍSTICAS Y FUNCIONES GENERALES DE LAS ENZIMAS Integrantes: • Martínez Martínez Adriana Guadalupe • Reséndiz Leal Luis Eduardo • Rivera Garduño Diana • Rosales Rojas Raúl
- 2. ENZIMA El prefijo griego En(dentro) y la palabra griega zime (levadura o fermento). Una enzima es una proteína que cataliza las reacciones bioquímicas del metabolismo. Las enzimas actúan sobre las moléculas conocidas como sustratos y permiten el desarrollo de los diversos procesos celulares.
- 4. CONCEPTOS FUNDAMENTALES • CATALIZADOR • ENZIMA • RIBOZIMA • COFACTOR • COENZIMA • GRUPO PROSTÉTICO
- 5. NOMENCLATURA • SUFIJO (ASA) TOMADO DEL NOMBRE DE SU SUSTRATO. • BETA-LACTAMICOS CONOCIDOS COMO PENICILINASAS O LACTAMASAS
- 6. NOMENCLATURA SISTEMÁTICA Consta de tres partes fundamentales: ATP: Hexosa fosfotransferasa § El sustrato preferente. § El tipo de reacción realizada. § Terminación «asa». Aceptor Grupo transferido Donador
- 7. • Un código numérico encabezadas por las letras EC (Enzyme Comission) • Cuatro números separados por puntos • 1) clase perteneciente • 2)subclase perteneciente • 3y 4) grupos químicos que intervienen en la reacción. NUMERO SISTEMÁTICO
- 8. GRUPO 1: OXIDOREDUCTASAS Catalizan las reacciones de óxido reducción. en las reacciones redox, siempre tienen que estar presentes a la vez el aceptor y el dador electrónico. Subclases: • Deshidrogenasas • Oxidasas • Hidrolasas
- 9. GRUPO 2: TRANSFERASAS Catalizan reacciones de transferencia del grupo. Subclases •Quinasas
- 10. GRUPO 3: HIDROLASAS Catalizan la ruptura de enlaces químicos con la participación de moléculas de agua. Subclases •Fosfatasas
- 11. GRUPO 4: LIASAS Generan o hacen desaparecer dobles enlaces en forma no oxidativa. Subclases • Hidratasas
- 12. GRUPO 5: ISOMERASAS Catalizan cambios estructurales dentro de una misma molécula (reacciones de isomeracion). Como estas reacciones solo tienen un sustrato y un producto son de las reacciones enzimáticas más simples. Subclases • Mutasas • Epimerasas
- 13. GRUPO 6: LIGASAS Catalizan la ligadura o unión de dos sustratos. Estas reacciones necesitan un suministro de energía potencial química de un nucleosido Trifosfato. Subclases • EC 6.1= Carbono- Oxigeno • EC 6.2= Carbono- Azufre • EC 6.3= Carbono- Nitrógeno • EC 6.4= Carbono- Carbono • EC 6.5= Esteres fosfóricos • EC 6.6= Nitrógeno- Metal
- 14. HOLOENZIMAS • Se refiere a la enzima activa con su factor no proteico. Es una coenzima con una apoenzima que estan unidas por un enlace covalente o no covalente.
- 15. Apoenzima • Se refiere a una enzima inactiva con un factor proteico. Es una holoenzima sin coenzima. Caracteristicas. • Naturaleza proteica • Peso molecular elevado • No dializable y termolábil. • Hay de peso molecular bajo: • Con una sola cadena polipeptídica: Ejemplos: 1. Ribonucleasa 2. Papaína 3. Tripsina 4. Pepsina, etc. • Son proteínas oligoméricas.
- 16. COFACTOR • Su mitad es un ion metalico (ya no un factor no proteico o proteico), ejemplo: el Zn2+o el Fe2+. • Ejemplo, las enzimas de la coagulación sanguínea que requieren Ca +2 y las oxidorreductasas, que a su vez utilizan Fe, Cu y Mn.
- 17. COENZIMAS a) Es una molécula orgánica pequeña, que catalíticamente no esta activa y si se llegasen a asociar de modo transitorio a una enzima se llama COSUSTRATO. b) Reciben o ceden un fragmento, químicamente activado, proveniente del sustrato c) No se consumen en la reacción y sólo actúan captando y liberando ciertos grupos b) Si la coenzima esta asociada permanentemente con la enzima y vuelve a su forma original se llama grupo prostético. c) La mayoría de coenzimas normalmente proceden de las vitaminas.. Por ejemplo, el NAD+ contiene niacina y el FAD contiene riboflavina actúan en reacciones oxido reductasas. d) También son llamados grupos prostéticos (algunos autores las consideran diferentes pero en realidad se dice que se descontinuara la terminología coenzima y solo quedara el grupo prostético). La única función de las vitaminas hidrosolubles del complejo B es ser integrantes de las coenzimas Diferencias entre las anteriores: 1) Grupo prostético: esta firmemente unido a una enzima. 2) Coenzima: esta laxamente unido a una proteína.
- 18. • Las coenzimas pueden clasificarse como: 1) Transferencia de grupos diferentes a hidrogeno: qUridina difosfato (UDP) qPirofosfato de Tiamina (TPP). qFosfato de Pirirdoxal (Ppal). qCoenzima A (CoA-SH) qAcido tetrahidrofolico (TH4) qBiotina qCoenzima de cobamida (B12) qAcido Lipoico qS-adenosil metionina (SAM). 2) Transferencia de Hidrogeno: qNAD +, NADP+ qFAD,FMN qAcido Lipoico qCoenzima Q.
- 20. ISOENZIMAS • Las isoenzimas son formas diversas de una enzima que les confieren peculiaridades metabólicas a los tejidos del organismo. • Proteínas que catalizan la misma reacción, con los mismos requerimientos, pero con propiedades cinéticas y fisicoquímicas diferentes, lo cual permitió su descubrimiento y estudio. • Apoenzimas que difieren entre si en su estructura, pero que catalizan la misma reaccion con el mismo sustrato.
- 21. • Aunque existen numerosas enzimas que presentan formas isoenzimáticas, el primer caso conocido y el más estudiado es la lactato deshidrogenasa (LDH); esta enzima existe en todos los tejidos y en todos estos cataliza la misma reacción. La LDH1 del corazón, músculos, y hematíes La LDH2 del sistema retículo endotelial y leucocitos La LDH3 de los pulmones La LDH4 de los riñones, placenta y páncreas. La LDH5 del hígado y musculo
- 22. • El caso más ilustrativo es el de la deshidrogenasa láctica, enzima tetraédrica que posee dos subunidades distintas: H (de corazón) y M (de musculo). Estas dos subunidades se combinan de cinco formas diferentes para formar cinco isoenzimas
- 23. ENZIMAS OLIGOMERICAS • Enzimas monoméricas: • Constituidas por una sola cadena polipeptídica, no presentan estructura cuaternaria. Pero la gran mayoría de las enzimas son oligoméricas: • Si están formadas por: • Dos subunidades à Dímeros • Tres subunidades à Trímero • Cuatro subunidades à Tetrámero • Cinco subunidades à Pentámero • etc.
- 25. COMPLEJOS MULTIENZIMATICOS • Algunas reacciones requieren de múltiples enzimas asociadas que participan secuencialmente para transformar un sustrato. • Ejemplos: Piruvato deshidrogenasa y la sisntetasa de acidos grasos • Un complejo enzimático es una serie de enzimas que se reúnen para cumplir una función determinada.
- 28. CATALISIS Conjunto de Procedimientos No altera la energía libre de la reacción. La velocidad con la que transcurre una reacción se incremente RAMA DE LA CINETICA QUIMICA CATALISIS • Proceso por el cual se aumenta la velocidad de una reacción química. CATALIZADOR • Sustancia que incrementa la velocidad de la reacción sin alterar la energía libre de Gibbs estándar de la misma; el proceso se denomina catálisis.
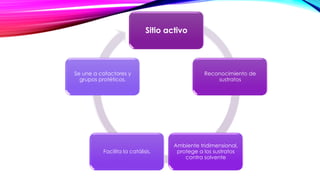
- 29. Sitio activo Reconocimiento de sustratos Ambiente tridimensional, protege a los sustratos contra solvente Facilita la catálisis. Se une a cofactores y grupos protéticos.
- 30. ENZIMATICA HOMOGENEA HETEROGENEA • Ocurre en las reacciones bioquímicas. • Forma un complejo de adición con la molécula del sustrato. • Se produce en una sola fase. • El catalizador está disperso uniformemente. • Forma un complejo de adición con la molécula del sustrato • La reacción se produce en la interfase. • El catalizador es sólido y los reactivos son gases o líquidos.
- 32. CATALISIS POR PROXIMIDAD CATALISIS ACIDO-BASICA • Las moléculas deben acercarse hasta ubicarse dentro de la distancia formadora de enlace de la otra molécula. • Mas alta concentración, mayor índice de reacción. • Cuando una enzima se une a moléculas de sustrato en su sitio activo, crea una región de concentración local alta de sustrato. • Transferencia de protones. • Grupos funcionales ionizables de cadenas laterales aminoacilo y de grupos prostéticos. q ESPECIFICA: El índice de reacción es sensible a cambios de la concentración de protones. No importa la concentración de otros ácidos o bases. q GENERAL: reacciones cuyos índices muestran capacidad de respuesta a todos los ácidos y/o bases presentes.
- 33. CATALISIS COVALENTE CATALISIS POR TENSION • Enzima covalente=enzima + 1 o más sustratos. • Enzima modificada se convierte en un reactivo. • Nueva vía de reacción con energía de activación mas baja. • Modificación transitoria. • Residuos: cisteína, histidina y/o serina. • El primer sustrato es unido y su producto se libera antes de la unión del segundo sustrato. • Los enzimas que catalizan reacciones – líticas que comprender la ruptura de enlace covalente se unen a sus sustratos desfavorablemente para el enlace que tendrá división. • La tensión resultante estira el enlace al cual se dirige, lo debilita y lo hace vulnerable a división.
- 34. AUXILIARES… METALES: Cargas +, unión de moléculas pequeñas. Mediadores en reacción oxido- reducción. Electrófilos. GRUPOS PROSTETICOS, COENZIMAS Y COFACTORES Extienden el repertorio de capacidades catalíticas. Actúan directamente en la unión de sustrato
- 35. VITAMINAS Sustancias orgánicas imprescindibles para el metabolismo celular, las cuales se necesitan en muy pequeña cantidad, pero que nuestras células no pueden fabricar a partir de otras sustancias. COENZIMAS Pequeñas moléculas orgánicas no proteicas que transportan grupos químicos entre enzimas. Son sustratos de las enzimas. La mayoría de las coenzimas derivan de las vitaminas.
- 36. Funciones generales de las enzimas: COENZIMA. • Funcionan con muchas enzimas que tienen distinta especifidad de sustrato.
- 37. ESPECIFICIDAD QUIERE DECIR… • Una de las principales caracteristicas de las enzimas es su alta especificidad. Las enzimas son especificas para: a) el substrato b) la reaccion Ello significa que las enzimas pueden catalizar la transformacion de apenas un substrato o una familia de substratos relacionados estructuralmente, catalizando solo una de las posibles reacciones que ese substrato puede experimentar. Cuando la enzima solo puede actuar sobre un tipo de substrato, se dice que la enzima muestra especificidad absoluta para el substrato. Por ejemplo en el caso de la deshidrogenasa succinica, que es especifica para el succinato, o la L-glutamico deshidrogenasa, especifica para el glutamato.
- 39. Las vitaminas son: • Sustancias indispensables para el funcionamiento adecuado de los seres vivos • Cuando faltan en la dieta producen: AVITAMINOSIS • Las vitaminas hidrosolubles del complejo B forman parte de la estructura de una coenzima o un grupo prostético.
- 40. Cuadro 3-2 Coenzimas Nombre Abreviatura Vitamina presente Grupo acarreado en forma Enfermedad en humanos por carencia Dinucleótido de nicoti- namida y adenina NAD+ Nicotinamida Hidruros (H-) Pelagra Fosfato de dinucleótido de nicotinamida y adenina NADP+ Nicotinamida Hidruros (H-) Pelagra Mononucleótido de riboflavina FMN Riboflavina Hidrógenos (H2) Queilosis, glositis, dermatitis seborreica, etc. Dinucleótido de flavina y adenina FAD Riboflavina Hidrógenos (H2) Queilosis, glositis, dermatitis seborreica, etc. Pirofosfato de tiamina TPP Tiamina Aldehídos Beriberi Lipoil-lisina Ácido lipoico Acilos No se conoce Coenzima A CoA Ácido pantoténico Acilos No se conoce Fosfato de Piridoxal o piridoxal-5-fosfato P5P Piridoxina Amino (de aminoácidos) ¿Cuadros convulsivos? Biotina --- Biotina CO2 No se conoce Tetrahidrofolato FH4 Ácido fólico Fragmentos de un carbono Anemia macrocítica Coenzima B12 --- B12 Metilos Anemia perniciosa
- 41. Coenzimas Redox
- 42. • Muchas vitaminas actúan como coenzimas. • Son precursores o son parte de las coenzimas. • Su carencia impide un correcto funcionamiento de los enzimas con las que actúan como coenzima. • Alteraciones metabólicas. RELACIÓN ENTRE VITAMINAS Y COENZIMAS
- 43. VITAMINA DERIVADO FUNCIÓN B1 TIAMINA Pirofosfato de tiamina Metabolismo energético de glúcidos. B2 RIBOFLAVINA Nucleótidos coenzimaticos Reductor B3 NIACINA Nucleótidos coenzimaticos Reductor B5 ÁCIDO PANTOTÉNICO Coenzima A Procesos metabólicos B6 PIRIDOXINA Fosfato de piridoxal, fosfato de piridoxamina Metabolismo de aminoácidos B7 BIOTINA Biocitina Funcionamiento de carboxilasas B9 ACIDO FÓLICO FH4 Síntesis de purinas
- 44. BIBLIOGRAFIA • Pacheco, D. (1999). BIOQUIMICA ESTRUCTURAL Y APLICADA A LA MEDICINA. México: SEP IPN. Pág. 177 • Trudy Mckfee “Bioquimica, las bases moleculares de la vida”, Ed. Mc Graw Hill, 4° edición (2009), Pag. 202-212. • Robert Murray, “Harper, Bioquimica Ilustrada, Editorial Mc Graw Hill, 28° Edicion (2010), Pag 52-54. • Pacheco Leal, Daniel. 2010. Bioquímica, estructura y aplicación a la Medicina. México, D.F. Editorial: Instituto Politecnico Nacional. • Koolman, J. Y Heinrich Röhm, K. 2004, tercera edición, Bioquímica, Texto y Atlas. Editorial: Panamericana. • Hay es, J. W y Dominiczak, M. H. 2011. Bioquímica Médica. España, Barcelona. Editorial: Elsevier