SistemáTica InorgáNica
- 1. SISTEMÁTICA INORGÁNICA Compuestos químicos Lic. Verónica Rosso
- 2. Nomenclatura de las sustancias simples: Fórmula general de la sustancia simple: Xp X: especifica el elemento que forma la sustancia p: especifica la atomicidad de la sustancia ATOMICIDAD : cantidad de átomos Metales y gases nobles son Monoatómicos (1 átomo en la molécula) es decir p=1 ej: Na; Ca; Mg; Xe; Ne; He; etc. Gases de los elementos representativos son Biatómicos (2 átomos en la molécula) es decir p=2 Son H 2 ; N 2 ; O 2 ; Cl 2 ; F 2 ; Br 2 ; I 2 Existen elementos Poliatómicos pero no hay una regla general para determinarlos, dependen de la forma alotrópica de la sustancia. ej: P 4 : fósforo blanco es tetratómico P 8 : fósforo rojo es octatómico O 2 : oxígeno es diatómico O 3 : ozono es triatómico
- 3. Nomenclatura de las sustancias compuestas: “Formadas por más de 1 elemento” En estas sustancias nos interesan los IONES que son átomos que perdieron o ganaron electrones al unirse con otros átomos y adquirieron cargas negativas o positivas llamada “CARGA IONICA”
- 4. ÓXIDOS BÁSICOS ANIÓN (carga negativa) + CATIÓN (carga positiva) El anión siempre es el anión óxido O2- El catión siempre es un METAL PROPIEDADES PRINCIPALES : Neutralizan los ácidos Reacción azul con el tornasol Su fórmula se obtiene intercambiando los números de oxidación respectivos. El número de oxidación del oxígeno es -2 El número de oxidación de los metales casi siempre coincide con el número de grupo al cual pertenecen, ej: Na+ ; Ca 2 +; K+ pero generalmente los de transición tiene 2 tipos de valencia, ej: Cu+ y Cu 2 + ; Fe 2 + y Fe 3 + Así tenemos: Na 2 O, CaO, Cu 2 O, CuO, K 2 O, BaO
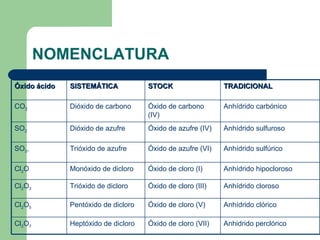
- 5. ÓXIDOS ÁCIDOS NO METAL + OXÍGENO PROPIEDADES PRINCIPALES Neutralizan a las bases Dan reacción roja con el tornasol La mayoría son compuestos gaseosos La Unión es Covalente: los electrones se comparten. Así tenemos: CO 2 , SO 2 , SO 3 , Cl 2 O, Cl 2 O 3 , Cl 2 O 5 , Cl 2 O 7
- 6. O2- O2- Cl2O S4- Cl- S2O4 SO2 Na+ O2- Na2O
- 7. NOMENCLATURA ---- Óxido de bario Monóxido de bario BaO --- Óxido de calcio Monóxido de calcio CaO Óxido cúprico Óxido de cobre (II) Monóxido de dicobre CuO Óxido cuproso Óxido de cobre (I) Monóxido de cobre Cu 2 O ---- Óxido de sodio Monóxido de disodio Na 2 O TRADICIONAL STOCK SISTEMÁTICA Óxido básico
- 8. NOMENCLATURA Anhídrido clórico Óxido de cloro (V) Pentóxido de dicloro Cl 2 O 5 Anhídrido cloroso Óxido de cloro (III) Trióxido de dicloro Cl 2 O 3 Anhidrido perclórico Óxido de cloro (VII) Heptóxido de dicloro Cl 2 O 7 Anhídrido hipocloroso Óxido de cloro (I) Monóxido de dicloro Cl 2 O Anhídrido sulfúrico Óxido de azufre (VI) Trióxido de azufre SO 3 , Anhídrido sulfuroso Óxido de azufre (IV) Dióxido de azufre SO 2 Anhídrido carbónico Óxido de carbono (IV) Dióxido de carbono CO 2 TRADICIONAL STOCK SISTEMÁTICA Óxido ácido
- 9. La expresión anhídrido implica la carencia de agua en estos compuestos lo cual ocurre precisamente en algunos ácidos con oxígeno que son deshidratados mediante calentamiento dando lugar a la formación de estos óxidos o anhídridos: H2SO4 ---> SO3 + H2O Ácido sulfúrico anhídrido sulfúrico 2HNO3---> N2O5 + H2O ácido nítrico anhídrido nítrico 2H3PO4---> P2O5 + 3 H2O Ácido fosfórico anhídrido fosfórico
- 10. HIDRUROS NO METÁLICOS: HIDRÁCIDOS ANIÓN MONOATÓMICO + CATIÓN HIDRÓGENO Cl- H+ ClH S2- H+ SH2 NOMENCLATURA: NOMBRE DEL ANIÓN de hidrógeno Ejemplos: HCl: cloruro de hidrógeno H2S: sulfuro de hudrógeno Ácido NOMBRE DEL ANIÓN (cambia URO por HÍDRICO ) Ejemplos: HCl: ácido clorhídrico H2S: ácido sulfhídrico
- 11. HIDRUROS NO METÁLICOS: HIDRÁCIDOS Compuestos binarios (no metal e hidrógeno) que en solución acuosa son capaces de liberar el ión H+; para ello se requiere que el HIDRÓGENO esté unido covalentemente con elementos de alta electronegatividad como los halógenos. Para nombrarlos se antepone la palabra ÁCIDO (cuando se describe al compuesto en solución acuosa) al no metal y se reemplaza su última vocal por la terminación HIDRICO. Cuando no se encuentran en solución acuosa, no presentan comportamiento como ácidos, de donde la manera que se adopta para nombrarlos es la correspondiente a las sales de haluros. Por ejemplo para el HCl se emplea cloruro de hidrógeno. Existen algunas compuestos entre el carbono con otros elementos de alta electronegatividad que forman sustancias con características ácidas: HCN ácido cianhídrico y HSCN ácido sulfocianhídrico
- 12. excepciones NH3 = amoníaco CH4= metano H2O = agua PH3 = fosfina Algunos elementos como el Nitrógeno, el Oxígeno y el Fósforo; aún siendo de alta electronegatividad no formar compuestos binarios ácidos con el hidrógeno y aún pueden comportarse como bases al disolverlos en agua.
- 13. HIDRUROS METÁLICOS Son compuestos caracterizados por la presencia de Hidrógeno combinado con un metal. Ya que el hidrógeno es más electronegativo que los metales, necesariamente su estado de oxidación será negativo. LiH hidruro de litio CaH2 hidruro de calcio MgH2 hidruro de magnesio Para darles nombre se menciona la palabra HIDRURO que será el nombre genérico para todos aquellos compuestos donde el hidrógeno presente estado de oxidación (-1).Después se especifica el nombre del metal que interviene.
- 14. HIDRÓXIDOS CATIÓN + ANIÓN OXHIDRILO (HIDROXILO) K+ OH- KOH Fe2+ OH- Fe3+ OH- Fe(OH)2 Fe(OH)3 NOMENCLATURA: Hidróxido de CATIÓN Ejemplos: KOH: hidróxido de potasio Fe(OH)2: hidróxido de hierro (II) o hidróxido ferroso Fe(OH)3: hidróxido de hierro (III) o hidróxido férrico
- 15. HIDRÓXIDOS Son compuestos ternarios con características básicas (colorean de azul el papel tornasol) que presentan en su fórmula el anión monovalente oxidrilo (OH)-1. El grado de basicidad de los hidróxidos depende de la electronegatividad del metal.
- 16. OXOÁCIDOS CATIÓN HIDRÓGENO + ANIÓN POLIATÓMICO H+ ClO- HClO H+ SO4 2- H+ PO4 3- H2SO4 H3PO4 Nota : en la nomenclatura tradicional cambia la terminación: Ito (Anión) x oso Ato (Anión) x ico
- 17. NOMENCLATURA Ácido clórico Clorato (V) de hidrógeno Trioxoclorato de hidrógeno HClO 3 Ácido cloroso Clorato (III) de hidrógeno Dioxoclarato de hidrógeno HClO 2 Ácido perclórico Clorato (VII) de hidrógeno Tetraoxoclorato de hidrógeno HClO 4 Ácido hipocloroso Clorato (I) de hidrógeno Monoxoclorato de hidrógeno HClO Ácido sulfúrico Sulfato (VI) de hidrógeno Tetraoxosulfato de dihidrógeno H 2 SO 4 Ácido sulfuroso Sulfato (IV) de hidrógeno trioxosulfato de dihidrógeno H 2 SO 3 Ácido carbónico carbonato (IV) de hidrógeno trioxocarbonato de dihidrógeno H 2 CO 3 TRADICIONAL STOCK SISTEMÁTICA Óxido ácido
- 18. OXOÁCIDOS Son compuestos ternarios con características ácidas (colorean de rojo el papel tornasol). Estos compuestos además del oxígeno presentan en su estructura átomos de HIDRÓGENO. Al disolverse el compuesto en agua producen iones hidronio (H3O)+1 en la solución. Según la cantidad de hidrógenos (H) presentes en su estructura se clasifican en: MONOPRÓTICOS con uno, DIPRÓTICOS con dos y POLIPRÓTICOS con tres o más.
- 19. Existen ácidos que se forman bajo condiciones especiales originando compuestos diferentes donde participan los mismos elementos con igual estado de oxidación: HPO3 H3PO4 H4P2O7 En los tres casos el fósforo tiene estado de oxidación +5, el oxígeno -2 y el hidrógeno +1. El fósforo determina el nombre de los ácidos como FOSFÓRICO, pero, como se trata de compuestos distintos, se debe diferenciarlos a través del uso de prefijos alusivos a las condiciones de reacción que determinan el compuesto formado: P2O5+ H2O ---> 2 HPO3 Anh. Fosfórico Ácido metafosfórico *META: más pequeño Reacción que ocurre limitando la cantidad de agua P2O5+ 3 H2O ---> 2 H3PO4 Acido ortofosfórico *ORTO: el más común, lo correcto. Este ácido es el más común, normalmente conocido como ÁCIDO FOSFÓRICO; se puede observar que la cantidad de agua es mayor. El ácido ortofosfórico por calentamiento, puede sufrir una deshidratación parcial: 2 H3PO4---> H4P2O7+ H2O Ácido fosfórico Ácido pirofosfórico *PIRO: Fuego (por el calentamiento)
- 20. SALES DE HIDRÁCIDOS ANIÓN MONOATÓMICO + CATIÓN Cl- Na+ ClNa S2- K+ SK2 NOMENCLATURA: NOMBRE DEL ANIÓN (uro) de NOMBRE DEL CATIÓN Ejemplos: ClNa: cloruro de sodio K2S: sulfuro de potasio
- 21. SALES DE HIDRÁCIDOS Estos compuestos son generalmente producidos por neutralización de ACIDOS y BASES, o por la acción directa de estos compuestos sobre los METALES. Su nombre se establece mencionando al NO METAL con la terminación URO seguido del METAL. También aquí es necesario determinar estados de oxidación, los cuales estarán señalados por la terminación OSO o ICO en caso de nomenclatura común; o bien los NUMEROS ROMANOS empleados para la NOMENCLATURA STOCK.
- 22. OXOSALES CATIÓN METÁLIDO + ANIÓN POLIATÓMICO K+ ClO- KClO Ca2+ SO4 2- Ba2+ PO4 3- CaSO 4 Ba 3 (PO 4 ) 2 NOMENCLATURA: NOMBRE DEL ANIÓN (ito ó ato) de NOMBRE DEL CATIÓN Ejemplos: KClO: hipoclorito de potasio CaSO 4 : sulfato de calcio Ba 3 (PO 4 ) 2 : fosfato de bario ó ortofosfato de bario
- 23. OXOSALES Son compuestos iónicos ternarios o poliatómicos; no presentan propiedades básicas ni ácidas y tampoco reaccionan con el agua para producir sustancias con esas propiedades. Se producen mediante reacciones de neutralización de ÁCIDOS OXIGENADOS con HIDROXIDOS o con METALES.
- 24. SALES ÁCIDAS La existencia de ácidos dipróticos y polipróticos permite que ocurran neutralizaciones parciales de estos originando SALES ÁCIDAS así como también a partir de hidróxidos con múltiples (OH)-1 se pueden formar SALES BÁSICAS. Estas sales pueden en una reacción posterior ser neutralizadas por completo pudiendo dar lugar a la formación de SALES MIXTAS.
- 25. SALES ÁCIDAS NaHCO3 carbonato ácido de sodio o bicarbonato de sodio Mg(HSO4)2 sulfato ácido de magnesio o bisulfato de magnesio Ca(H2PO4)2 fosfato diácido de calcio. La palabra ácido indica la cantidad de hidrógenos que existen en el anión.
- 26. SALES BÁSICAS Al(OH)Cl2 hidroxicloruro de aluminio o cloruro básico de aluminio Al(OH)2Cl dihidroxicloruro de aluminio o cloruro dibásico de aluminio La palabra hidroxi o básico indica la cantidad de oxhidrilos que existen en el catión.
- 27. SALES MIXTAS NaKCO3 carbonato de potasio y sodio KNaLiPO4 fosfato de litio, sodio y potasio