Aprend 45
- 1. BLOQUE III 45. Relaciona la masa de las sustancias con el mol para determinar la cantidad de sustancia.
- 2. volumen. Avogadro tuvo la precaución de especificar que las partículas no tenían por qué ser átomos individuales sino que podían ser combinaciones de átomos (lo que hoy llamamos moléculas). Con esta consideración pudo explicar con facilidad la ley de la combinación de volúmenes que había sido anunciada por Gay-Lussac y, basándose en ella, dedujo que el oxígeno era 16 veces más pesado que el hidrógeno y no ocho como defendía Dalton en aquella época. Enunció la llamada hipótesis de Avogadro: iguales volúmenes de gases distintos contienen el mismo número de moléculas, si ambos se encuentran a igual temperatura y presión. Ese número, equivalente a 6,022· 1023, es constante, según publicó en 1811. Como ha ocurrido muchas veces a lo largo de la historia las propuestas de Avogadro no fueron tomadas en cuenta, es más, Dalton,
- 3. Concepto de mol Cantidad de sustancia En función del SI (sistema internacional de unidades)
- 5. 1 mol Es la cantidad de materia que contienen 6.02 x 1023 partículas elementales (ya sea átomos, moléculas, iones partículas subatómicas Concepto de mol
- 6. 1 mol Cuya masa en gramos es numéricamente igual al peso formular de la sustancia 1 Mol de Azufre (S) = 32.07 g 1 Mol de H2O = 18.00 g En función de la masa Concepto de mol
- 7. 1 mol contiene 6.02 x 1023 partículas Representa el Número de Avogadro (NA) En función del número de partículas Concepto de mol
- 9. El mol 6.02 x 1023 átomos, si es un elemento. 6.02 x 1023 moléculas si es un compuesto covalente. 6.02 x 1023 fórmulas unitarias si es compuesto iónico. Es la cantidad de sustancia que contienen:
- 10. El número de Avogadro (NA) El número de fórmulas unitarias contenidas en 1 mol de cualquier sustancia iónica. El número de moléculas que hay en 1 mol (molécula – gramo) de cualquier compuesto covalente. Indica: El número de átomos que hay en 1 mol (átomo – gramo) de cualquier elemento.
- 11. Moles Átomos Gramos (Masa atómica) 1 mol de S 6.022 x 1023 átomos de S 32.06 g de S 1 mol de Cu 6.022 x 1023 átomos de Cu 63.55 g de Cu 1 mol de N 6.022 x 1023 átomos de N 14.01 g de N 1 mol de Hg 6.022 x 1023 átomos de Hg 200.59 g de Hg 2 moles de K 1.2044 x 1023 átomos de K 78.20 g de K 0.5 moles de P 3.0110 x 1023 átomos de P 15.485 g de P
- 12. ¿Cuántas moléculas hay en 5 moles de H2O? Ejemplo 1 mol de H2O tiene 6.02 x 1023 moléculas 5 moles H2O x 6.02 x 1023 moléculas de H2O 1 mol de H2O 30.1 x 1023 moléculas de H2O = Se multiplica por la Relación Molar (factor de conversión)
- 13. • Ejemplos: Calcule la masa molar de los siguientes compuestos. KOH (hidróxido de potasio) • K = 1 x 39.10 =39.10 • O = 1 x 16.00 =16.00 • H = 1 x 1.01 = 1.01 • 56.11 g • Cu 3(PO4)2 (sulfato de cobre II) Cu3 = 3 x 63.55 = 190.65 P2 = 2 x 30.97 = 61.04 O8 = 8 x 16 = 128 379.69 g • Al2(SO3)3 (sulfito de aluminio) Al2 = 2 x 26.98 = 53.96 S3 = 3 x 32.06 = 96.18 O9 = 9 x 16 = 144 294.14 g
- 14. ¿Cuántas fórmulas unitarias hay en tres moles de NaNO3? 1 mol de Na NO3 tiene 6.02 x 1023 F.U. 3 moles NaNO3 x 6.02 x 1023 F.U. de NaNO3 1 mol de NaNO3 18.06 x 1023 F.U. de NaNO3 = Se multiplica por la Relación Molar (factor de conversión) Ejemplo
- 15. Actividad 2.4 El mol y el número de partículas
- 16. La masa en gramos de un mol de una sustancia La masa en g de 6.02 x 1023 partículas. Ya que la masa atómica del carbono es 12 uma, la masa molar es igual a la masa atómica, pero expresada en g. La masa molar es es
- 17. EJERCICIOS 1. ¿Cuántas moles de hierro representan 25.0 g de hierro (Fe)? 1 mol de Fe = 56g = 25g 2. ¿Cuántos moles de magnesio están contenidos en 5.00 g de magnesio (Mg)? 1 mol de Mg = 24.31g = 5g
- 18. EJERCICIOS ¿Cuántas moles de NaOH (hidróxido de sodio) hay en 1.0 Kg de esta sustancia? ¿Cuántos moles serán 27 g de hidróxido de calcio? (Ca(OH)2)
- 19. La suma de las masas atómicas de los átomos que forman una molécula es la masa molecular. Normalmente se miden en Unidad de Masa Atómica (uma); o bien como lo llamamos gramos. ENCUENTRA LA MASA MOLECULAR DE LOS SIGUIENTES COMPUESTOS: H2SO4 (Ácido Sulfúrico) CaCO3 (Carbonato de Calcio) NaOH (Hidróxido de Sodio) 2 moles de plata (Ag) 5 moles de NaCl 18 moles de H2O 2 moles de Ca
- 20. Masa molar = es la masa de 1 mol de cualquier sustancia: Elemento o compuesto (covalente o iónico). Las unidades de masa molar son: g/mol Kg/mol.
- 21. La masa molar del carbono es 12.01 g o 12.01 g/mol Elementos: La masa molar, se calcula igual para compuestos covalentes o iónicos. Compuestos: La masa molar del agua es 18.0 g o 18.0 g/mol Ejemplo
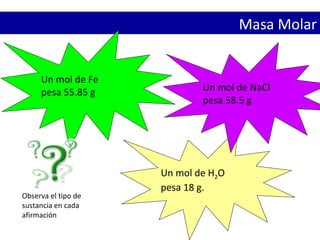
- 22. Masa Molar Un mol de Fe pesa 55.85 g Un mol de H2O pesa 18 g. Observa el tipo de sustancia en cada afirmación Un mol de NaCl pesa 58.5 g
- 23. ¿Cuántos moles de NaCl hay en 25 gramos de la sal ? 1 mol de NaCl pesa 58.5 gr 25 gr de NaCl x 58.5 gr de NaCl 1 mol de NaCl 0.427 mol de NaCl= Se multiplica por la Relación Molar (factor de conversión) Ejemplo
- 24. ¿Cuántos gramos de Na2SO4 hay en 2.5 moles de la sal? 1 mol de Na2SO4 pesa 142.00 gramos 2.5 moles Na2SO4 x 142.00 gramos de Na2SO4 1 mol de Na2SO4 355.00 gramos de Na2SO4 = Se multiplica por la Relación Molar (factor de conversión) Ejemplo
- 25. Actividad 2.5 El mol y la Masa de sustancia
- 26. Concepto de mol 1 mol NA partículas Masa Molar contiene pesa pesan La constante de Avogadro ( NA) : 6.02 x 1023
- 27. Relación entre moles y NA Un mol de carbono (carbón vegetal) tiene una masa de 12 g y contiene 6.022 x 10 23 átomos de carbono.
- 28. Número de Avogadro Una muestra de cualquier elemento cuya masa en gramos sea igual a su masa molar contiene el mismo número de átomos, moléculas y/o fórmulas unitarias NA, independientemente del tipo de elemento y/o compuesto. A este número se le conoce como Número de Avogadro NA = 6.022 x 1023 Masa molar del S: 32.07 g NA = 6.022 x 1023 átomos Masa molar del H2O: 18 g NA = 6.022 x 1023 Moléculas Mas molar del Na2SO4: 142.0 g NA = 6.022 x 1023 Fórmulas unitarias
- 29. El número de Avogadro nos permite calcular la masa relativa de un átomo o de una molécula de cualquier elemento o compuesto, por ejemplo: ¿Cuál es la masa en gramos de un átomo de calcio? (Masa atómica del calcio = 40 g) Ejemplos con Número de Avogadro 1 átomo de calcio x 40 g Calcio 6.02 x 1023 átomos = 6.64 x 10-23 g
- 30. ¿Cuántos gramos hay en 2.3 x 10 24 moléculas de H2O? 1 mol de H2O pesa 18 g y contiene 6.02 x 1023 molèculas 2.3 x 1024 moléculas de H2O x 18 g de H2O 6.02 x 1023 moléculas de H2O 3.05 x 101 g de H2O = Se multiplica por la Relación Molar (factor de conversión) Ejemplo