Clase 5 Enlaces AtóMicos
- 3. Atomic Macro
- 4. Atomic Macro
- 5. Atomic Macro
- 6. Atomic Macro
- 7. Atomic Macro
- 8. Atomic Macro
- 9. Atomic Macro
- 10. Atomic Macro
- 11. Atomic Macro
- 12. Atomic Macro
- 13. Atomic Macro
- 14. Atomic Macro
- 15. Atomic Macro
- 16. Atomic Macro
- 17. Los átomos se combinan para formar compuestos más estables . Los átomos más estables son los gases nobles Por consiguiente, la configuración electrónica más estable es isoelectrónica con un gas noble
- 18. Cuando los átomos interactúan, solo entran en contacto sus regiones externas. Para los enlaces, se consideran solamente los electrones de valencia Lewis desarrolló un sistema de puntos que representa un átomo con sus electrones de valencia. Excepto para el He, el número de electrones de valencia es igual al número de grupo
- 19. F Ne Electrones de valencia Capa exterior completa
- 20. Problemas Escriba los símbolos de puntos de Lewis para los átomos de los siguientes elementos: a) Be, b) K, c) Ca, d) Ga, e) O, f) Br, g) N Escriba los símbolos de Lewis para los siguientes iones: a) Li + , b) Cl - , c) S -2 , d) Sr ++ , e) N -3
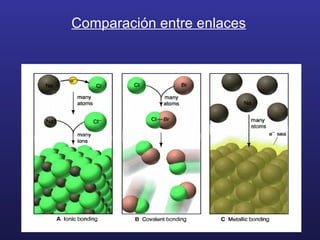
- 21. Tipos de enlaces primarios 1) El enlace iónico 2) El enlace covalente 3) El enlace metálico
- 22. 1) El enlace iónico Electronegatividad: es la capacidad de un átomo para atraer hacia sí los electrones de un enlace químico Se diferencia de la Afinidad Electrónica en que esta se refiere al átomo y la electronegatividad al enlace Tiene relación con la Afinidad Electrónica y la Energía de Ionización
- 23. Afinidad Electrónica Energía de Ionización Electro- negatividad Afinidad Electrónica Energía de Ionización Electro- negatividad
- 25. Los átomos con gran diferencia de electronegatividad (2,0 o más) forman enlaces iónicos Los electrones se transfieren de los átomos con menor EN a los átomos con mayor electronegatividad Se producen cationes cargados positivamente y aniones cargados negativamente La atracción electrostática da “fuerza” al enlace
- 26. Na Cl - +
- 27. Los sólidos iónicos tienen altas energías reticulares ( energía necesaria para separar un mol de compuesto en iones en estado gaseoso ) Por consiguiente, tienen puntos de fusión relativamente altos. A mayor tamaño del ión, es menor la energía reticular. Ej: LiCl (829 KJ/mol); CsCl (649 Kj/mol) Son sólidos solubles en agua y conductores
- 28. 2. El enlace covalente Se forma en enlaces con pequeñas diferencias de electronegatividad, ubicados muy próximos en la tabla periódica Generalmente se comparten electrones s y p externos con otros átomos . Los enlaces pueden ser sencillos o múltiples
- 29. Moléculas con no metales Moléculas con metales y no metales Sólidos elementales Compuestos sólidos Prevalente en cerámicos y polímeros
- 30. El enlace covalente puede ser a) No polar: el par de electrones de enlace se comparte en forma equitativa entre dos átomos. Ej: H 2 , O 2 .
- 31. Oxygen Atom Oxygen Atom Oxygen Molecule (O 2 )
- 33. b) Enlace covalente polar: cuando los átomos que forman el enlace tienen electronegatividades diferentes, la nube electrónica se desplaza más fuertemente hacia el átomo más electronegativo
- 35. Cuando se forman enlaces covalentes entre átomos poliatómicos, quedan electrones que no forman enlace, conocidos como pares libres. Los enlaces pueden ser dobles (CO 2 ) o triples (N 2 ). Los enlaces triples son más cortos que los dobles, los que a su vez son más cortos que los simples.
- 36. Enlace Covalente Coordinado: es el caso en que los electrones del enlace son aportados por uno solo de los átomos. El átomo que aporta el par (el menos electronegativo) se llama donador y el que los recibe aceptor S O O O O S O
- 37. Propiedades: El enlace covalente no es conductivo porque los electrones están fuertemente atraídos por ambos núcleos El punto de fusión es variado, en compuestos como el diamante los enlaces se extienden en el espacio, pero en la mayoría de los casos los enlaces son limitados y la interacción entre moléculas es débil
- 38. 3. El enlace Metálico Los átomos de los metales se caracterizan por tener pocos electrones de valencia. Además tienen mucha facilidad para moverse en el nivel de energía en que se encuentran (nivel más externo)
- 39. Los átomos de un elemento con enlace metálico se encuentran ordenados muy juntos en una estructura cristalina. Los electrones de valencia son atraídos por varios núcleos.
- 40. Los electrones no están férreamente asociados a un núcleo particular: son electrones libres. No hay restriccciones sobre pares electrónicos como en el enlace covalente ni sobre la neutralidad como en los enlaces iónicos.
- 41. Propiedades: Debido a la movilidad de los electrones de valencia, son buenos conductores eléctricos. La interacción entre los cationes vibrantes y los electrones hace que sean buenos conductores de calor. Cuando baja la temperatura, baja la vibración, y disminuye la resistencia al paso de la corriente: el material se vuelve superconductor
- 42. Como los enlaces no son tan fijos, los distintos átomos de un metal pueden deslizarse unos sobre otros, lo que hace que puedan deformarse sin rotura.
- 44. Todos los elementos metálicos Blando a duro, punto de fusión bajo a alto, buen conductor de calor y electricidad Enlace metálico Metálico H 2 O, sacarosa Suave, punto de fusión bajo, mal conductor de calor y electricidad Fuerzas de dispersión, fuerzas dipolo-dipolo, enlaces de hidrógeno Molecular C (diamante), SiO 2 (cuarzo) Duro, punto de fusión alto, mal conductor de calor y electricidad Enlace covalente Covalente NaCl, LiF, MgO, CaCO 3 Duro, Quebradizo, punto de fusión alto, mal conductor de calor y electric. Atracción electrostática Iónico Ejemplos Propiedades Fuerzas de unión Tipo de cristal