Nom 031 ssa2
- 1. NORMA Oficial Mexicana NOM-031-SSA2-1999, Para la atención a la salud del niño. Publicado en el Diario Oficial de la Federación el 9 de febrero de 2001 Al margen un sello con el Escudo Nacional, que dice: Estados Unidos Mexicanos.- Secretaría de Salud. NORMA OFICIAL MEXICANA NOM-031-SSA2-1999, PARA LA ATENCION A LA SALUD DEL NIÑO. ROBERTO TAPIA CONYER, Presidente del Comité Consultivo Nacional de Normalización de Prevención y Control de Enfermedades, con fundamento en los artículos 39 de la Ley Orgánica de la Administración Pública Federal; 4o. y 69-H de la Ley Federal de Procedimiento Administrativo; 3o., fracciones II, IV y XV, 13 apartado A), fracción I, 133, fracción I, y demás relativos de la Ley General de Salud; 38, fracción II, 40, fracciones III y XI, 41 y 47, fracción IV de la Ley Federal sobre Metrología y Normalización; 28 y 34 del Reglamento de la Ley Federal sobre Metrología y Normalización; 7, fracciones V y XIX y 39, fracción IV del Reglamento Interior de la Secretaría de Salud, me permito ordenar la publicación en el Diario Oficial de la Federación de la Norma Oficial Mexicana NOM-031-SSA2-1999, Para la atención a la salud del niño, y CONSIDERANDO Que con fecha 22 de septiembre de 1999, en cumplimiento de lo previsto en el artículo 46, fracción I de la Ley Federal sobre Metrología y Normalización, la Coordinación de Vigilancia Epidemiológica presentó al Comité Consultivo Nacional de Normalización de Prevención y Control de Enfermedades, el anteproyecto de la presente Norma Oficial Mexicana. Que con fecha 9 de junio de 2000, en cumplimiento de lo previsto en el artículo 47, fracción I de la Ley Federal sobre Metrología y Normalización, se publicó en el Diario Oficial de la Federación el proyecto de la presente Norma Oficial Mexicana, a efecto de que dentro de los siguientes sesenta días naturales posteriores a dicha publicación, los interesados presentaran sus comentarios al Comité Consultivo Nacional de Normalización, de Prevención y Control de Enfermedades. Las respuestas a los comentarios recibidos por el mencionado Comité, fueron publicadas previamente a la expedición de esta Norma en el Diario Oficial de la Federación, en los términos del artículo 47, fracción III de la Ley Federal sobre Metrología y Normalización. Que en atención a las anteriores consideraciones, contando con la aprobación del Comité Consultivo Nacional de Normalización, de Prevención y Control de Enfermedades, se expide la siguiente: NORMA OFICIAL MEXICANA NOM-031-SSA2-1999, PARA LA ATENCION A LA SALUD DEL NIÑO PREFACIO En la elaboración de la presente Norma Oficial Mexicana, participaron las siguientes instituciones, asociaciones y organismos: SECRETARIA DE SALUD. Subsecretaría de Prevención y Control de Enfermedades. Centro de Vigilancia Epidemiológica.
- 2. Consejo Nacional de Vacunación. Coordinación de Institutos Nacionales de Salud. Dirección General de Enseñanza en Salud. Dirección General de Estadística e Informática. Dirección General de Extensión de Cobertura. Dirección General de Promoción de la Salud. Dirección General de Regulación de los Servicios de Salud. Dirección General de Salud Reproductiva. Dirección General Adjunta de Epidemiología. Biológicos y Reactivos de México. Consejo Nacional para la Prevención y Control del Síndrome de Inmunodeficiencia Adquirida. Consejo Nacional Contra las Adicciones. Hospital Infantil de México. Instituto Nacional de Ciencias Médicas y de la Nutrición "Dr. Salvador Zubirán". Instituto Nacional de Perinatología. Instituto Nacional de Pediatría. Instituto de Diagnóstico y Referencia Epidemiológicos. Laboratorio Nacional de Salud Pública. SECRETARIA DE COMUNICACIONES Y TRANSPORTES. Dirección General de Medicina Preventiva en el Transporte. SECRETARIA DE LA DEFENSA NACIONAL. Dirección General de Sanidad Militar. SECRETARIA DE MARINA. Dirección General de Sanidad Naval. PETROLEOS MEXICANOS. Gerencia de Servicios Médicos. INSTITUTO MEXICANO DEL SEGURO SOCIAL. Régimen Ordinario. Régimen de Solidaridad Social. INSTITUTO DE SEGURIDAD Y SERVICIOS SOCIALES DE LOS TRABAJADORES DEL ESTADO. Subdirección General Médica. INSTITUTO NACIONAL INDIGENISTA. Subdirección de Salud y Bienestar Social. SISTEMA NACIONAL PARA EL DESARROLLO INTEGRAL DE LA FAMILIA. COMISION NACIONAL DEL AGUA. ACADEMIA MEXICANA DE CIRUGIA. AMERICAN BRITISH COWDRAY HOSPITAL. ASOCIACION MEXICANA DE HOSPITALES, A.C. ASOCIACION MEXICANA DE INFECTOLOGIA Y MICROBIOLOGIA CLINICA. ASOCIACION MEXICANA DE PEDIATRIA, A.C. ASOCIACION NACIONAL DE PADRES DE FAMILIA.
- 3. FUNDACION MEXICANA PARA LA SALUD. HOSPITAL ANGELES DEL PEDREGAL. LA LIGA DE LA LECHE DE MEXICO, A.C. SOCIEDAD MEXICANA DE SALUD PUBLICA, A.C. SOCIEDAD MEXICANA DE PEDIATRIA, A.C. FONDO DE LAS NACIONES UNIDAS PARA LA INFANCIA EN MEXICO. ORGANIZACION PANAMERICANA DE LA SALUD EN MEXICO. INDICE 0. Introducción 1. Objetivo y campo de aplicación 2. Referencias 3. Definiciones 4. Símbolos y abreviaturas 5. Disposiciones generales 6. Vacunación universal 7. Prevención y control de las enfermedades diarreicas 8. Prevención y control de las infecciones respiratorias agudas 9. Control de la nutrición, crecimiento y desarrollo de los menores de cinco años 10. Cartilla Nacional de Vacunación 11. Registro de la información 12. Capacitación, participación comunitaria e información a la población 13. Bibliografía 14. Concordancia con normas internacionales y mexicanas 15. Observancia de la Norma 16. Vigencia LK19 Apéndices 0. Introducción
- 4. Para mejorar los actuales niveles de salud del niño, mediante la integración de los programas de prevención y control de las enfermedades que con mayor frecuencia pueden afectarlos, el Gobierno Federal, por conducto de la Secretaría de Salud y del Consejo Nacional de Vacunación, ha considerado normar los siguientes aspectos en relación con la salud del niño: atención integrada, vacunación universal; prevención y control de enfermedades diarreicas; prevención y control de infecciones respiratorias agudas, y control de la nutrición mediante la vigilancia del crecimiento y desarrollo de los niños menores de cinco años. La presente Norma Oficial Mexicana establece los criterios, estrategias, actividades y procedimientos aplicables al Sistema Nacional de Salud en todas las unidades que proporcionan atención a los niños residentes en la República Mexicana: aplicación de las vacunas para la prevención de enfermedades que actualmente se emplean en el esquema de Vacunación Universal; prevención, tratamiento y control de las enfermedades diarreicas y de las infecciones respiratorias agudas, así como las acciones para la vigilancia del estado de nutrición, crecimiento y desarrollo de los niños menores de cinco años y aquellas que son posibles de incorporar posteriormente. 1. Objetivo y campo de aplicación 1.1 Esta Norma Oficial Mexicana tiene por objeto establecer los requisitos que deben seguirse para asegurar la atención integrada, el control, eliminación y erradicación de las enfermedades evitables por vacunación; la prevención y el control de las enfermedades diarreicas, infecciones respiratorias agudas, vigilancia del estado de nutrición y crecimiento, y el desarrollo de los niños menores de 5 años. 1.2 Esta Norma Oficial Mexicana es de observancia obligatoria en todas las instituciones que prestan servicios de atención médica de los sectores público, social y privado del Sistema Nacional de Salud. 2. Referencias 2.1 NOM-016-SSA2-1994, Para la Vigilancia, Prevención, Control, Manejo y Tratamiento del Cólera. 2.2 NOM-006-SSA2-1993, Para la Prevención y Control de la Tuberculosis en la Atención Primaria a la Salud. 2.3 NOM-007-SSA2-1993, Para la Atención de la Mujer durante el Embarazo, Parto y Puerperio, y del Recién Nacido. 2.4 NOM-010-SSA2-1993, Para la Prevención y Control de la Infección por Virus de la Inmunodeficiencia Humana. 2.5 NOM-011-SSA2-1993, Para la Prevención y Control de la Rabia. 2.6 NOM-017-SSA2-1994, Para la Vigilancia Epidemiológica. 2.7 NOM-012-SSA1-1993, Requisitos sanitarios que deben cumplir los sistemas de abastecimiento de agua potable para uso y consumo humano, públicos y privados. 2.8 NOM-127-SSA1-1994, Salud ambiental, agua para uso y consumo humano. Límites permisibles de calidad y tratamientos a que debe someterse el agua para su potabilización. 2.9 NOM-168-SSA1-1998, Del expediente clínico.
- 5. 2.10 NOM-087-ECOL-1995, Que establece los requisitos para la separación, envasado, almacenamiento, transporte, tratamiento y disposición final de los residuos peligrosos biológico- infecciosos, que se generan en establecimientos que prestan atención médica. 2.11 NOM-008-SCF1-1994, Sistema General de Unidades de Medida. 3. Definiciones Para los efectos de esta Norma, se entiende por: 3.1 Ablactación, a la incorporación de alimentos diferentes a la leche. 3.2 Antibiótico, a la sustancia química que impide el desarrollo o multiplicación de ciertos microbios o los destruye. 3.3 Antropometría, a la medición de las dimensiones físicas del cuerpo humano. 3.4 Atención integrada, al conjunto de acciones que se proporcionan al menor de cinco años en la unidad de salud, independientemente del motivo de la consulta e incluyen: vigilancia de la vacunación, vigilancia de la nutrición, atención motivo de la consulta, capacitación de la madre y atención a la salud de la madre. 3.5 Brote, a la ocurrencia de dos o más casos asociados epidemiológicamente entre sí, a excepción de aquellas enfermedades que ya se encuentran erradicadas o eliminadas, en cuyo caso la presencia de un solo caso se considera brote. 3.6 Caso, al individuo de una población en particular que, en un tiempo definido, es sujeto de una enfermedad o evento bajo estudio o investigación. 3.7 Censo nominal, a la fuente primaria del Sistema de Información de los componentes de Vacunación Universal y Nutrición, donde se registran el nombre, edad, domicilio, esquema de vacunación, peso, talla y otras acciones, que realizan las instituciones del Sistema Nacional de Salud en beneficio de la población menor de ocho años, y de las embarazadas que residen en el área geográfica de su responsabilidad. 3.8 Cianosis, a la coloración azul de piel y mucosas. 3.9 Comunicación, a la acción de informar la presencia de padecimientos o eventos, por parte de fuentes que pertenecen al Sistema Nacional de Salud. 3.9.1 Comunicación educativa, al proceso basado en el desarrollo de esquemas novedosos y creativos de comunicación que se sustenta en técnicas de mercadotecnia social, que permiten la producción y difusión de mensajes gráficos y audiovisuales de alto impacto, con el fin de reforzar los conocimientos en salud y promover conductas saludables en la población. 3.10 Control, a la aplicación de medidas para la disminución de la incidencia, en casos de enfermedad. 3.11 Convulsión o ataque, a la contracción involuntaria, violenta o tenue de los músculos voluntarios que determina movimientos irregulares, localizados en uno o varios grupos musculares o generalizados a todo el cuerpo.
- 6. 3.12 Crecimiento, al proceso fisiológico por el cual se incrementa la masa celular de un ser vivo, mediante el aumento en el número de células (hiperplasia), en el volumen de las células (hipertrofia) y en la sustancia intercelular. 3.13 Choque hipovolémico, al colapso circulatorio por déficit de volumen intravascular. 3.14 Deposiciones, a las evacuaciones intestinales. 3.15 Desarrollo, a la diferenciación progresiva de órganos y sistemas. Se refiere a funciones, adaptaciones, habilidades y destrezas psicomotoras, relaciones afectivas y socialización. 3.16 Deshidratación, a la pérdida excesiva de líquidos y electrolitos del cuerpo. 3.17 Desinfección, a la aplicación de un agente, generalmente químico, que disminuye la carga microbiana y el crecimiento de microorganismos. 3.18 Desnutrición, al estado patológico inespecífico, sistémico y potencialmente reversible que se genera por el aporte insuficiente de nutrimentos, o por una alteración en su utilización por las células del organismo. Se acompaña de varias manifestaciones clínicas y reviste diversos grados de intensidad (leve, moderada y grave). Además se clasifica en aguda y crónica. 3.18.1 Desnutrición aguda, al trastorno de la nutrición que produce déficit del peso sin afectar la talla (peso bajo, talla normal). 3.18.2 Desnutrición crónica, al trastorno de la nutrición que se manifiesta por disminución del peso y la talla con relación a la edad. 3.18.3 Desnutrición leve, al trastorno de la nutrición que produce déficit de peso entre menos una y menos 1.99 desviaciones estándar, de acuerdo con el indicador de peso para la edad. 3.18.4 Desnutrición moderada, al trastorno de la nutrición que produce déficit de peso entre menos dos y menos 2.99 desviaciones estándar, de acuerdo con el indicador de peso para la edad. 3.18.5 Desnutrición grave, al trastorno de la nutrición que produce déficit de peso de tres o más desviaciones estándar, de acuerdo con el indicador de peso para la edad. 3.19 Diarrea, a la enfermedad intestinal, generalmente infecciosa y autolimitada, caracterizada por evacuaciones líquidas y frecuentes, en número de tres o más en 24 horas. 3.19.1 Diarrea aguda, a tres o más evacuaciones anormalmente blandas o líquidas en 24 horas, por menos de dos semanas. 3.19.2 Diarrea persistente, a tres o más evacuaciones anormalmente blandas o líquidas en 24 horas, por más de dos semanas. 3.20 Dificultad respiratoria, a la alteración en el funcionamiento pulmonar, que se manifiesta por uno o más de los siguientes signos: aumento de la frecuencia respiratoria (polipnea o taquipnea); tiraje; estridor en reposo; o sibilancia en diferentes intensidades. 3.21 Disentería, a las evacuaciones con moco y sangre. 3.22 Disfonía, a la alteración en el tono de la voz.
- 7. 3.23 Educación para la salud, al proceso de enseñanza-aprendizaje que permite mediante el intercambio y análisis de la información, desarrollar habilidades y cambiar actitudes, con el propósito de inducir comportamiento para cuidar la salud individual, familiar y colectiva. 3.24 Eliminación, a la ausencia de casos, aunque persista el agente causal. 3.25 Epidemiología, a la rama de la medicina que trata de la incidencia, distribución y control de las enfermedades, entre las poblaciones. 3.26 Erradicación, a la desaparición en un tiempo determinado, tanto de casos de enfermedad como del agente causal. 3.27 Esquema básico de vacunación, al esquema de vacunación orientado a la prevención de diez enfermedades: poliomielitis con tres dosis de la vacuna VOP tipo Sabin; formas graves de tuberculosis con una dosis de BCG; tétanos, difteria, tos ferina, infecciones graves por Haemophilus influenzae y Hepatitis B con tres dosis de la vacuna Pentavalente (DPT+HB+Hib), y sarampión, rubéola y parotiditis con dos dosis de triple viral (SRP). 3.28 Esquema completo de vacunación, al número ideal de vacunas, dosis y refuerzos que debe recibir la población sujeta al Programa, de acuerdo con su edad. 3.29 Estrategia, al método para resolver o controlar un problema. 3.30 Estridor, al ruido áspero, de predominio inspiratorio, que ocurre cuando se estrecha la laringe. 3.31 Eventos adversos temporalmente asociados a vacunación, a todas aquellas manifestaciones clínicas que se presentan dentro de los 30 días posteriores a la administración de una o más vacunas y que no son ocasionadas por alguna entidad nosológica específica (para la vacuna Sabin el periodo puede ser hasta de 75 días y para la vacuna BCG, de hasta seis meses). 3.31.1 Eventos adversos graves, a las manifestaciones clínicas que ponen en riesgo la vida del paciente, o cuyas secuelas afectan la capacidad funcional del individuo; o las defunciones. 3.31.2 Eventos adversos leves, a las manifestaciones clínicas locales –en el sitio de aplicación de las vacunas– y a las sistémicas que se tratan en forma ambulatoria y no dejan secuelas. 3.31.3 Eventos adversos moderados, a las manifestaciones clínicas que, aun cuando requieren hospitalización, no ponen en riesgo la vida del paciente, o las secuelas presentadas no afectan la capacidad funcional del individuo. 3.32 Factores de mal pronóstico, a las variables para identificar que un niño con enfermedad diarreica, infección respiratoria aguda o desnutrición, tiene mayor probabilidad de desarrollar complicaciones graves y, consecuentemente, de morir. Dichas variables son: menor de dos meses, desnutrición, muerte previa de un menor de cinco años en el mismo hogar, madre analfabeta o menor de 17 años de edad, dificultad para trasladarse a una unidad de salud y menor de un año con bajo peso al nacer. 3.33 Fiebre, a la elevación anormal de la temperatura corporal, por encima de los límites normales citados, arriba de 38.0ºC. 3.34 Fontanela, a la zona blanda que corresponde a cada uno de los espacios membranosos que existen en el cráneo humano antes de su completa osificación, en niños menores de 18 meses, también conocida como mollera.
- 8. 3.36 Gasto fecal elevado, a más de tres evacuaciones por hora, o más de 10 gramos de heces por kilogramo de peso, por hora. 3.37 Gastroclisis, a la aplicación de una sonda nasogástrica para introducir alimentos líquidos y medicamentos al estómago. 3.38 Grupo de edad, al conjunto de individuos que se caracteriza por pertenecer al mismo rango de edad. Se establecen por diversos estándares estadísticos y su clasificación permite señalar características especiales para el mismo. También se le llama grupo etáreo. 3.39 Grupo de población cautiva, al conjunto de individuos que se encuentran bajo custodia temporal, en instituciones cuyo servicio es de cuidado, capacitación y control, o que comparten de manera tanto temporal como permanente, un área geográfica específica. 3.40 Hipertermia, al estado de elevación anormal de la temperatura del cuerpo por arriba de 40°C, sin intervención del hipotálamo o participación de mecanismos termorreguladores, ejemplo, insolación, golpe de calor. 3.41 Hipotermia, a la disminución de la temperatura corporal, por debajo de 36ºC. 3.42 Inconsciencia, al estado en el que una persona ha perdido el conocimiento y no responde a estímulos externos. 3.43 Infección aguda de las vías respiratorias, a la enfermedad infecciosa, causada por microorganismos, que afecta al aparato respiratorio durante un periodo menor de 15 días. 3.43.1 Infección aguda de las vías respiratorias inferiores, a la enfermedad infecciosa, que afecta al aparato respiratorio, de las cuerdas vocales hacia abajo, durante un periodo menor de 15 días. 3.43.2 Infección aguda de las vías respiratorias superiores, a la enfermedad infecciosa, que afecta al aparato respiratorio por arriba de las cuerdas vocales, durante un periodo menor de 15 días. 3.44 Inmunización activa, a la protección de un individuo susceptible a una enfermedad transmisible, mediante la administración de una vacuna. 3.45 Insumos para la vacunación, a los recursos materiales desechables, que se utilizan para la aplicación de los biológicos: vacunas, torundas, alcohol, jeringas y agujas. 3.46 Inactivación de las vacunas, al proceso mediante el cual se suprime la acción o el efecto de las vacunas, generalmente a través del uso de calor o alguna solución desinfectante, al término de su vida útil o de su caducidad. 3.47 Lactancia materna exclusiva, a la alimentación de los niños con leche materna, como único alimento, durante los primeros cuatro meses de vida. 3.48 Lactante, al niño menor a dos años de edad. 3.49 Líquidos caseros recomendados, a las aguas preparadas de frutas, sopas, tés, atoles, y agua de coco verde. 3.50 Longitud; estatura; talla, medidas del eje mayor del cuerpo. La longitud se refiere a la talla obtenida con el paciente en decúbito; en tanto que la estatura se refiere a la talla con el
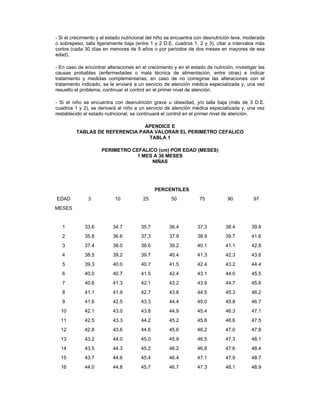
- 9. paciente de pie. Para los fines de esta Norma, se utilizará talla como sinónimo de longitud y estatura. 3.51 Macronutrimento, a los sustratos energéticos de la dieta, incluye a los hidratos de carbono, proteínas y grasas. 3.52 Mecha, a la punta larga de tela de algodón absorbente, o gasa limpia, enrollada, para utilizarla en la limpieza de los orificios nasales y conductos auditivos externos. 3.53 Micronutrimento, a las vitaminas y nutrimentos inorgánicos (minerales) que participan en diversas funciones orgánicas, actuando como enzimas y coenzimas de reacciones metabólicas. 3.54 Mortalidad, tasa de, a la que tiene como numerador el total de defunciones producidas en una población en un periodo de tiempo determinado, y el denominador representa la población donde ocurrieron las muertes. Se expresa como una tasa, puede ser general o específica. 3.55 Nutrición humana, al aporte y aprovechamiento de nutrimentos, que se manifiesta por crecimiento y desarrollo. 3.56 Orientación alimentaria, al conjunto de acciones que proporcionan información básica, científicamente validada y sistematizada, sobre las características de los alimentos y la alimentación; para favorecer una alimentación correcta a nivel individual, familiar o colectivo, tomando en cuenta sus condiciones físicas, económicas y sociales; la adquisición, conservación, manejo, preparación y consumo, así como la disponibilidad y acceso de los alimentos. 3.57 Otalgia, al dolor de oído. 3.58 Otitis media aguda, a la inflamación del oído medio que incluye la cavidad del oído medio, la trompa de Eustaquio limitando la movilidad de la membrana timpánica. Su presentación puede ser muy diversa con sintomatología inespecífica, incluyendo otalgia, fiebre, sensación de oído ocupado, hipoacusia y otorrea. 3.59 Otorrea, a la supuración en el oído, salida de líquido, o pus, por el conducto auditivo externo. 3.60 Otoscopia, al examen visual del canal auditivo y de la membrana timpánica por medio de un otoscopio. Para establecer el diagnóstico de otitis media aguda se requiere un otoscopio neumático para evaluar anatomía y función de la membrana timpánica. 3.61 Palidez, al tono blanquecino de piel y mucosas. 3.62 Peso, a la medida de la masa corporal. 3.62.1 Peso para la edad, al índice resultante de comparar el peso de un niño, con el peso ideal que debiera presentar para su edad. El ideal corresponde a la mediana de una población de referencia. 3.62.2 Peso para la talla, al índice resultante de comparar el peso de un niño, con la talla que presenta, como método ideal para evaluar el estado nutricional en mayores de un año. 3.63 Perímetro cefálico, a la medida de la circunferencia craneana.
- 10. 3.64 Polipnea o respiración rápida, al aumento de la frecuencia respiratoria arriba de 60 por minuto, en niños menores de 2 meses de edad; arriba de 50 por minuto, en niños de 2 a 11 meses, y arriba de 40 por minuto, en niños de uno a cuatro años. 3.65 Preescolar, al niño de dos a cuatro años. 3.66 Promoción de la salud, al proceso que permite fortalecer los conocimientos, aptitudes y actitudes de las personas para participar corresponsablemente en el cuidado de su salud y para optar por estilos de vida saludables, facilitando el logro y conservación de un adecuado estado de salud individual, familiar y colectivo mediante actividades de participación social, comunicación educativa y educación para la salud. 3.67 Recién nacido, a todo niño menor de 30 días de vida. 3.68 Red o cadena de frío, al sistema logístico que comprende al personal, al equipo y a los procedimientos para almacenar, transportar y mantener las vacunas a temperaturas adecuadas, desde el lugar de su fabricación hasta el momento de aplicarlas a la población. 3.69 Sibilancia, a los ruidos respiratorios silbantes, de predominio espiratorio. 3.70 Sistema Nacional de Salud, al conjunto constituido por las dependencias e instituciones de la Administración Pública, tanto federal como local, y por las personas físicas o morales de los sectores social y privado que prestan servicios de salud, así como por los mecanismos establecidos para la coordinación de acciones. 3.71 Somatometría, a la medición de las dimensiones físicas del cuerpo humano. 3.72 Somnolencia, a la dificultad para mantener la vigilia. 3.73 Sucedáneo, a la sustancia que por tener propiedades parecidas a otra, puede reemplazarla. 3.74 Susceptible, al individuo que tiene el riesgo de contraer alguna enfermedad evitable por vacunación, porque, de acuerdo con su edad cronológica u ocupación, no ha completado su esquema de vacunación y no ha enfermado de dichos padecimientos. 3.75 Talla para la edad, al índice resultante de comparar la talla de un niño con la talla ideal que debiera presentar para su edad. La talla ideal corresponde a la media de una población de referencia. 3.76 Terapia de hidratación oral, a la administración, por la boca, de líquidos seguros y vida suero oral, para prevenir o tratar la deshidratación. 3.77 Tiro o tiraje, al hundimiento del hueco supraesternal, de los espacios intercostales y del hueco epigástrico, durante la inspiración, como consecuencia de la obstrucción de las vías respiratorias, que, en su expresión de mayor gravedad, se manifiesta como disociación torácico-abdominal. 3.78 Vacunación, a la administración de un producto inmunizante a un organismo, con objeto de protegerlo contra el riesgo de una enfermedad determinada. 3.78.1 Vacunación universal, a la política sanitaria que tiene como objetivo lograr la protección de toda la población del país, mediante su esquema completo de vacunación. Establece los criterios y procedimientos para lograr el control, la eliminación y la erradicación de enfermedades evitables por vacunación. 3.79 Vial, al recipiente en forma de gotero dosificador.
- 11. 3.80 Vida útil de las vacunas, al periodo de vigencia de las vacunas determinado por el laboratorio productor. En los frascos abiertos sólo el tiempo normado, independientemente de su fecha de caducidad. 4. Símbolos y abreviaturas ºC grado Celsius. µ g microgramo. BCG Bacilo de Calmette y Guerin (Vacuna contra la tuberculosis). c.b.p. cantidad bastante para. cm centímetro. CONAVA Consejo Nacional de Vacunación. CURP Clave Unica del Registro de Población. D.E. desviación estándar. DICC50 Dosis infectante en cultivo celular 50. DPT vacuna triple, contra difteria, tos ferina y tétanos. DPT+HB+Hib Vacuna pentavalente, contra difteria, tos ferina, tétanos, hepatitis B e infecciones invasivas por Haemophilus influenzae tipo b. DT vacuna doble, contra difteria y tétanos, para uso en menores de cinco años. g gramo HbsAg Antígeno de superficie de Hepatitis B. IRA Infección respiratoria aguda. IV Intravenosa. kg kilogramo. Lf unidades de floculación. log10 logaritmo en base diez. máx. máximo. ml mililitro. mg miligramo. OMS Organización Mundial de la Salud. OPS Organización Panamericana de la Salud.
- 12. PFA Parálisis flácida aguda. PROVAC sistema de información computarizado, diseñado para control de las acciones de vacunación universal y vigilancia del crecimiento y desarrollo de los niños; permite la evaluación continua de sus avances y logros. PVRV vacuna producida sobre células VERO. SSA Secretaría de Salud. SIDA Síndrome de Inmunodeficiencia Adquirida. SRP vacuna triple viral, contra sarampión, rubéola y parotiditis. Td vacuna doble, contra el tétanos y la difteria. TMP/SMZ Trimetoprim con sulfametoxazol. U.E. unidades ELISA. UFC unidades formadoras de colonias. U.l. unidades internacionales. UNICEF Fondo de las Naciones Unidas para la Infancia. U.O. unidades de opacidad. VHB Virus de hepatitis B. VIH Virus de la Inmunodeficiencia Humana. VSO Vida Suero Oral. VOP Vacuna oral de poliovirus atenuados. 5. Disposiciones generales 5.1 La atención integrada al menor de cinco años en la unidad de salud debe considerar los siguientes aspectos: Vigilancia de la vacunación, atención del motivo de la consulta, vigilancia de la nutrición y capacitación de la madre. 5.2 La estrategia para asegurar la atención integrada la constituye la consulta completa que incluye: identificación de factores de mal pronóstico, evaluación clínica y clasificación, tratamiento adecuado, capacitación a la madre sobre la identificación de los signos de alarma, cuidados generales en el hogar y seguimiento de los casos. 5.3 Las vacunas que deberán ser aplicadas rutinariamente en el país, son: 5.4 Esquema de Vacunación Universal: BCG, antituberculosa; VOP tipo Sabin, antipoliomielítica; DPT+HB+Hib, contra difteria, tos ferina, tétanos, hepatitis B e infecciones invasivas por Haemophilus influenzae tipo b; SRP, contra sarampión, rubéola y parotiditis; DPT, contra la difteria, tos ferina y tétanos; y toxoide tetánico-diftérico (Td adulto y DT infantil).
- 13. 5.5 Todas las vacunas que se apliquen en el territorio nacional, de origen mexicano o extranjero, cumplirán con las especificaciones de calidad señaladas en cada caso por la Farmacopea de los Estados Unidos Mexicanos, vigente. 5.6 El Esquema Básico de Vacunación Universal debe completarse en los lactantes a los doce meses de edad. Cuando esto no sea posible, se ampliará el periodo de vacunación, hasta los cuatro años con once meses de edad. 5.7 La aplicación de los productos biológicos se realizará durante todos los días hábiles del año, por personal capacitado, en todas las unidades del primer nivel de atención; en hospitales del segundo nivel, se cubrirá la demanda durante los 365 días del año. Las unidades hospitalarias de tercer nivel, que cuenten con servicios de medicina preventiva, apoyarán las acciones de vacunación; la vacunación extramuros se realizará con la periodicidad que cada institución establezca para completar esquemas y en las Semanas Nacionales de Salud, tres veces al año. 5.8 Los insumos utilizados en la aplicación de vacunas, serán eliminados de conformidad con los instructivos y manuales de procedimientos específicos, a fin de evitar que éstos contaminen el ambiente. 5.9 En los grupos de población cautiva se deberán llevar a cabo acciones preventivas para la atención a la salud del niño conforme a lo establecido en esta norma en: 5.9.1 Estancias infantiles, casas cuna, orfanatos, guarderías y jardines de niños; 5.9.2 Escuelas, albergues, internados, consejos tutelares, reclusorios y casas hogar; 5.9.3 Fábricas, empresas e instituciones públicas; 5.9.4 Campos de refugiados, jornaleros y grupos de emigrados, y 5.9.5 Hospitales y centros de atención para enfermos psiquiátricos. 6. Vacunación universal 6.1. Vacunas del Esquema de Vacunación Universal 6.1.1 BCG, contra la tuberculosis 6.1.1.1 La vacuna BCG se utiliza en la prevención de las formas graves de tuberculosis, principalmente la tuberculosis meníngea. Produce inmunidad relativa y disminuye la incidencia de las formas graves de la enfermedad. Se elabora con bacilos (Mycobacterium bovis) vivos atenuados (bacilo de Calmette y Guerin). Cada dosis de 0.1 ml contiene, como mínimo, 200,000 UFC. 6.1.1.2 Indicaciones: Para la inmunización activa contra las formas graves de tuberculosis (miliar y meníngea). 6.1.1.3 Administración: intradérmica, en la región deltoidea del brazo derecho; en los casos de revacunación, la segunda dosis se aplicará en el mismo brazo, a un lado de la cicatriz anterior. Sin prueba tuberculínica previa y sola o simultáneamente con otras vacunas. 6.1.1.4 Grupos de edad: todos los niños recién nacidos y hasta los 14 años de edad; posteriormente a los 14 años, cuando se considere necesario. Todo niño vacunado al nacer, o antes de cumplir un año de edad, puede ser revacunado al ingresar a la escuela primaria (en circunstancias de riesgo epidemiológico).
- 14. 6.1.1.5 Dosis: 0.1 ml. 6.1.1.6 Contraindicaciones: No debe aplicarse a niños con peso inferior a 2 kg, o con lesiones cutáneas en el sitio de aplicación, a personas inmunodeprimidas por enfermedad o por tratamiento, excepto infección por VIH en estado asintomático; tampoco se aplicará en caso de padecimientos febriles (más de 38.5ºC). Las personas que hayan recibido transfusiones, o inmunoglobulina, esperarán cuando menos tres meses para ser vacunadas. 6.1.2 VOP tipo Sabin, contra la poliomielitis 6.1.2.1 La vacuna que se utiliza en México para prevenir la poliomielitis, es la oral de poliovirus atenuados tipo Sabin, conocida también como VOP. Cada dosis contiene al menos 1,000,000 DICC50 de poliovirus atenuados tipo I; 100,000 del tipo II y 600,000 del tipo III. 6.1.2.2 Indicaciones: Para la inmunización activa contra poliomielitis. 6.1.2.3 Administración: oral. 6.1.2.4 Grupo de edad: todos los niños menores de cinco años; y personas mayores de esta edad, en caso de riesgo epidemiológico. 6.1.2.5 Esquema: al menos tres dosis, aplicándose la primera a los dos meses de edad, la segunda a los cuatro y la tercera a los seis. Como dosis preliminar, se aplicará al recién nacido, indicándose dosis adicionales a los niños menores de cinco años, de conformidad con los Programas Nacionales de Salud. 6.1.2.6 Dosis: es de 0.1 ml: dos gotas, del vial de plástico depresible con gotero integrado. 6.1.2.7 Contraindicaciones: Inmunodeficiencias; en caso de infección por VIH, no está contraindicada por la OMS, pero se recomienda la aplicación de vacuna Salk, si se cuenta con ella. Padecimientos febriles agudos (fiebre superior a 38.5ºC), enfermedades graves o pacientes que estén recibiendo tratamiento con corticosteroides u otros medicamentos inmunosupresores o citotóxicos. 6.1.3 Pentavalente (DPT+HB+Hib), contra la difteria, tos ferina, tétanos, hepatitis B e infecciones invasivas por H. influenzae tipo b. 6.1.3.1 La vacuna que se utiliza para prevenir difteria, tos ferina, tétanos, hepatitis B e infecciones invasivas por H. influenzae tipo b, es la DPT+HB+Hib. Cada dosis de 0.5 ml contendrá no más de 30 Lf de toxoide diftérico; no más de 25 Lf de toxoide tetánico y un máximo de 10 – 15 x 109 células muertas de Bordetella pertussis adsorbidas en gel de sales de aluminio. Asimismo cada dosis deberá contener no menos de 10 &#ΣΨΜΒΟΛ; g de polisacárido capsular tipo b de H. Influenzae. 6.1.3.2 Indicaciones: Para la inmunización activa contra difteria, tos ferina, tétanos, hepatitis B e infecciones invasivas por H. influenzae b. 6.1.3.3 Administración: intramuscular profunda, en la cara anterolateral externa del muslo en los menores de un año, si es mayor de un año de edad, en la región deltoidea o en el cuadrante superior externo del glúteo. 6.1.3.4 Grupo de edad: niños menores de dos años. 6.1.3.5 Esquema: tres dosis; la primera, a los dos meses de edad, la segunda a los cuatro y la tercera a los seis.
- 15. 6.1.3.6 Dosis: 0.5 ml. 6.1.3.7 Contraindicaciones: Inmunodeficiencias, a excepción de la infección por VIH/SIDA, padecimientos agudos febriles (superiores a 38.5ºC), enfermedades graves con o sin fiebre, o aquellas que involucren daño cerebral, cuadros convulsivos o alteraciones neurológicas sin tratamiento o en progresión (el daño cerebral previo no la contraindica). Tampoco se administrará a niños con historia personal de convulsiones u otros eventos adversos graves (encefalopatía) temporalmente asociados a dosis previas de la vacuna. Las personas transfundidas o que han recibido inmunoglobulina, esperarán tres meses para ser vacunadas. 6.1.4 Triple Viral (SRP), contra sarampión, rubéola y parotiditis 6.1.4.1 Las vacunas que se utilizan para prevenir el sarampión, rubéola y parotiditis, son las siguientes: 6.1.4.1.1 Virus atenuados de sarampión, de las cepas Edmonston-Zagreb (cultivado en células diploides humanas), Enders y Schwarz (cultivados en fibroblastos de embrión de pollo). La dosis de 0.5 ml debe contener no menos de 3.0 log10 DICC50 y no más 4.5 log10 DICC50 . 6.1.4.1.2 Virus atenuados de rubéola cepa Wistar RA 27/3 cultivado en células diploides humanas, en células diploides humanas MRC-5 o WI-38. La dosis de 0.5 ml debe contener no menos de 3.0 log10 DICC50. 6.1.4.1.3 Virus atenuados de la parotiditis cultivados en huevo embrionario de gallina o en células diploides, de las cepas Rubini, Leningrad-Zagreb, Jeryl Lynn, Urabe AM-9, RIT 4385. Cada dosis debe contener no menos de 3.7 log10 DICC50, a excepción de la cepa Jeryl Lynn que debe contener no menos de 4.3 log10 DICC50. 6.1.4.2 Indicaciones: Para la inmunización activa contra sarampión, rubéola y parotiditis. 6.1.4.3 Administración: subcutánea, en la región deltoidea del brazo izquierdo; 6.1.4.4 Grupo de edad: aplicación a todos los niños entre uno y seis años, o personas mayores de esta edad en circunstancias de riesgo epidemiológico; 6.1.4.5 Esquema: dos dosis de vacuna; la primera a partir de los doce meses de edad; cuando esto no sea posible, el periodo se ampliará hasta los cuatro años y, la segunda, al cumplir los seis años o ingresar a la escuela primaria; 6.1.4.6 Dosis: 0.5 ml de vacuna reconstituida. 6.1.4.7 Contraindicaciones: Inmunodeficiencias que incluye a pacientes con enfermedades hematooncológicas en quimio o radioterapia, a excepción de la infección por VIH/SIDA, padecimientos agudos febriles (temperatura superior a 38.5ºC), enfermedades graves o neurológicas, como hidrocefalia, tumores del sistema nervioso central o cuadros convulsivos sin tratamiento. Tampoco debe aplicarse a personas que padezcan leucemia (excepto si están en remisión y no han recibido quimioterapia en los últimos tres meses), que reciban tratamiento con corticosteroides por tiempo prolongado u otros medicamentos inmunosupresores o citotóxicos. En el caso de la vacuna Schwarz, no se aplicará a personas con antecedentes de reacción anafiláctica a las proteínas del huevo (si la alergia es de otro tipo, sí pueden ser vacunadas). Las personas transfundidas o que han recibido inmunoglobulina, deben esperar tres meses para ser vacunadas. 6.1.5 DPT, contra difteria, tos ferina y tétanos 6.1.5.1 La vacuna que se utiliza para prevenir difteria, tos ferina y tétanos, es la DPT. Cada dosis de 0.5 ml, contendrá no más de 30 Lf de toxoide diftérico; no más de 25 Lf de toxoide
- 16. tetánico y un máximo de 10 – 15 UO correspondientes a 10 – 15 x 109 células muertas de Bordetella pertussis adsorbidas en gel de sales de aluminio. 6.1.5.2 Indicaciones: Para la inmunización activa de refuerzo contra difteria, tos ferina y tétanos. 6.1.5.3 Administración: intramuscular profunda, en la región deltoidea o en el cuadrante superior externo del glúteo. 6.1.5.4 Grupo de edad: niños de dos a cuatro años. 6.1.5.5 Esquema: Se aplican dos refuerzos: el primero, a los dos años de edad, y el segundo a los cuatro. 6.1.5.6 Dosis: 0.5 ml. 6.1.5.7 Contraindicaciones: Inmunodeficiencias, a excepción de la infección por VIH/SIDA, padecimientos agudos febriles (superiores a 38.5ºC), enfermedades graves con o sin fiebre, o aquellas que involucren daño cerebral, cuadros convulsivos o alteraciones neurológicas sin tratamiento o en progresión (el daño cerebral previo no la contraindica). Tampoco se administrará a niños con historia personal de convulsiones u otros eventos clínicos graves (encefalopatía) temporalmente asociados a dosis previas de la vacuna. Las personas transfundidas, o que han recibido inmunoglobulina, esperarán tres meses para ser vacunadas. 6.1.6 DT; Td, contra difteria y tétanos 6.1.6.1 Vacuna DT: Se utiliza para prevenir difteria y tétanos. Cada dosis de 0.5 ml contendrá no más de 30 Lf de toxoide diftérico; no más de 25 Lf de toxoide tetánico adsorbidas en gel de sales de aluminio. 6.1.6.1.1 Indicaciones: Para la inmunización activa contra difteria y tétanos. Se utiliza en menores de cinco años, que presentan contraindicaciones a la fracción pertusis, de la vacuna DPT+HB+Hib o DPT. El esquema es el mismo que el de la DPT+HB+Hib. Si los niños han recibido una o más dosis de DPT+HB+Hib o DPT y presentan contraindicaciones a la fracción pertusis que impidan continuar su aplicación, se administrarán las dosis de DT hasta completar el esquema establecido. 6.1.6.1.2 Administración: intramuscular profunda, en la cara anterolateral externa del muslo en los menores de un año, si es mayor de un año de edad, en la región deltoidea o en el cuadrante superior externo del glúteo. 6.1.6.1.3 Grupo de edad: niños menores de cinco años. 6.1.6.1.4 Dosis: 0.5 ml. 6.1.6.1.5 Contraindicaciones: Inmunodeficiencias, a excepción de la infección por VIH/SIDA, padecimientos agudos febriles (superiores a 38.5ºC), y enfermedades graves. No administrar en personas con antecedentes de hipersensibilidad secundaria a la aplicación de una dosis previa. Las personas transfundidas o que han recibido inmunoglobulina, deberán esperar tres meses para ser vacunadas. 6.1.6.2 Vacuna Td: Se utiliza para prevenir difteria y tétanos. Cada dosis de 0.5 ml contiene 3-5 Lf de toxoide diftérico; y no más de 20 Lf de toxoide tetánico adsorbida en gel de sales de aluminio.
- 17. 6.1.6.2.1 Indicaciones: Para la inmunización activa contra difteria y tétanos. Se utiliza en mayores de siete años de edad. Las personas que completaron su esquema con DPT+HB+Hib o DPT recibirán una dosis cada cinco a diez años. Las no vacunadas, o con esquema incompleto de DPT+HB+Hib o DPT, recibirán al menos dos dosis, con intervalo de cuatro a ocho semanas entre cada una y revacunación cada cinco a diez años. En las mujeres embarazadas, la vacuna se puede aplicar en cualquier edad gestacional, de preferencia en el primer contacto con los servicios de salud; aplicar al menos dos dosis, con intervalo de cuatro a ocho semanas entre cada una, posteriormente una dosis de refuerzo con cada embarazo hasta completar cinco dosis (esquema recomendado por la OMS) y revacunación cada cinco a diez años. 6.1.6.2.2 Administración: intramuscular profunda, en la cara anterolateral externa del muslo, en la región deltoidea o en el cuadrante superior externo del glúteo. 6.1.6.2.3 Grupo de edad: niños mayores de siete años. 6.1.6.2.4 Dosis: 0.5 ml. 6.1.6.2.5 Contraindicaciones: Inmunodeficiencias, a excepción de la infección por VIH/SIDA; padecimientos agudos febriles (superiores a 38.5ºC), y enfermedades graves. Cuando exista historia de reacción grave de hipersensibilidad o eventos neurológicos relacionados con la aplicación de una dosis previa. Las personas transfundidas o que han recibido inmunoglobulina, deberán esperar tres meses para ser vacunadas. 6.1.7 Vacuna contra el sarampión 6.1.7.1 La utilizada para prevenir el sarampión, es de virus atenuados de las cepas Edmonston- Zagreb o Schwarz y se presenta sola, combinada con rubéola (vacuna doble viral) o rubéola y parotiditis (vacuna triple viral). Cada dosis de 0.5 ml contiene, al menos, 3 log10 y hasta 4.5 log10 DICC50 de virus atenuado de sarampión. 6.1.7.2 Indicaciones: Para la inmunización activa contra el sarampión. 6.1.7.3 Administración: subcutánea en la región deltoidea del brazo izquierdo. 6.1.7.4 Grupo de edad: se recomienda vacunar a todos los menores de cinco años, a partir de los nueve meses, y a escolares bajo condiciones particulares de riesgo de epidemias (acumulación de susceptibles equivalente a una cohorte de nacimientos), o durante epidemias; asimismo, personas en riesgo epidemiológico y seropositivos al VIH que aún no desarrollan el cuadro clínico del SIDA. 6.1.7.5 Dosis: una sola, con 0.5 ml de vacuna reconstituida. 6.1.7.6 Contraindicaciones: Inmunodeficiencias, a excepción de la infección por VIH que no presenten inmunodeficiencia grave, padecimientos agudos febriles (superiores a 38.5ºC), enfermedades graves o neurológicas como hidrocefalia, tumores del sistema nervioso central o cuadros convulsivos sin tratamiento, historia de anafilaxia con la neomicina. Tampoco debe aplicarse a personas que padezcan leucemia (excepto si está en remisión y los pacientes no han recibido quimioterapia los últimos tres meses), linfoma, neoplasias, o personas que estén recibiendo tratamiento con corticosteroides u otros medicamentos inmunosupresores o citotóxicos. En el caso de la vacuna Schwarz, no debe aplicarse a personas con antecedente de reacción anafiláctica a las proteínas del huevo (si la alergia es de otro tipo, sí pueden ser vacunadas). Las personas transfundidas o que han recibido gammaglobulina, deben esperar tres meses para ser vacunadas. 6.1.8 Vacuna contra la rubéola
- 18. 6.1.8.1 La utilizada es de virus atenuados, provenientes generalmente de las cepas Wistar RA 27/3, o de la Cendehill; se presenta sola, combinada con el componente sarampión (vacuna doble viral) o sarampión y parotiditis (vacuna triple viral). Cada dosis de 0.5 ml contiene, al menos, 3 log10 DICC50 de virus atenuados de rubéola. 6.1.8.2 Indicaciones: Para la inmunización activa contra la rubéola. 6.1.8.3 Administración: subcutánea en la región deltoidea del brazo izquierdo. 6.1.8.4 Grupo de edad: menores de cinco años, a partir de los doce meses, escolares, mujeres en edad fértil no embarazadas y mujeres en postparto inmediato; adultos en riesgo epidemiológico: trabajadores de la salud y estudiantes de enfermería y medicina. Se recomienda vacunar a las maestras de instrucción primaria en edad fértil, y a las estudiantes del magisterio (mujeres); seropositivos al VIH que aún no desarrollan cuadro clínico de SIDA. 6.1.8.5 Dosis: 0.5 ml de vacuna reconstituida. 6.1.8.6 Esquema: dosis única, cuando se administre a niñas menores de cinco años, se recomienda aplicar una segunda dosis, entre los seis y los catorce años de edad, para la prevención del síndrome de la rubéola congénita. Debe recomendarse a las mujeres en edad fértil que reciban la vacuna, evitar el embarazo durante los tres meses siguientes a la vacunación. 6.1.8.7 Contraindicaciones: Mujeres embarazadas; personas con hipertermia mayor a 38ºC; quienes padezcan enfermedades graves, inmunodeficiencias congénitas o con infección por VIH con inmunodeficiencia grave, o que estén recibiendo tratamiento con corticosteroides u otros medicamentos inmunosupresores o citotóxicos. No debe aplicarse a personas con antecedente de reacción anafiláctica a la neomicina. Las personas transfundidas o que han recibido gamma globulina, deben esperar tres meses para ser vacunadas. 6.1.9 Vacuna contra la parotiditis 6.1.9.1 La utilizada es de virus atenuados y se presenta sola o combinada con los componentes sarampión y rubéola (vacuna triple viral). Cada dosis de 0.5 ml contiene, al menos, 3.7 log1O DICC50 de virus atenuados de parotiditis. 6.1.9.2 Indicaciones: Para la inmunización activa contra la parotiditis. 6.1.9.3 Administración: subcutánea en la región deltoidea del brazo izquierdo. 6.1.9.4 Grupo de edad: se recomienda vacunar a los menores de cinco años, a partir de los doce meses, y a escolares. Sólo bajo condiciones particulares de epidemias, se puede aplicar a una edad más temprana; en este caso, debe haber una dosis de refuerzo a los doce meses, ya que los anticuerpos maternos pueden interferir con la eficacia de la vacuna; además, personas en riesgo epidemiológico y seropositivos al VIH que aún no desarrollan el cuadro clínico de SIDA. 6.1.9.5 Dosis: una sola, de 0.5 ml de vacuna reconstituida. 6.1.9.6 Contraindicaciones: Mujeres embarazadas; cuando, por consideraciones de riesgo epidemiológico, se vacuna a las que se encuentran en edad fértil, debe recomendárseles evitar el embarazo durante los tres meses siguientes a la vacunación. Personas con fiebre mayor de 38.5 grados centígrados, o que padezcan leucemia (excepto si está en remisión y los pacientes no han recibido quimioterapia los últimos tres meses), linfoma, neoplasias, o inmunodeficiencia (a excepción de la infección por VIH asintomática), o personas que estén recibiendo tratamiento con corticosteroides u otros medicamentos inmunosupresores o citotóxicos; tampoco debe aplicarse a aquellas con antecedente de reacción anafiláctica a las proteínas del
- 19. huevo o a la neomicina (si la alergia es de otro tipo, sí se puede vacunar). Las personas transfundidas o que han recibido gammaglobulina, deben esperar tres meses para ser vacunadas. 6.1.10 Vacuna contra Haemophilus influenzae tipo b 6.1.10.1 Las vacunas que se utilizan para prevenir las infecciones invasivas por Haemophilus influenzae del tipo b (meningoencefalitis, neumonía, epiglotitis, etc.), están elaboradas con polisacáridos del tipo b de la bacteria, unidos a diferentes proteínas acarreadoras, algunas de las cuales son proteínas de membrana externa de Neisseria meningitidis, toxoide diftérico y toxoide tetánico. Las vacunas inducen inmunidad solamente contra el polisacárido b de Haemophilus influenzae, y no contra los acarreadores. Cada 0.5 ml contiene desde 7.5 hasta 25 mg de polisacárido capsular b, del agente. 6.1.10.2 Indicaciones: Para la inmunización activa contra infecciones invasivas por Haemophilus influenzae tipo b. 6.1.10.3 Administración: intramuscular profunda, en la cara anterolateral externa del muslo en los menores de un año, si es mayor de un año de edad, en la región deltoidea o en el cuadrante superior externo del glúteo. 6.1.10.4 Grupo de edad: menores de dos años y personas cuyas condiciones de salud predisponen al desarrollo de infecciones por bacterias encapsuladas (disfunción esplénica, esplenectomía, enfermedad de Hodgkin, anemia de células falciformes, neoplasias del sistema hematopoyético o inmunodeficiencias). 6.1.10.5 Dosis: en los menores de 12 meses de edad, se requieren tres dosis de 0.5 ml, con un intervalo entre cada una de dos meses, aplicándose idealmente la primera a los dos meses, la segunda a los cuatro y la tercera a los seis. 6.1.10.6 Esquema de vacunación: Cuando se inicia el esquema de vacunación entre los 12 y 14 meses, sólo se requieren dos dosis (cada una de 0.5 ml), con intervalo entre las mismas de sesenta días, si la vacunación se inicia a partir de los 15 meses de edad, sólo se necesita una dosis (0.5 ml). La dosis es única, para personas en riesgo epidemiológico. 6.1.10.7 Contraindicaciones: Fiebre mayor de 38.5ºC, o antecedentes de hipersensibilidad a alguno de los componentes de la vacuna. 6.1.11 Vacuna antihepatitis B (recombinante) 6.1.11.1 Preparación purificada del antígeno de superficie del virus de la hepatitis (HBsAg), producida con técnica de ácido desoxirribonucleico recombinante en células procarióticas o eucarióticas. 6.1.11.2 Indicaciones: Para la inmunización activa contra la infección por virus de la hepatitis B. 6.1.11.3 Administración: intramuscular profunda, en la cara anterolateral externa del muslo en los menores de un año, si es mayor de un año de edad, en la región deltoidea o en el cuadrante superior externo del glúteo. 6.1.11.4 Grupo de edad: población en riesgo; trabajadores de la salud en contacto directo con sangre, hemoderivados y líquidos corporales; pacientes hemodializados y receptores de factores VIII o IX; hijos de madres seropositivas al VHB; hombres y mujeres con múltiples parejas sexuales; convivientes con personas seropositivas al VHB; grupos de población cautiva; y trabajadores de los servicios de seguridad pública.
- 20. 6.1.11.5 Esquema de vacunación: tres dosis, aplicándose la primera y la segunda con un mes de intervalo y la tercera a los seis meses. Se recomienda aplicar un refuerzo, a los cinco años de terminado el esquema. 6.1.11.6 Dosis: 2 meses a 10 años, 0.5 ml (10 µ g); población mayor de 10 años, 1.0 ml (20 µ g). En recién nacidos iniciar el esquema sólo cuando se trata de hijos de madres portadoras del virus de la hepatitis B. 6.1.11.7 Contraindicaciones: Estados febriles, infecciones severas y alergia a los componentes de la vacuna incluyendo el timerosal. 6.2 Manejo y conservación de las vacunas 6.2.1 Las instituciones y servicios de salud de los sectores público, social y privado en el país, deberán vigilar el funcionamiento adecuado de la red o cadena de frío en todas sus unidades de salud y áreas administrativas o de distribución, disponiendo para ello de equipo y personal capacitado en los procedimientos de almacenamiento, conservación, distribución, control y transporte de las vacunas. (Cadena de Frío, Manual de Procedimientos Técnicos. Consejo Nacional de Vacunación). 6.2.2 El transporte de las vacunas se realizará del nivel nacional a los niveles estatal, delegacional, regional y local, empleando medios refrigerantes que mantengan la temperatura entre 2ºC y 8ºC, de acuerdo con las indicaciones del laboratorio productor, respecto a su temperatura y fecha de caducidad. 6.2.3 Los elementos que integran la cadena de frío sujetos a vigilancia estrecha, son: 6.2.3.1 Refrigeración (cámaras frías, refrigeradores y termos). 6.2.3.2 Registro y control de temperatura. 6.2.3.3 Transporte. 6.2.3.4 Registro y control de vacunas. 6.2.4 La temperatura del área de almacenamiento, de la cámara fría y de los refrigeradores, debe registrarse gráficamente, por lo menos cada ocho horas. 6.2.5 Los periodos de almacenamiento de las vacunas en los diferentes niveles de la cadena de frío son: Nivel Nacional de 6 a 24 meses. Nivel Estatal de 4 a 6 meses, a partir de la fecha de recepción del nivel nacional. Nivel Jurisdiccional o Zonal de 2 a 4 meses, a partir de la fecha de recepción del nivel estatal. Nivel Local de 1 a 2 meses, a partir de la fecha de recepción del nivel jurisdiccional. El tiempo máximo que debe permanecer el biológico en el estado no debe sobrepasar los 6 meses (el periodo de tiempo entre los distintos niveles no es sumable). 6.2.6 La vida útil para administrar las vacunas de frascos abiertos en el nivel aplicativo, que no hayan salido a campo, será:
- 21. 6.2.6.1 Vacuna BCG, sólo una jornada de trabajo (8 horas); 6.2.6.2 Vacunas Sabin, DPT, DPT+HB+Hib, DT y Td, una semana de trabajo, siempre y cuando se garantice que su manejo fue hecho bajo estrictas medidas de asepsia y, su conservación dentro de las unidades de salud, fue adecuado (entre dos y ocho grados centígrados); 6.2.6.3 Vacuna contra sarampión, rubéola y parotiditis, sólo una jornada de trabajo (ocho horas); 6.2.7 Si las vacunas se utilizaron en actividades extramuros (brigadas de campo), los frascos sobrantes y los cerrados, sin excepción deberán desecharse al término de una jornada de trabajo, aun cuando contengan dosis. 6.2.8 Las instituciones de salud proporcionarán al personal responsable de la vacunación universal, capacitación continua sobre la cadena de frío, en los diferentes niveles operativos o administrativos. 6.3 Eventos adversos temporalmente asociados a la vacunación 6.3.1 Las instituciones y servicios de salud públicos, privados y sociales, deberán notificar la presencia de eventos adversos temporalmente asociados a la vacunación, clasificados como moderados o graves. Asimismo, realizarán los estudios de caso y campo correspondientes, establecerán el diagnóstico y el tratamiento inmediato, y establecerán las medidas de control pertinentes. 6.3.2 Los eventos adversos moderados o graves deberán ser notificados de manera inmediata o tan pronto se tenga conocimiento de su existencia, a la autoridad inmediata superior según la estructura institucional correspondiente, y a las autoridades sanitarias. Inicialmente, la notificación se efectuará por la vía más expedita: teléfono, correo electrónico, fax o telegrama. 6.3.3 Toda notificación se realizará a la Dirección General Adjunta de Epidemiología de la SSA, de conformidad con las indicaciones establecidas en la Norma Oficial Mexicana NOM-017- SSA2-1994, Para la Vigilancia Epidemiológica. 6.4 Vacunación a grupos de población cautiva 6.4.1 Las instituciones de salud de carácter público están obligadas a realizar la vacunación de los niños menores de quince años, que forman parte de los grupos de población cautiva. 6.4.2 Es responsabilidad de las diferentes instituciones de salud de carácter público, realizar acciones de control de casos y brotes de enfermedades evitables por vacunación, así como el estudio, tratamiento y control de los posibles eventos adversos a la ministración de las vacunas que se presenten en los grupos de población cautiva, ubicados en su área de responsabilidad. 6.4.3 Los responsables de los grupos de población cautiva, participarán en el desarrollo de las actividades de vacunación y control de las enfermedades evitables por vacunación, y proporcionarán a las instituciones de salud de su área de influencia la información necesaria sobre la población vacunada y la sujeta a vacunación, así como la presencia de casos y posibles eventos adversos ocurridos. 6.5 Control de casos y brotes 6.5.1 Poliomielitis
- 22. 6.5.1.1 Todo caso de parálisis flácida aguda en población menor de quince años de edad (PFA) será considerado como un posible brote de poliomielitis; por tanto, las acciones de bloqueo vacunal deben efectuarse en forma inmediata, realizándose simultáneamente la investigación correspondiente, de conformidad con la Norma Oficial Mexicana NOM-017-SSA2-1994, Para la Vigilancia Epidemiológica. 6.5.1.2 El bloqueo vacunal será realizado dentro de las primeras 72 horas a partir de aquélla en la que se tenga conocimiento del caso, a nivel local, regional o estatal. De acuerdo con su ubicación geográfica, las acciones de bloqueo se efectuarán por la institución de salud responsable de dicha área. 6.5.1.3 Ante la presencia de casos probables, se vacunará a todos los menores de cinco años, independientemente de sus antecedentes en cuanto a vacunación, de conformidad con los lineamientos establecidos. En situaciones especiales, podrá vacunarse a la población adulta en riesgo. Los resultados de las acciones de control deberán notificarse dentro de los tres días hábiles posteriores al término de la actividad, en los formatos correspondientes. 6.5.2 Difteria 6.5.2.1 La presencia de un solo caso obliga a desarrollar de inmediato la investigación epidemiológica y las correspondientes acciones de bloqueo vacunal. 6.5.2.2 La aplicación de antitoxina diftérica y el tratamiento específico del caso, se realizarán al momento en que se diagnostique por el cuadro clínico presentado, sin esperar resultados de laboratorio para su confirmación. 6.5.2.3 En los menores de cinco años se aplicarán las vacunas DPT+HB+Hib o DPT, según sea el caso, para completar esquemas, incluidos los refuerzos de la DPT. A los niños mayores de cinco años y personas consideradas contactos estrechos, incluyendo a médicos y enfermeras que los han atendido, se les aplicarán dos dosis de la vacuna Td, con un intervalo de seis a ocho semanas entre cada dosis. Las acciones de control deberán notificarse, en los formatos correspondientes, dentro de los tres días hábiles posteriores al término de la actividad. 6.5.3 Tos ferina 6.5.3.1 Las acciones de control se realizarán fundamentalmente en menores de cinco años, así como entre escolares y personas, que sean contactos cercanos o convivientes de casos confirmados y de aquellos que sean compatibles con tos ferina. 6.5.3.2 A los menores de cinco años se les aplicará la vacuna DPT+HB+Hib o la DPT, según sea el caso, para completar esquemas, incluidos los refuerzos de la DPT. Además de lo anterior, recibirán quimioprofilaxis con eritromicina. En cuanto a los niños mayores de cinco años, se administrará únicamente la quimioprofilaxis con eritromicina. 6.5.3.3 Tanto los casos, como sus contactos, quedarán bajo vigilancia en sus domicilios, por lo menos durante cinco días después del inicio del tratamiento o de la quimioprofilaxis. Las acciones de control se notificarán en los formatos correspondientes, dentro de los tres días hábiles posteriores al término de la actividad. 6.5.4 Tétanos Neonatal 6.5.4.1 Ante la presencia de un caso, se establecerán acciones de control mediante la vacunación con Td, a todas las mujeres en edad fértil que radiquen en el municipio donde se registró el caso, con énfasis en la localidad. 6.5.4.2 En las mujeres embarazadas, la vacuna se puede aplicar en cualquier edad gestacional, de preferencia en el primer contacto con los servicios de salud; aplicar al menos
- 23. dos dosis, con intervalo de cuatro a ocho semanas entre cada una, posteriormente una dosis de refuerzo con cada embarazo hasta completar cinco dosis (esquema recomendado por la OMS) y revacunación cada cinco a diez años. 6.5.5 Sarampión 6.5.5.1 Las acciones de control se efectuarán ante todo caso definido operacionalmente como probable o confirmado y se considera como grupo blanco a los niños entre seis meses y 14 años de edad. 6.5.5.2 Ante la presencia de un brote, los niños de seis a 11 meses que se encuentren alrededor del caso, deberán ser protegidos con una dosis de vacuna antisarampión monovalente o Triple viral, que será considerada como preliminar, y recibirán la primera dosis del esquema con Triple Viral al cumplir los doce meses. 6.5.6 Rabia 6.5.6.1 Las acciones de control se verificarán ante todo caso definido como sospechoso o confirmado, independientemente del tiempo de diagnóstico empleado. 6.5.6.2 Ante la presencia de un brote, se cumplirán las medidas de control conforme a las indicaciones establecidas en la Norma Oficial Mexicana NOM-011-SSA2-1993, para la Prevención y Control de la Rabia, y la Norma Oficial Mexicana NOM-017-SSA2-1994, para la Vigilancia Epidemiológica. 7. Prevención y control de las enfermedades diarreicas 7.1 Medidas de Prevención 7.1.1 El saneamiento ambiental y la educación para la salud de la población, en particular de las madres, han comprobado ser las más importantes medidas de prevención. 7.1.2 Tales medidas pueden dividirse en dos tipos: las que interrumpen los mecanismos de transmisión de la enfermedad; y las que incrementan la resistencia del huésped a la infección. 7.1.3 Según lo demuestran diferentes estudios, sobresale la lactancia materna como factor importante para la reducción de la incidencia por diarreas en los niños menores de seis meses y, en general, el uso de agua potable, la eliminación adecuada de excretas, el lavado de manos y el manejo correcto de las heces, en niños con diarrea. Respecto a la mortalidad, también destaca la lactancia materna en cuanto a los menores de seis meses y, asimismo, el uso de agua potable, la eliminación adecuada de excretas y la vacuna contra el sarampión, que reduce la mortalidad por diarrea hasta en un 22%. 7.1.4 Las tareas específicas efectivas para prevenir las enfermedades diarreicas, son: 7.1.4.1 Cloración del agua y procedimientos de desinfección; 7.1.4.2 Lactancia materna exclusiva, durante los primeros cuatro a seis meses de vida; 7.1.4.3 Mejoramiento de las prácticas de ablactación, a partir de los cuatro a seis meses de edad; 7.1.4.4 Promoción de la higiene en el hogar, con énfasis en el lavado de manos, manejo higiénico de los alimentos y la eliminación correcta de las excretas en niños con diarrea; 7.1.4.5 Vacunación contra el sarampión;
- 24. 7.1.4.6 Administración de vitamina "A" como suplemento, que juega un papel central en la resistencia inmunológica a la infección. 7.2 Medidas de Control 7.2.1 La atención eficaz y oportuna de la enfermedad diarreica comprende tres acciones principales: la administración de líquidos en forma de tés, agua de frutas, cocimientos de cereal y Vida Suero Oral, así como el mantener la alimentación habitual. Ambas acciones evitan por un lado la deshidratación y por el otro la desnutrición. La tercera está orientada a que la madre o responsable del niño identifique oportunamente la presencia de complicaciones. 7.2.2 Las enfermedades diarreicas, de acuerdo con la evaluación del estado de hidratación, se clasifican en: casos sin deshidratación, con deshidratación, con choque hipovolémico por deshidratación. 7.2.3 Caso sin deshidratación, es aquel que presenta generalmente menos de cuatro evacuaciones líquidas en 24 horas, ausencia de vómito, sin signos clínicos de deshidratación. 7.2.4 Caso con deshidratación, es aquel que presenta dos o más de las manifestaciones clínicas siguientes: 7.2.4.1 Inquieto o irritable; 7.2.4.2 Ojos hundidos, llanto sin lágrimas; 7.2.4.3 Boca y lengua secas, saliva espesa; 7.2.4.4 Respiración rápida; 7.2.4.5 Sed aumentada, bebe con avidez; 7.2.4.6 Elasticidad de la piel, mayor o igual a dos segundos; 7.2.4.7 Pulso rápido; 7.2.4.8 Llenado capilar de tres a cinco segundos; 7.2.4.9 Fontanela anterior hundida (lactantes); 7.2.5 Caso con choque hipovolémico, es aquel que presenta dos o más de las manifestaciones clínicas siguientes: 7.2.5.1 Inconsciente o hipotónico; 7.2.5.2 No puede beber; 7.2.5.3 Pulso débil o ausente; 7.2.5.4 Llenado capilar mayor de cinco segundos; 7.2.6 El manejo de los casos de enfermedades diarreicas se basa en tres planes generales de tratamiento: 7.2.6.1 Plan A: Para pacientes con enfermedad diarreica sin deshidratación con atención en el hogar:
- 25. 7.2.6.1.1 Continuar con la alimentación habitual; 7.2.6.1.2 Aumentar la ingesta de los líquidos de uso regular en el hogar así como Vida Suero Oral: de este último, en los niños menores de un año de edad, ofrecer media taza (75 ml) y en los mayores de un año, una taza (150 ml) y administrarlo a cucharadas o mediante sorbos pequeños, después de cada evacuación. 7.2.6.1.3 Capacitar a la madre para reconocer los signos de deshidratación y otros de alarma por enfermedades diarreicas: (sed intensa, poca ingesta de líquidos y alimentos, numerosas heces líquidas, fiebre, vómito y sangre en las evacuaciones), con el propósito de que acuda nuevamente a solicitar atención médica en forma oportuna. 7.2.6.2 Plan B: Para pacientes con diarrea y deshidratación con atención en la unidad de salud: 7.2.6.2.1 Administrar Vida Suero Oral 100 ml por kilogramo de peso, en dosis fraccionadas cada 30 minutos durante cuatro horas; 7.2.6.2.2 Si el paciente presenta vómito, esperar 10 minutos e intentar otra vez la hidratación oral, más lentamente; 7.2.6.2.3 Al mejorar el estado de hidratación, pasar al Plan A. En caso contrario, repetir el Plan B por otras cuatro horas, de no existir mejoría pasar al Plan C; 7.2.6.2.4 Si los vómitos persisten, existe rechazo al Vida Suero Oral, o gasto fecal elevado (más de10 g/kg/hora o más de tres evacuaciones por hora) se hidratará con sonda nasogástrica, a razón de 20 a 30 ml de Vida Suero Oral por kilogramo de peso, por hora. 7.2.6.3 Plan C: Para pacientes con choque hipovolémico por deshidratación: 7.2.6.3.1 Inicie inmediatamente administración de líquidos por vía intravenosa, con solución Hartmann; si no se encuentra disponible, use solución salina isotónica al 0.9%, de acuerdo con el siguiente esquema: PRIMERA HORA 50 ml/kg SEGUNDA HORA 25 ml/kg TERCERA HORA 25 ml/kg • Evalúe al paciente continuamente. Si no mejora, aumente la velocidad de infusión. • Cuando pueda beber (usualmente en dos a tres horas), administre VSO, a dosis de 25 ml/kg/hora; mientras sigue líquidos IV. • Al completar la dosis IV, evalúe al paciente para seleccionar Plan A o B, y retirar venoclisis, o repetir Plan C. • Si selecciona el Plan A, observe durante dos horas para asegurarse de que el responsable encargado del paciente puede mantenerlo hidratado con VSO y además, alimentarlo en su domicilio. 7.2.6.4 Uso de Antimicrobianos
- 26. 7.2.6.4.1 Los antimicrobianos no son útiles en el tratamiento de las enfermedades diarreicas en el 90% de los casos. Por otra parte, su uso puede propiciar que la enfermedad se prolongue y ocasionar resistencia bacteriana. 7.2.6.4.2 Los antimicrobianos sólo están indicados en casos de diarrea por: Shigella sp, Vibrio cholerae, presencia de trofozoitos de Entamoeba histolytica o Giardia lamblia, de acuerdo con el cuadro siguiente: USO DE ANTIMICROBIANOS EN LAS ENFERMEDADES DIARREICAS DIAGNOSTICO MEDICAMENTO DE ELECCION ALTERNATIVA Disentería por Shigella Trimetoprim, 10 mg/kg/día, con sulfametoxazol, 50 mg/kg/día, divididos en dos dosis diarias, durante cinco días, vía oral. Ampicilina 100 mg/kg/día divididos en cuatro dosis diarias, durante cinco días, vía oral. Amibiasis intestinal Metronidazol, 30 mg/kg/día, divididos en tres dosis diarias, durante 10 días, vía oral. Tinidazol, 50 mg/kg/día una vez al día por 3 días, vía oral. Giardiasis intestinal Metronidazol 15 mg/kg/día, divididos en tres dosis diarias, durante cinco días, vía oral. Albendazol 400 mgs por día, durante cinco días, vía oral. Cólera Eritromicina 30 mg/kg/día, divididos en tres dosis diarias, durante tres días, vía oral. Trimetoprim, 8 a 10 mg/kg/día con sulfametoxazol 40-50 mg/Kg/día, divididos en dos dosis diarias, durante 3 días, vía oral. 7.3 Vigilancia Epidemiológica 7.3.1 La vigilancia epidemiológica y las notificaciones de casos y defunciones por enfermedades diarreicas se realizará de conformidad con la Norma Oficial Mexicana NOM-017- SSA2-1994, para la Vigilancia Epidemiológica. 7.3.2 Para el efecto de notificación de casos y defunciones por enfermedades diarreicas, se considerará la Décima Revisión de la Clasificación Estadística Internacional de Enfermedades y Problemas Relacionados con la Salud que incluye: A00 Cólera; A01 Fiebres tifoidea y paratifoidea; A02 Otras infecciones debidas a Salmonella; A03 Shigelosis; A04 Otras infecciones intestinales bacterianas; A05 Otras intoxicaciones alimentarias bacterianas; A06 Amibiasis;
- 27. A07 Otras enfermedades intestinales debidas a protozoarios; A08 Infecciones intestinales debidas a virus y otros organismos especificados; A09 Diarrea y gastroenteritis de presunto origen infeccioso. 8. Prevención y control de las infecciones respiratorias agudas 8.1 Medidas de Prevención 8.1.1 Las actividades que han demostrado ser efectivas en la prevención de las infecciones respiratorias agudas, y que se deben promover en la comunidad, son: 8.1.1.1 Dar lactancia materna exclusiva, durante los primeros cuatro a seis meses de vida, y complementaria después de esa edad; 8.1.1.2 Vigilar y en caso necesario, orientar a la familia sobre la alimentación adecuada y otras medidas que contribuyan a corregir el estado nutricional del niño; 8.1.1.3 Vacunar contra el sarampión, tos ferina, difteria e infecciones invasivas por Haemophilus influenzae tipo b, de acuerdo con el esquema referido en el numeral 5.1.1.1 de esta Norma y el que señale la Cartilla Nacional de Vacunación vigente; 8.1.1.4 Evitar fumar cerca de los niños; 8.1.1.5 Evitar la combustión de leña, o el uso de braseros, en habitaciones cerradas; 8.1.1.6 Evitar los cambios bruscos de temperatura; 8.1.1.7 En época de frío, mantener abrigados a los niños; 8.1.1.8 Proporcionar el aporte adecuado de líquidos, frutas y verduras amarillas o anaranjadas, que contengan vitaminas "A" y "C"; 8.1.1.9 Evitar el hacinamiento humano, para disminuir la transmisión de estas infecciones; 8.1.1.10 Ventilar la habitación del niño; 8.1.1.11 Fomentar la atención médica del niño sano; 8.2 Medidas de control 8.2.1 En la atención de los niños con IRA, el interrogatorio y la inspección se deben orientar hacia la identificación, en primer lugar, de la presencia o no de neumonía y en forma secundaria, de otitis media aguda, faringoamigdalitis purulenta u otra entidad nosológica de etiología bacteriana. 8.2.2 Se ha aceptado que la polipnea es el signo predictor más temprano de neumonía, con una alta sensibilidad y especificidad, además de constituir el primero de los mecanismos que el organismo pone en marcha ante la dificultad respiratoria. 8.2.3 Las infecciones respiratorias agudas, de acuerdo con las características clínicas, se clasifican en casos: sin neumonía; con neumonía y dificultad respiratoria leve (polipnea o taquipnea); y con neumonía y dificultad respiratoria grave (tiraje, cianosis y disociación tóraco- abdominal).
- 28. 8.2.4 Características clínicas de las IRA sin neumonía. 8.2.4.1 Rinofaringitis: 8.2.4.1.1 Estornudos; 8.2.4.1.2 Rinorrea; 8.2.4.1.3 Obstrucción nasal; 8.2.4.1.4 Enrojecimiento de la faringe; 8.2.4.1.5 Dolor faríngeo. 8.2.4.2 Faringitis congestiva: 8.2.4.2.1 Dolor faríngeo; 8.2.4.2.2 Vesículas o ulceraciones; 8.2.4.2.3 Enrojecimiento de la faringe. 8.2.4.3 Faringoamigdalitis purulenta: 8.2.4.3.1 Dolor faríngeo; 8.2.4.3.2 Adenopatía cervical; 8.2.4.3.3 Ausencia de rinorrea; 8.2.4.3.4 Fiebre. 8.2.4.4 Otitis media aguda: 8.2.4.4.1 Otalgia; 8.2.4.4.2 Otorrea menor de dos semanas; 8.2.4.4.3 Tímpano abombado. 8.2.4.5 Sinusitis: 8.2.4.5.1 Dolor facial o cefalea; 8.2.4.5.2 Rinorrea mucopurulenta; 8.2.4.5.3 Fiebre mayor de cuatro días, o reaparición después de cuatro días. 8.2.4.6 Laringitis: 8.2.4.6.1 Disfonía; 8.2.4.6.2 Estridor laríngeo. 8.2.4.7 Bronquitis:
- 29. 8.2.4.7.1 Estertores bronquiales; 8.2.4.7.2 Tos con expectoración. 8.2.5 El manejo de los casos de infecciones respiratorias agudas se basa en tres planes generales de tratamiento: 8.2.5.1 Plan A: Tratamiento para niños con IRA sin neumonía: 8.2.5.1.1 Medidas generales 8.2.5.1.1.1 Aumentar la ingesta de líquidos; 8.2.5.1.1.2 Mantener la alimentación habitual; 8.2.5.1.1.3 No suspender la lactancia al seno materno; 8.2.5.1.1.4 Si hay otorrea, limpieza del conducto auditivo externo, con mechas de gasa o tela absorbente, tres veces al día. No aplicar gotas óticas; 8.2.5.1.1.5 Control del dolor, la fiebre, y el malestar general, con acetaminofén, 60 mg/kg/día, vía oral, dividido en cuatro a seis tomas; 8.2.5.1.1.6 En menores de un año, no aplicar supositorios para la fiebre; 8.2.5.1.1.7 No utilizar jarabes o antihistamínicos; 8.2.5.1.1.8 Si existen factores de mal pronóstico, revalorar al niño en 48 horas y capacitar a la madre o responsable del menor en el reconocimiento de los signos de dificultad respiratoria así como los cuidados en el hogar, con el propósito de que acuda nuevamente a solicitar atención médica en forma oportuna; 8.2.5.1.1.9 Explicar a la madre por qué la tos es un mecanismo de defensa, que se debe favorecer; 8.2.5.1.1.10 Revisar la Cartilla Nacional de Vacunación y aplicar las dosis faltantes; y 8.2.5.1.1.11 Evaluar el estado nutricional, así como registrar peso y talla en la Cartilla Nacional de Vacunación. 8.2.5.1.2 Antimicrobianos: 8.2.5.1.2.1 Sólo están indicados en casos de faringoamigdalitis purulenta, otitis media aguda y sinusitis, de acuerdo con el cuadro siguiente: USO DE ANTIMICROBIANOS EN LAS INFECCIONES RESPIRATORIAS AGUDAS SIN NEUMONIA DIAGNOSTICO MEDICAMENTO DE ELECCION ALTERNATIVA Faringoamigdalitis purulenta Penicilina benzatínica combinada, 1’200,000 U.I., dosis única, vía intramuscular. Eritromicina 30-40 mg/kg/día dividido en tres dosis durante 10 días o Clindamicina 10-20 mg/kg/día dividido en 4 dosis
- 30. durante 10 días. Otitis media aguda Amoxicilina, 40 mg/kg/día divididos en tres dosis diarias, durante siete días, vía oral. Trimetoprim 8 a 10 mg/kg/día con sulfametoxazol 40 a 50 mg/kg/día, divididos en dos dosis diarias, durante siete días, vía oral. Sinusitis Amoxicilina, 40 mg/kg/día divididos en tres dosis diarias, durante siete días, vía oral. Trimetoprim 8 a 10 mg/kg/día con sulfametoxazol 40 a 50 mg/kg/día, divididos en dos dosis diarias, durante siete días, vía oral. 8.2.5.1.3 Capacitación a la madre o responsable del niño: 8.2.5.1.3.1 La capacitación debe estar dirigida fundamentalmente hacia la identificación de los signos de alarma (respiración rápida, tiraje, dificultad para respirar, beber y amamantarse, o avance de la enfermedad), a fin de que la madre acuda urgentemente a la unidad de salud más cercana; además, hacia los cuidados generales que deben brindarse al niño en el hogar. 8.2.5.2 Plan B: Tratamiento para niños con neumonía leve, sin factores de mal pronóstico: 8.2.5.2.1 Medidas generales; 8.2.5.2.1.1 Tratamiento ambulatorio; 8.2.5.2.1.2 Aumentar la ingesta de líquidos; 8.2.5.2.1.3 Mantener la alimentación habitual, pero en pequeñas fracciones, un mayor número de veces al día; 8.2.5.2.1.4 No suspender la lactancia al seno materno; 8.2.5.2.1.5 Controlar la fiebre: con acetaminofén, 60 mg/kg/día, por vía oral, divididos en cuatro a seis dosis diarias; 8.2.5.2.1.6 En caso de sibilancias, administrar salbutamol jarabe, 0.2-0.3 mg/kg/día, vía oral, divididos en tres dosis diarias. En el menor de un año, valorar la respuesta en una o dos horas; si es positiva, continuar con salbutamol, y si es negativa, suspender el tratamiento. En mayores de un año continuarlo, y 8.2.5.2.1.7 Revalorar en 24 horas, o antes, si se agrava. 8.2.5.2.2 Antimicrobianos: 8.2.5.2.2.1 Amoxicilina, 40 mg/kg/día divididos en tres dosis diarias, durante siete días, vía oral o Trimetoprim 8-10 mg/kg/día, con sulfametoxazol, 40-50 mg/kg/día, divididos en dos dosis diarias, durante siete días, vía oral. 8.2.5.2.3 Capacitación a la madre: 8.2.5.2.3.1 La capacitación debe estar dirigida, fundamentalmente, hacia la identificación de los signos de alarma (respiración rápida, dificultad para respirar, beber y amamantarse, o avance de la enfermedad), a fin de que la madre acuda urgentemente a la unidad de salud más cercana; además, hacia los cuidados generales que deben brindarse al niño en el hogar.
- 31. 8.2.5.3 Plan C: Tratamiento para niños con neumonía grave o neumonía leve, con factores de mal pronóstico: 8.2.5.3.1 Manejo y tratamiento: 8.2.5.3.1.1 Envío inmediato a un hospital; 8.2.5.3.1.2 Traslado con oxígeno, si es necesario (4 a 6 litros por minuto); 8.2.5.3.1.3 Control de la fiebre: acetaminofén, 15 mg/kg, vía oral, dosis única, y 8.2.5.3.1.4 En caso de sibilancias, administrar salbutamol jarabe, 0.15 mg/kg por dosis, vía oral o inhalado (dos disparos con espaciador de aire) o 0.1 ml de adrenalina, 1:1000, vía subcutánea. 8.2.5.3.2 Antimicrobianos: 8.2.5.3.2.1 Primera opción: 8.2.5.3.2.1.1 En el menor de dos meses, ampicilina, 50 mg/kg/día, vía oral o intramuscular; 8.2.5.3.2.1.2 En niños de dos meses a cuatro años, Bencilpenicilina sódica cristalina, 100,000 U.I. por kg, vía intramuscular. 8.2.5.3.2.2 Segunda opción: en los casos donde no hay respuesta positiva, el cuadro siguiente es útil para orientar la selección de antimicrobianos: USO DE ANTIMICROBIANOS EN NEUMONIA CUADRO CLINICO GERMEN PROBABLE MEDICAMENTO DE ELECCION ALTERNATIVA Bronconeumonía S. pneumoniae S. beta hemolítico Penicilina Cloranfenicol o TMP/SMZ Neumonía lobar o segmentaria S. pneumoniae Haemophilus influenzae b Ampicilina o cefuroxina Cloranfenicol o TMP/SMZ Neumonía por aspiración Flora de faringe Penicilina Clindamicina Penicilina más Amikacina Neumonía con derrame S. aureus H. influenzae Dicloxacilina más Cloranfenicol Dicloxacilina más Gentamicina Neumonía con focos múltiples S. aureus Enterobacterias Dicloxacilina más Amikacina Vancomicina más Amikacina Neumonía en el menor de dos meses Enterobacterias Streptococcus B Ampicilina más Amikacina Vancomicina o Eritromicina más cefalosporina de tercera generación
- 32. Neumonía intrahospitalaria S. aureus Enterobacterias Dicloxacilina más Amikacina Cefalosporina de tercera generación más aminoglucócido Neumonía en pacientes granulocitopénicos Enterobacterias Pseudomonas Staphylococcus Imipenem más Amikacina Vancomicina más Amikacina 8.3 Vigilancia Epidemiológica 8.3.1 La vigilancia epidemiológica y notificaciones de casos y defunciones por infecciones respiratorias agudas se realizará de conformidad con la Norma Oficial Mexicana NOM-017- SSA2-1994, Para la Vigilancia Epidemiológica. 9. Control de la nutrición, el crecimiento y el desarrollo del niño menor de cinco años 9.1 Medidas de Prevención: Las actividades que han demostrado ser efectivas y que deben promoverse en la comunidad, son: 9.1.1 Orientación alimentaria a la madre o responsable del menor de cinco años en los siguientes aspectos: 9.1.1.1 Alimentación adecuada de la madre durante el embarazo y lactancia; 9.1.1.2 Lactancia materna exclusiva durante los primeros cuatro a seis meses de vida; 9.1.1.3 Ablactación adecuada; 9.1.1.4 Orientación a la madre y al niño para la utilización de alimentos locales en forma variada y combinada. 9.1.1.5 Promoción de la higiene dentro del hogar, con énfasis en el lavado de manos, corte de uñas periódicamente, el consumo de agua hervida y cloración de la misma, así como en el manejo de alimentos; 9.1.1.6 Capacitar a la madre o responsable del menor de cinco años en signos de alarma por desnutrición. 9.1.2 Esquema básico de vacunación completo; 9.1.3 Desparasitación intestinal periódica mediante tratamiento con Albendazol dos veces al año; 9.1.4 Megadosis de vitamina A, en administración periódica; 9.1.5 Fomentar la atención médica del niño sano, para vigilar su crecimiento y desarrollo, en forma periódica; 9.1.6 Atención integrada del niño enfermo. 9.2 Consultas
- 33. 9.2.1 En cada consulta se deberá registrar: edad (en el menor de un año en meses y días y en el mayor de un año en años y meses), peso, talla, perímetro cefálico y evaluación del desarrollo psicomotor. 9.2.2 El personal de salud deberá otorgar al niño menor de 28 días dos consultas médicas, la primera a los siete días y la segunda a los 28. 9.2.3 El personal de salud deberá otorgar al niño menor de un año seis consultas al año, una cada dos meses. 9.2.4 El personal de salud deberá otorgar al niño de uno a cuatro años, una consulta con una periodicidad mínima de cada seis meses. 9.2.5 Se consideran como mínimas, para el registro de peso y talla de los niños en la Cartilla Nacional de Vacunación y en el Censo Nominal, las visitas a las unidades de salud con objeto de recibir las dosis del Esquema Básico de Vacunación: 9.2.5.1 Menores de un año: al nacimiento, a los dos, cuatro y seis meses de edad; 9.2.5.2 Al año; 9.2.5.3 A los dos años; y 9.2.5.4 A los cuatro años. 9.3 Somatometría 9.3.1 Longitud, talla: la longitud debe medirse acostando en un Infantómetro a los niños que no pueden ponerse de pie. Se utilizará el estadímetro en niños que pueden ponerse de pie; se deben retirar zapatos y descubrir la cabeza de objetos y peinados que alteren la medición; hay que asegurarse que el niño tenga las rodillas estiradas, la espalda recta y la vista al frente. La lectura se debe realizar frente a la escala y debe anotarse en centímetros. 9.3.2 Peso: para su medición se debe calibrar y colocar la báscula en una superficie plana (báscula pesa bebé o de piso), o colgarla de un sitio fijo (báscula de resorte), se debe retirar toda la ropa, zapatos y objetos pesados, colocando al niño en la báscula y realizando la lectura de la medición cuando el instrumento esté sin movimiento, de frente a la escala de medición y expresarse en kilogramos. 9.3.3 Perímetro cefálico: debe realizarse hasta los dos años de edad, con cinta métrica metálica, flexible, 5 milímetros de ancho, expresándose en centímetros. En caso de detectarse problema, se efectuará el seguimiento del mismo y la medición por especialistas, hasta que el niño cumpla los cinco años de edad. 9.4 Valoración del estado de nutrición 9.4.1 La valoración del estado de nutrición debe basarse en una evaluación que comprende: historia dietética, social y económica, historia clínica con énfasis en los datos antropométricos y signos de desnutrición. 9.4.2 Los índices antropométricos a utilizar en la valoración del estado nutricional son: peso para la edad, talla para la edad y peso para la talla. 9.4.2.1 Para la valoración de peso-edad, se aplicarán las Tablas 1 y 2 del APENDICE A; 9.4.2.2 Para la valoración de talla-edad, se utilizarán las Tablas 1 y 2 del APENDICE B;
- 34. 9.4.2.3 Para la valoración de peso-talla, se hará uso de las Tablas 1 y 2 del APENDICE C; 9.4.2.4 La clasificación del estado de nutrición se realizará de acuerdo a los cuadros 1, 2 y 3 del APENDICE D. 9.4.5 La evaluación del perímetro cefálico se realizará de acuerdo a las tablas 1 y 2 del APENDICE E; 9.4.6 Las unidades de salud deben disponer e incorporar en los expedientes clínicos, tablas de crecimiento y desarrollo o las gráficas que de ellas se deriven. 9.5 Medidas de control 9.5.1 Atención de la desnutrición: 9.5.1.1 Desnutrición leve: incorporarlo a un programa de orientación alimentaria, consulta mensual en la unidad de salud hasta su recuperación. 9.5.1.2 Desnutrición moderada sin infección agregada que ponga en riesgo su vida: incorporarlo a un programa de recuperación nutricia ambulatorio, consulta cada 15 días hasta que disminuya el grado de desnutrición y continuar en un programa de orientación alimentaria hasta su recuperación. 9.5.1.3 Desnutrición moderada con infección agregada que ponga en riesgo su vida: envío a una unidad de segundo nivel, al disminuir el grado de desnutrición y ser dado de alta, incorporarlo a un programa de recuperación nutricia ambulatorio, consulta cada 15 días hasta que disminuya el grado de desnutrición y continuar en un programa de orientación alimentaria hasta su recuperación. 9.5.1.4 Desnutrición grave: envío a una unidad de segundo nivel, al disminuir el grado de desnutrición y ser dado de alta, incorporarlo a un programa de recuperación nutricia ambulatorio, consulta cada 15 días hasta que disminuya el grado de desnutrición y continuar en un programa de orientación alimentaria hasta su recuperación. 9.5.1.5 En caso de sobrepeso u obesidad: integrarlo a un programa de orientación alimentaria, incrementar la actividad física y evaluar periódicamente su estado de nutrición. 9.5.2 Para clasificar la desnutrición, se emplean las mediciones de peso para la edad, peso para la talla o talla para la edad, y se comparan con los valores de una población de referencia que establezca indicadores. Actualmente se usan las tablas propuestas por la Organización Mundial de la Salud (APENDICE "A" al "F"). La interpretación de estos indicadores somatométricos es como sigue: 9.5.2.1 Peso para la edad: útil para vigilar la evolución del niño, cuando se sigue su curva de crecimiento; 9.5.2.2 Peso para la talla: el bajo peso para la talla indica desnutrición aguda y refleja una pérdida de peso reciente. 9.5.2.3 Talla para la edad: una talla baja para la edad, refleja desnutrición crónica. 9.6 Valoración del desarrollo psicomotor del niño menor de un año y de uno a cuatro años de edad. 9.6.1 Se realizará cada que el niño acuda a consulta para el control de la nutrición y crecimiento, utilizando los parámetros de normalidad del APENDICE F.
- 35. 10. Cartilla Nacional de Vacunación 10.1 Es un documento gratuito, único e individual, oficialmente válido para toda la República Mexicana. Se utiliza para el registro y control de las acciones de vacunación, así como para la anotación del peso y la talla del niño. En su distribución participan las unidades operativas del Sistema Nacional de Salud y las Oficialías o Juzgados del Registro Civil (Vacunación Universal. Manual de Procedimientos Técnicos). 10.2 La Cartilla se entregará a los padres, tutores o responsables de los niños menores de cinco años, al ser vacunados por alguna institución de salud. Las Oficialías o Juzgados del Registro Civil, la entregarán en el momento en que el niño sea registrado, cuando éste carezca de ella, evitando así duplicar la entrega del documento. 10.3 El personal del servicio de inmunizaciones, o el vacunador de campo, deben entregar la Cartilla a todo niño que no cuente con ella, aun cuando éste no haya sido registrado. 10.4 Corresponde a las Oficialías o Juzgados del Registro Civil, asignar el número de la Clave Unica del Registro de Población, tanto a las Cartillas otorgadas por el propio Registro Civil, como a las entregadas por el personal de las diversas instituciones del Sistema Nacional de Salud. 10.5 El personal de salud anotará en la Cartilla del niño, la clave CURP que aparece en el acta de nacimiento, cuando éste haya sido registrado. Si aún no está registrado, se dejará en blanco el espacio asignado para la clave CURP, remitiendo a los padres de familia o tutores a las Oficialías o Juzgados del Registro Civil, con objeto de que éstos la asignen. Asimismo, el personal de salud registrará en el documento las dosis aplicadas, el peso y la talla según corresponda a los servicios proporcionados al niño. 10.6 En ningún caso las Oficialías del Registro Civil destruirán o cambiarán las Cartillas Nacionales de Vacunación, otorgadas a los menores vacunados por el personal de las unidades aplicativas de las diferentes instituciones de salud. 10.7 En los casos de pérdida de la Cartilla, el nuevo documento con que se dote al responsable del niño, deberá conservar la misma Clave Unica de Registro de Población. La transcripción de las dosis de vacuna anteriormente recibidas por el niño, se efectuará sólo por el personal de salud institucional, y esto se hará con base en el censo nominal o por los comprobantes de vacunación previos. Sólo para el caso de la vacuna BCG será válido considerar la cicatriz posvacunal. 10.8 Ante la ausencia de comprobantes o datos que avalen las dosis recibidas, se deberá iniciar el esquema de vacunación del niño. 10.9 Las instituciones que atienden a grupos de población menor de seis años, solicitarán a los padres o tutores de los niños, al ingresar o inscribirse, la Cartilla Nacional de Vacunación, y verificarán su esquema de vacunación. En caso de no cumplir aún con dicho esquema, los derivarán a la unidad de salud correspondiente. 10.10 Es obligación de las instituciones que integran el Sistema Nacional de Salud, proporcionar el respectivo comprobante a la población mayor de cinco años que reciba las vacunas no consideradas en el esquema básico, mismo que deberá contener: 10.10.1 Nombre de la institución o cédula profesional del médico que aplicó la(s) vacuna(s); 10.10.2 Nombre, edad y sexo de la persona que recibe la vacuna; 10.10.3 Domicilio de la persona;
- 36. 10.10.4 Nombre de la vacuna aplicada; 10.10.5 Fecha de su aplicación, y 10.10.6 Nombre y firma del vacunador. 10.11 Cada entidad federativa o institución de salud, establecerá los controles que considere necesarios para reponer los documentos oficiales (pérdida o extravío de la Cartilla Nacional de Vacunación o comprobantes de vacunación), señalando en los mismos las dosis anteriormente administradas. 11. Registro de la información 11.1 El control y la evaluación de los componentes de vacunación universal, control de la nutrición y crecimiento y desarrollo de los menores de cinco años, se efectuará en forma computarizada mediante el uso del Sistema de Información PROVAC. Cada institución de salud realizará el registro de la población de niños menores de ocho años en su área de responsabilidad (Sistema de Información PROVAC. Manual de Procedimientos Técnicos). 11.2 Las instituciones de salud levantarán el Censo Nominal de la población de niños menores de ocho años que reside en su área de responsabilidad, y realizarán el seguimiento del esquema de vacunación, así como el registro del peso y la talla de los niños, de manera permanente. A fin de mantener actualizado el Censo Nominal, es indispensable que las instituciones del Sistema Nacional de Salud capten los datos de todos los nacimientos ocurridos en su área de responsabilidad. 11.3 Para el caso de los servicios médicos privados, éstos llenarán el formato del Censo Nominal de los niños menores de ocho años que sean vacunados, pesados y medidos, y enviarán la información a la unidad operativa del Sistema Nacional de Salud más cercana a su domicilio. 11.4 Las instituciones de salud se coordinarán a efecto de intercambiar los listados de niños menores a ocho años, de nueva inclusión en el censo nominal, a fin de mantener actualizado el PROVAC. 11.5 Las instituciones que integran el Sistema Nacional de Salud, que efectúen la atención del parto, están obligadas a intercambiar los listados de recién nacidos atendidos por las mismas, con datos de identificación y localización domiciliaria. 12. Capacitación, participación comunitaria e información a la población 12.1 Capacitación 12.1.1 La capacitación será continua y permanente. La recibirá todo el personal de salud, incluyendo a los pasantes en servicio social y al de nuevo ingreso a las unidades médicas. 12.1.2 En apoyo a las acciones para preservar la salud del niño, el personal de los servicios de salud realizará entre la población las siguientes actividades de educación: 12.1.2.1 Instruir a la población acerca de las medidas preventivas para reducir la probabilidad de enfermar; 12.1.2.2 Fortalecer la responsabilidad personal y social de la población, en lo referente al autocuidado de su salud; 12.1.2.3 Promover la demanda oportuna de los servicios que ofrecen las unidades médicas del Sistema Nacional de Salud.
- 37. 12.2 Participación Comunitaria 12.2.1 Todas las instituciones de salud fomentarán la participación comunitaria, la cual estará orientada a formar conciencia y autorresponsabilidad en individuos, familias y grupos sociales, con el propósito de que proporcionen facilidades y participen activamente en las acciones de control, eliminación y erradicación de las enfermedades evitables por vacunación; en las de prevención y control de las enfermedades diarreicas; de prevención y control de las infecciones respiratorias agudas y en la vigilancia de la nutrición, el crecimiento y el desarrollo de los niños menores de cinco años; 12.2.2 Corresponde a las diferentes instituciones de salud, de carácter público, promover la organización y la participación de la comunidad en las siguientes acciones educativas: 12.2.2.1 Reclutamiento y capacitación de personal voluntario; 12.2.2.2 Colaboración con las brigadas de salud; y 12.2.2.3 Apoyo mediante la realización de acciones para la obtención de materiales de promoción y recursos necesarios para las campañas de Semanas Nacionales de Salud, enfermedades diarreicas, infecciones respiratorias agudas y nutrición. 12.2.3 En relación con la participación comunitaria, las instituciones de salud deberán: 12.2.3.1 Sensibilizar a la población para que permita el desarrollo de acciones preventivas y de control; 12.2.3.2 Invitar a maestros, padres de familia, líderes de opinión y grupos de la comunidad, a que colaboren en actividades educativas y de promoción; 12.2.3.3 Promover que agrupaciones profesionales de la comunidad y otras diversas, intervengan activamente en las acciones de salud del niño; 12.2.3.4 Procurar la integración y capacitación de otros grupos sociales, en acciones concretas de apoyo a la salud del niño; 12.2.3.5 Impulsar la gestión de recursos humanos, materiales, técnicos y económicos, ante autoridades locales, municipales y estatales, así como ante instituciones públicas, privadas y sociales, para el desarrollo de las actividades de salud del niño; y 12.2.3.6 Consolidar la participación activa de los diversos grupos sociales, en la planeación, ejecución y evaluación de las actividades de salud; 12.3 Información a la población 12.3.1 Se utilizarán los diferentes medios de información, tanto de corto, como de mediano y largo alcance, a través de comunicación directa, grupal o masiva, y se aprovechará la organización social, con énfasis en centros educativos y asociaciones civiles. 12.3.2 Las unidades médicas de los sectores público, social y privado, apoyarán las acciones de salud del niño mediante la realización de actividades de difusión que permitan orientar a la población sobre la preservación de la salud. 12.3.3 La promoción y la difusión de las acciones de salud del niño estarán dirigidas a: 12.3.3.1 Informar a la población respecto a las medidas preventivas para preservar la salud, los factores que intervienen para favorecer la enfermedad y los riesgos que los padecimientos conllevan;
- 38. 12.3.3.2 Disminuir los riesgos de adquirir padecimientos evitables, y 12.3.3.3 Eliminar el peligro de complicaciones, al tratar adecuada y oportunamente a los enfermos. 13. Bibliografía 13.1 Alvarez y Muñoz M.T., Bustamante Calvillo M.E. "Vacunación en la hepatitis B". En: Escobar Gutiérrez A., Valdespino Gómez J.L. y Sepúlveda Amor J. Vacunas, Ciencia y Salud. México: Secretaría de Salud,1992. pp. 274 y 275. 13.2 Ambruster C, Junker W, Vetter N. and Jaksch G. Disseminated Bacille Calmette-Guerin infection in the patients, 30 years after BCG vaccination. J. Infect. Dis. 1990; 162:1216. 13.3 Anderson LJ. And Heilman CA. Protective and Disease-Enhancing immune Responses to Respiratory Syncytial Virus. J. Infect. Dis. 1995; 171:1-7. 13.4 Asociación Española de Pediatría. Manual de Vacunas en Pediatría. 1a. Ed. Latinoamericana. EGRAF, S.A. 1997 pp. 212, 214, 215. 13.5 Benenson, Abraham S, ed. El control de las enfermedades transmisibles en el hombre. 15a. ed. Washington: OPS, 1992. pp. 267-274. (Publicación Científica: 538). 13.6 Benenson, Abraham S, ed. El control de las enfermedades transmisibles en el hombre. 14a. ed. Washington: OPS, 1993. (Publicación Científica: 507). 13.7 Cabrera Contreras R, Gómez de León P. "Prevención de la meningoencefalitis por Haemophilus influenzae b y por Neisseria meningitidis". En: Escobar Gutiérrez A, Valdespino Gómez JL y Sepúlveda Amor J. Vacunas, Ciencia y Salud. México: Secretaría de Salud. 1992. pp. 359-377. 13.8 Centers for Disease Control. Hepatitis B virus: A comprehensive strategy for eliminating transmission in the United States through universal childhood vaccination. MMWR 1991 (40 RR-13): 1-25. 13.9 Centers for Disease Control. Measles Prevention: Recommendations of the Immunization Practices Advisory Committee (ACIP). MMWR 1989; 38 (No. S-9). 13.10 Centers for Disease Control. Prevention and control of influenza. Recommendations of the Immunization Practices Advisory Committee (ACIP). MMWR 1994; 40 (RR-6): 1-15. 13.11 Centers for Disease Control. Recommendations of the Advisory Commitee on Inmunization Practices (ACIP). General Recommendations on Immunization. MMWR 1994; 43 (RR-1): 1-38. 13.12 Centers for Disease Control. Recommendations of the lmmunization Practices Advisory Committee. Pneumococcal Polysaccharide Vaccine. MMWR 1989; 38:64-76. 13.13 Centers for Disease Control. Update on adult immunization. Recommendations of the Immunization Practices Advisory Committee (ACIP). MMWR 1991 (RR-12): 1-93. 13.14 Consejo Nacional de Vacunación. Programa de Atención a la Salud del Niño. México: CONAVA, 1997. 13.15 Consejo Nacional de Vacunación. Programa de Vacunación Universal 1995-2000. México: CONAVA, 1995.
- 39. 13.16 Cusminsky, Itarte y Mercer. Crecimiento y Desarrollo Físico desde la Concepción hasta la Adolescencia. Buenos Aires: Editorial Universitaria, 1985 (Cuadernos de Pediatría para el Posgrado). 13.17 Cusminsky, Lejárraga. Manual de Crecimiento y Desarrollo del Niño, No. 8. Washington: OPS/OMS. 1986. 13.18 Cusminsky, Moreno y Suárez Ojeda. Crecimiento y Desarrollo. Hechos y Tendencias. Washington: OPS, 1988. (Publicación Científica: 510). 13.19 Dai Y, Foy HM, Zhu PZ et. al. Respiratory rate and signs in roetgenographycally confirmed pneumoniae among children in China. Pediatr. Infect. Dis. J. 1995; 14:48-50. 13.20 Datta N et. al. Application of case management to the control of acute lower respiratory infections in low-birth-weight infants: a feasibility study. Bull WHO. 1987; 65:77-82. 13.21 Denny FW, Clyde WA Jr. Acute lower respiratory tract infections in nonhospitalized children. J. Pediatr. 1986; 108:635-646 (SUP-1). 13.22 Galazka AM, Lauer BA, Henderson H, Keja J. Indications and contraindications for vaccines used in the Expanded Programme on Immunization. Bull WHO 1981; 62:357-366. 13.23 Gómez Barreto D., "Vacuna contra la parotiditis". En: Escobar Gutiérrez A, Valdespino Gómez JL y Sepúlveda Amor J. Vacunas, Ciencia y Salud. México: Secretaría de Salud, 1992 pp. 225- 229. 13.24 Grossman LK, Caplan JE. Clinical, laboratory, and radiological information in the diagnosis of pneumonia in children. Ann Emerg Med. 1988; 17:43-46. 13.25 Guiscafré H. et. al. Autopsia verbal en niños con infección respiratoria y diarrea aguda. Análisis del proceso enfermedad-atención-muerte. Bol. Med. Hosp. Infant. Méx. 1993; 50:7-16. 13.26 Gutiérrez G, Guiscafré H. Los errores en el tratamiento médico de padecimientos comunes. Un grave problema de salud pública. Gac. Med. Méx. 1992: 501-503. 13.27 Gutiérrez Trujillo G., "Vacunación antirrubeólica: la vacuna y las estrategias". En: Vacunas, Ciencia y Salud. México: Secretaría de Salud, 1992. pp. 217-223. 13.28 Indacochea F. and Scott G. HIV-1, lnfection and the Acquired immunity deficiency Syndrome in Children Current Problems in Pediatrics. 1992, pp. 166-204. 13.29 Instituto Mexicano del Seguro Social. Motivos de Consulta en Consultorios de Medicina Familiar. Jefatura de Medicina Preventiva, México 1982. 13.30 Krugman S, Katz SL, Gerson AA, Wilfert CM. Enfermedades infecciosas. México: Interamericana, 1988. 13.31 Kumate J, Gutiérrez G, Muñoz O, Santos Jl. Manual de Infectología Clínica. 14a. Ed. México: s.n. 1994. 13.32 Leventhal JM. Clinical predictors of pneumonia as a guide to ordering chest roentgenograms. Clin. Pediatr. 1984; 21:730-734.
- 40. 13.33 Margolis, Harold S. Prevention of Acute and Chronic Liver Disease Through Immunization: Hepatitis B and Beyond, J Infect Dis. 1993; 168. 13.34 Markowitz LE, Sepúlveda J, Díaz Ortega JL, Albrecht P, Zell E, Stewart J, Zarate AML. lmmunization of six month-old infants with different doses of Edmonston-Zagreb and Schwarz measles vaccines. N. Engl J. Med. 1990; 322:580-587. 13.35 Martínez DF, Wright LA, Taussing ML et al. Asthma and Wheezing in the first six years of live. N. Engl. J. Med. 1995; 332:133-38. 13.36 Martínez E, Marcos A. Antibiotic Associated Diarrhoea. Lancet 1991; 13:911. 13.37 Maulen Y. Safety and efficacy of rice based oral rehydratation solution in the treatment of diarrohea in infant less than 6 months of age. J. Pediatr. Gastroenterol. and Nutr. 1994; 19:78- 82. 13.38 Miller D. Investigaciones y Estrategias para el Estudio de Infecciones Respiratorias Agudas en la Infancia. Bol. OPS. 1984; 96. 13.39 Nokes DJ, Anderson RM. Vaccine safety versus vaccine efficacy in mass immunization programmes. Lancet 1991; 338:1309-1312. 13.40 Olarte J. Etiología de las Diarreas Infecciosas. Viejos y Nuevos Agentes. Bol. Méd. Hosp. Infant. Méx. 1992; 49:143-150. 13.41 Organización Mundial de la Salud. Inmunización con BCG e infección con el VIH pediátrico. Weekly Epidemiological Record. 1992; 18:129-132. 13.42 Organización Mundial de la Salud. Medición del Cambio del Estado Nutricional. Ginebra: OMS, 1983. 13.43 Organización Panamericana de la Salud. Atención del Niño con Infección Respiratoria Aguda. Washington: OPS, 1992 (Serie PALTEX para Técnicos Medios y Auxiliares: 21). 13.44 Organización Panamericana de la Salud. Bases técnicas para las recomendaciones de la OMS sobre el tratamiento de la neumonía en niños en el primer nivel de atención. Washington: OPS, 1992. (Documento técnico HPM. ARI). 13.45 Organización Panamericana de la Salud. Clasificación Estadística Internacional de Enfermedades y Problemas Relacionados con la Salud. 10a. revisión. Washington: OPS/OMS. 1995. 3 v. (Publicación científica: 554). 13.46 Organización Panamericana de la Salud. Control del Tétanos. Boletín Informativo PAl. Febrero de 1988. 13.47 Organización Panamericana de la Salud. Guía sobre Educación y Participación Comunitaria en el Control del Crecimiento y Desarrollo del Niño. Washington: OPS/OMS, 1993. 13.48 Organización Panamericana de la Salud. Importancia de la cadena fría en el almacenamiento y distribución de vacunas. Washington: OPS/OMS, 1987. 13.49 Organización Panamericana de la Salud. Infecciones Respiratorias Agudas en los Niños. Washington: OPS, 1985. (Publicación Científica: 493). 13.50 Organización Panamericana de la Salud. Infecciones respiratorias agudas en los niños. Tratamiento de casos en hospitales pequeños. Washington: OPS, 1992 (Serie PALTEX para ejecutores de programas de salud: 24).
- 41. 13.51 Organización Panamericana de la Salud. Información para la Acción. Washington: OPS/OMS, 1984. (Publicación Científica: 472). 13.52 Organización Panamericana de la Salud. Los antibióticos en el tratamiento de las infecciones respiratorias agudas en niños menores de cinco años. Washington: OPS, 1991. (Manual técnico WHO, ARI). 13.53 Organización Panamericana de la Salud. Norma de Manipulación de Frascos Abiertos de Vacunas. Boletín Informativo PAl. Agosto de 1992. 13.54 Organización Panamericana de la Salud. Programa Ampliado de Inmunizaciones. Guía práctica para la erradicación de la poliomielitis. Washington: OPS/OMS, 1987. 13.55 Organización Panamericana de la Salud. Programa Ampliado de Inmunizaciones. La cadena de frío. Hojas de información sobre productos del Programa Ampliado de Inmunizaciones. Ginebra: OPS, 1986. (Serie Técnica OMS/UNICEF). 13.56 Organización Panamericana de la Salud. Simposio Internacional sobre el Control de la Poliomielitis. Washington: OPS/OMS, 1985. (Publicación Científica: 484). 13.57 Organización Panamericana de la Salud. Simposio lnternacional sobre Inmunización contra el Sarampión. Washington: OPS/OMS, 1985. (Publicación Científica: 477). 13.58 Paradise JL. Treatment guidelines for otitis media; the need for breadth and flexibility. Pediatr. Infect Dis J. 1995; 14:429-435. 13.59 Pérez R, Cuevas J, Bojalil R, Guiscafré H: Calidad de la atención médica en niños hospitalizados por infección respiratoria aguda. Bol. Med. Hosp. Infant. Méx. 1995; 55. 13.60 Pío A, Leowski J, Luelmo F. Programa de la Organización Mundial de la Salud de Infecciones Respiratorias Agudas en la Infancia. Bol. OPS. 1984; 96. 13.61 Pizarro D. Tratamiento y prevención de la enfermedad diarreica. Bol. Med. Hosp. Infant. Méx. 1991; 48: 258-268. 13.62 Pizarro Suárez E. "Vacunas para la influenza". En: Vacunas, Ciencia y Salud. México: Secretaría de Salud, 1992. pp. 231-242. 13.63 Plotkin SA, Mortimer EA. Vaccines. 2a. ed. Estados Unidos: Saunders Philadelphia, 1994. 13.64 Poole MD. Otitis media complications and treatment failures, implications of pneumococcal resistance. Pediatr. Infect. Dis. J. 1995; 14:523-526. 13.65 Red Book., Report of the Committee on lnfections Diseases. 22a. ed. Estados Unidos: American Academy of Pediatrics, 1991. 13.66 Reunión del Grupo de Consulta sobre Crecimiento y Desarrollo del Niño. (2a: X, Agosto 16-19, 1988: Guatemala). Informe: segundo borrador. OPS/OMS, INCAP, UNICEF. 13.67 Richards L. Claeson M. Management of acute diarrhea in children: Lesson learned. Pediatr. Infect. Dis J. 1993; 12:5-9. 13.68 Ríos E, Marge S, Melnick V, Neuhauser L. Las prácticas de alimentación en las instituciones de salud en México. México: La Prensa Médica Mexicana, 1994. (Ediciones científicas).
- 42. 13.69 Santos Preciado JI, Villaseñor Sierra A. Infecciones de Vías Respiratorias Superiores 1995, México. 13.70 Secretaría de Salud. Documento de Evaluación del Estudio Piloto de IRA en Ixtlahuaca, Estado de México. México: SSA, 1981. 13.71 Secretaría de Salud. Farmacopea de los Estados Unidos Mexicanos. 6a. ed. México: SSA, 1996, pp.1502-1515. 13.72 Secretaría de Salud. Norma y Procedimientos para Programas Integrados de Control de las Infecciones Respiratorias Agudas. México: SSA, 1983. 13.73 Secretaría de Salud. Programa de Prevención y Control de las Infecciones Respiratorias Agudas. México: SSA, 1994. 13.74 Sector Salud. Cuadro Básico de Medicamentos. México: Sector Salud, 1984. 13.75 Shann F, Hart K, Thomas D. Acute lower respiratory tract infections in children: possible criteria for selection of patients for antibiotic therapy and hospital admission. Bull WHO. 1984; 62:749-753. 13.76 Shann F. Etiology of severe pneumonia in children in developing countries. Pediatric Infectious Diseases. 1986; 5:247-252. 13.77 Sistema Nacional de Salud. Norma de Procedimientos. Programa Nacional de Inmunizaciones, 1988. 13.78 Stites Daniel P., Taylor Keith B, Howard C Thomas. Inmunología Básica y Clínica. Enfermedades del Aparato Digestivo e Hígado. 5a. Ed. México: s.n., 1985. pp 540, 651, 734, 738. 13.79 Suárez Ojeda et. al. Crecimiento y Desarrollo Físico del Adolescente. Washington: OPS, 1985. p. 47. (Publicación Científica: 489). 13.80 Thompson R., Bass D., Hoffman S. M.D. New Vaccines and new vaccine technology. Infectious Diseases Clinics of Noth America. ed. W.B. Saunders Company. EUA. Philadelphia.1999;13:149-167. 13.81 Torres J. González AS, Pérez R, Muñoz O. Inappropiate Treatment in Children with bloody diarrhea: Clinical and Microbiological Studies. Arch. Med. Rev. 1995; 26:23-29. 13.82 Turner RB, et al. Pneumonia in pediatric outpatients: cause and clinical manifestations. J. Pediatr. 1987; 111:194-200. 13.83 Tyromanen IE, Austrian R and Masure HR. Pathogenesis of Pneumococcal Infection. N. Engl. J. Med. 1995; 332:1280-1283. 13.84 Vardinon N, Handsher R, Burke M, Zacut V. Yust 1., Poliovirus vaccination responses in HIV-infected patients: correlation with T4 cell counts. J. Infect. Dis. 1990; 162:238-241. 13.85 Vásquez KR, Rosales E, Santos JI. susceptibilidad de aislamientos clínicos de Streptococcus pneumoniae en un hospital pediátrico. Bol. Med. Hosp. Infant. Méx. 1996; 53:854-60. 13.86 Villaseñor SA, Herrera BE, Vázquez SP, Arroyo MJA, Santos JI. Prevalencia de portadores y susceptibles a antimicrobianos de uso común de cepas de Haemophilus
- 43. influenzae aisladas en niños sanos de ciudad Nezahualcoyotl. Bol. Med. Hosp. Infant. Méx. 1993, 50:442-443. 13.87 Wang EL, Law JB, Stephens D, et al. Prospective study of risk factors and outcomes in patients hospitalized with respiratory tract infection syncytial viral lower respiratory. J. Pediatr. 1995; 126: 212-219. 13.88 World Health Organitation. Modern vaccines: Practice in developing countries. Lancet. 1990; 335:774-777. 14. Concordancia con normas internacionales y mexicanas La presente Norma Oficial Mexicana no es equivalente con ninguna norma internacional ni mexicana. 15. Observancia de la Norma La vigilancia de la aplicación de esta Norma, corresponde a la Secretaría de Salud y a los gobiernos de las entidades federativas, en el ámbito de sus respectivas competencias. 16. Vigencia La presente Norma Oficial Mexicana entrará en vigor al día siguiente de su publicación en el Diario Oficial de la Federación. La presente Norma Oficial Mexicana suple las siguientes normas oficiales mexicanas: NOM-008-SSA2-1993, control de la nutrición. Crecimiento y desarrollo del niño y del adolescente, criterios y procedimientos para la prestación del servicio; NOM-023-SSA2-1994, para el control, eliminación y erradicación de las enfermedades evitables por vacunación, y NOM-024-SSA2-1994, para la prevención y control de las infecciones respiratorias agudas en la atención primaria a la salud. Sufragio Efectivo. No Reelección. México, D.F., a 19 de octubre de 2000.- El Presidente del Comité Consultivo Nacional de Normalización de Prevención y Control de Enfermedades, Roberto Tapia Conyer.- Rúbrica. APENDICE A TABLAS DE REFERENCIA PARA VALORAR PESO/EDAD EN NIÑAS Y NIÑOS MENORES DE 5 AÑOS TABLA 1 PESO (kg) POR EDAD 0 MESES A 4 AÑOS 11 MESES NIÑAS EDAD DESNUT. GRAVE DESNUT. MODERADA DESNUT. LEVE PESO NORMAL SOBRE PESO OBESIDAD OBESIDAD MESES -3 D.E. -2 D.E. -1 D.E. MEDIANA +1 D.E. +2 D.E. +3 D.E.
- 44. 0 1.8 2.2 2.7 3.2 3.6 4.0 4.3 1 2.2 2.8 3.4 4.0 4.5 5.1 5.6 2 2.7 3.3 4.0 4.7 5.4 6.1 6.7 3 3.2 3.9 4.7 5.4 6.2 7.0 7.7 4 3.7 4.5 5.3 6.0 6.9 7.7 8.6 5 4.1 5.0 5.8 6.7 7.5 8.4 9.3 6 4.6 5.5 6.3 7.2 8.1 9.0 10.0 7 5.0 5.9 6.8 7.7 8.7 9.6 10.5 8 5.3 6.3 7.2 8.2 9.1 10.1 11.1 9 5.7 6.6 7.6 8.6 9.6 10.5 11.5 10 5.9 6.9 7.9 8.9 9.9 10.9 11.9 11 6.2 7.2 8.2 9.2 10.3 11.3 12.3 12 6.4 7.4 8.5 9.5 10.6 11.6 12.7 13 6.6 7.6 8.7 9.8 10.8 11.9 13.0 14 6.7 7.8 8.9 10.0 11.1 12.2 13.2 15 6.9 8.0 9.1 10.2 11.3 12.4 13.5 16 7.0 8.2 9.3 10.4 11.5 12.6 13.7 17 7.2 8.3 9.5 10.6 11.8 12.9 14.0 18 7.3 8.5 9.7 10.8 12.0 13.1 14.2 19 7.5 8.6 9.8 11.0 12.2 13.3 14.5 20 7.6 8.8 10.0 11.2 12.4 13.5 14.7 21 7.7 9.0 10.2 11.4 12.6 13.8 15.0 22 7.9 9.1 10.3 11.5 12.8 14.0 15.2 23 8.0 9.3 10.5 11.7 13.0 14.2 15.5 AÑOS/MESES 2/0 8.3 9.4 10.6 11.8 13.2 14.6 16.0 2/01 8.4 9.6 10.8 12.0 13.5 14.9 16.4 2/02 8.5 9.8 11.0 12.2 13.7 15.2 16.8 2/03 8.6 9.9 11.2 12.4 14.0 15.6 17.1 2/04 8.8 10.1 11.3 12.6 14.2 15.9 17.5 2/05 8.9 10.2 11.5 12.8 14.5 16.1 17.8 2/06 9.0 10.3 11.7 13.0 14.7 16.4 18.1 2/07 9.1 10.5 11.9 13.2 15.0 16.7 18.5 2/08 9.2 10.6 12.0 13.4 15.2 17.0 18.8 2/09 9.4 10.8 12.2 13.6 15.4 17.2 19.1 2/10 9.5 10.9 12.3 13.8 15.6 17.5 19.4
- 45. 2/11 9.6 11.0 12.5 13.9 15.8 17.8 19.7 3/0 9.7 11.2 12.6 14.1 16.1 18.0 20.0 3/01 9.8 11.3 12.8 14.3 16.3 18.3 20.2 3/02 9.9 11.4 12.9 14.4 16.5 18.5 20.5 3/03 10.0 11.5 13.1 14.6 16.7 18.7 20.8 3/04 10.1 11.6 13.2 14.8 16.9 19.0 21.1 3/05 10.2 11.8 13.3 14.9 17.0 19.2 21.3 3/06 10.3 11.9 13.5 15.1 17.2 19.4 21.6 3/07 10.4 12.0 13.6 15.2 17.4 19.6 21.8 3/08 10.5 12.1 13.7 15.4 17.6 19.8 22.1 3/09 10.6 12.2 13.9 15.5 17.8 20.1 22.3 3/10 10.7 12.3 14.0 15.7 18.0 20.3 22.6 3/11 10.8 12.4 14.1 15.8 18.1 20.5 22.8 4/0 10.9 12.6 14.3 16.0 18.3 20.7 23.1 4/01 10.9 12.7 14.4 16.1 18.5 20.9 23.3 4/02 11.0 12.8 14.5 16.2 18.7 21.1 23.5 4/03 11.1 12.9 14.6 16.4 18.9 21.3 23.8 4/04 11.2 13.0 14.8 16.5 19.0 21.5 24.0 4/05 11.3 13.1 14.9 16.7 19.2 21.7 24.3 4/06 11.4 13.2 15.0 16.8 19.4 21.9 24.5 4/07 11.5 13.3 15.1 17.0 19.6 22.2 24.8 4/08 11.5 13.4 15.2 17.1 19.7 22.4 25.0 4/09 11.6 13.5 15.4 17.2 19.9 22.6 25.3 4/10 11.7 13.6 15.5 17.4 20.1 22.8 25.5 4/11 11.8 13.7 15.6 17.5 20.3 23.0 25.8 Fuente: Medición del Cambio del Estado Nutricional. OMS. Ginebra, 1983. Tomadas de NCHS. Growth curves for Children. Birth - 18 years, 1977. VIGILANCIA DE LA NUTRICION DEL MENOR DE 5 AÑOS GRAFICA DE PESO PARA LA EDAD EN NIÑOS
- 46. TABLAS DE REFERENCIA PARA VALORAR PESO/EDAD EN NIÑAS Y NIÑOS MENORES DE 5 AÑOS TABLA 2 PESO (kg) POR EDAD
- 47. 0 MESES A 4 AÑOS 11 MESES NIÑOS EDAD DESNUT. GRAVE DESNUT. MODERADA DESNUT. LEVE PESO NORMAL SOBRE PESO OBESIDAD OBESIDAD MESES -3 D.E. -2 D.E. -1 D.E. MEDIANA +1 D.E. +2 D.E. +3 D.E. 0 2.0 2.4 2.9 3.3 3.8 4.3 4.8 1 2.2 2.9 3.6 4.3 5.0 5.6 6.3 2 2.6 3.5 4.3 5.2 6.0 6.8 7.6 3 3.1 4.1 5.0 6.0 6.9 7.7 8.6 4 3.7 4.7 5.7 6.7 7.6 8.5 9.4 5 4.3 5.3 6.3 7.3 8.2 9.2 10.1 6 4.9 5.9 6.9 7.8 8.8 9.8 10.8 7 5.4 6.4 7.4 8.3 9.3 10.3 11.3 8 5.9 6.9 7.8 8.8 9.8 10.8 11.8 9 6.3 7.2 8.2 9.2 10.2 11.3 12.3 10 6.6 7.6 8.6 9.5 10.6 11.7 12.7 11 6.9 7.9 8.9 9.9 10.9 12.0 13.1 12 7.1 8.1 9.1 10.2 11.3 12.4 13.5 13 7.3 8.3 9.4 10.4 11.5 12.7 13.8 14 7.5 8.5 9.6 10.7 11.8 13.0 14.1 15 7.6 8.7 9.8 10.9 12.0 13.2 14.4 16 7.7 8.8 10.0 11.1 12.3 13.5 14.7 17 7.8 9.0 10.1 11.3 12.5 13.7 14.9 18 7.9 9.1 10.3 11.5 12.7 13.9 15.2 19 8.0 9.2 10.5 11.7 12.9 14.1 15.4 20 8.1 9.4 10.6 11.8 13.1 14.4 15.6 21 8.3 9.5 10.8 12.0 13.3 14.6 15.8 22 8.4 9.7 10.9 12.2 13.5 14.8 16.0 23 8.5 9.8 11.1 12.4 13.7 15.0 16.3 AÑOS/MESES 2/0 9.0 10.1 11.2 12.3 14.0 15.7 17.4 2/01 9.0 10.2 11.4 12.5 14.2 15.9 17.6 2/02 9.1 10.3 11.5 12.7 14.4 16.1 17.8 2/03 9.1 10.4 11.7 12.9 14.6 16.3 18.0
- 48. 2/04 9.2 10.5 11.8 13.1 14.8 16.6 18.3 2/05 9.3 10.6 12.0 13.3 15.1 16.8 18.5 2/06 9.4 10.7 12.1 13.5 15.3 17.0 18.7 2/07 9.4 10.9 12.3 13.7 15.5 17.2 19.0 2/08 9.5 11.0 12.4 13.9 15.7 17.4 19.2 2/09 9.6 11.1 12.6 14.1 15.9 17.6 19.4 2/10 9.7 11.2 12.7 14.3 16.0 17.8 19.6 2/11 9.7 11.3 12.9 14.4 16.2 18.0 19.8 3/0 9.8 11.4 13.0 14.6 16.4 18.3 20.1 3/01 9.9 11.5 13.2 14.8 16.6 18.5 20.3 3/02 10.0 11.7 13.3 15.0 16.8 18.7 20.5 3/03 10.1 11.8 13.5 15.2 17.0 18.9 20.7 3/04 10.2 11.9 13.6 15.3 17.2 19.1 21.0 3/05 10.3 12.0 13.8 15.5 17.4 19.3 21.2 3/06 10.4 12.1 13.9 15.7 17.6 19.5 21.4 3/07 10.5 12.3 14.1 15.8 17.8 19.7 21.7 3/08 10.6 12.4 14.2 16.0 18.0 19.9 21.9 3/09 10.7 12.5 14.4 16.2 18.2 20.1 22.1 3/10 10.8 12.6 14.5 16.4 18.4 20.4 22.4 3/11 10.9 12.8 14.6 16.5 18.6 20.6 22.6 4/0 11.0 12.9 14.8 16.7 18.7 20.8 22.8 4/01 11.1 13.0 14.9 16.9 18.9 21.0 23.1 4/02 11.2 13.1 15.1 17.0 19.1 21.2 23.3 4/03 11.3 13.3 15.2 17.2 19.3 21.4 23.6 4/04 11.4 13.4 15.4 17.4 19.5 21.7 23.8 4/05 11.5 13.5 15.5 17.5 19.7 21.9 24.1 4/06 11.6 13.7 15.7 17.7 19.9 22.1 24.3 4/07 11.8 13.8 15.8 17.9 20.1 22.3 24.6 4/08 11.9 13.9 16.0 18.0 20.3 22.6 24.8 4/09 12.0 14.0 16.1 18.2 20.5 22.8 25.1 4/10 12.1 14.2 16.3 18.3 20.7 23.0 25.4 4/11 12.2 14.3 16.4 18.5 20.9 23.3 25.6 Fuente: Medición del Cambio del Estado Nutricional. OMS. Ginebra, 1983. Tomadas de NCHS. Growth curves for Children. Birth - 18 years, 1977.
- 49. VIGILANCIA DE LA NUTRICION DEL MENOR DE 5 AÑOS GRAFICA DE PESO PARA LA EDAD EN NIÑOS APENDICE B TABLAS DE REFERENCIA PARA VALORAR TALLA/EDAD EN NIÑAS Y NIÑOS MENORES DE 5 AÑOS TABLA 1
- 50. TALLA (cm) POR EDAD 0 MESES A 4 AÑOS 11 MESES NIÑAS EDAD -3 D.E. -2 D.E. -1 D.E. MEDIANA +1 D.E. +2 D.E. +3 D.E. MESES 0 43.4 45.5 47.7 49.9 52.0 54.2 56.4 1 46.7 49.0 51.2 53.5 55.8 58.1 60.4 2 49.6 52.0 54.4 56.8 59.2 61.6 64.0 3 52.1 54.6 57.1 59.5 62.0 64.5 67.0 4 54.3 56.9 59.4 62.0 64.5 67.1 69.6 5 56.3 58.9 61.5 64.1 66.7 69.3 71.9 6 58.0 60.6 63.3 65.9 68.6 71.2 73.9 7 59.5 62.2 64.9 67.6 70.2 72.9 75.6 8 60.9 63.7 66.4 69.1 71.3 74.5 77.2 9 62.2 65.0 67.7 70.4 73.2 75.9 78.7 10 63.5 66.2 69.0 71.8 74.5 77.3 80.1 11 64.7 67.5 70.3 73.1 75.9 78.8 81.5 12 65.8 68.6 71.5 74.3 77.1 80.0 82.8 13 66.9 69.8 72.6 75.5 78.4 81.2 84.1 14 67.9 70.8 73.7 76.7 79.6 82.5 85.4 15 68.9 71.9 74.8 77.8 80.7 83.7 86.6 16 69.9 72.9 75.9 78.9 81.8 84.3 87.8 17 70.8 73.8 76.9 79.9 82.9 86.0 89.0 18 71.7 74.8 77.9 80.9 84.0 87.1 90.1 19 72.6 75.7 78.8 81.9 85.0 88.1 91.2 20 73.4 76.6 79.7 82.9 86.0 89.2 92.3 21 74.3 77.4 80.6 83.8 87.0 90.2 93.4 22 75.1 78.3 81.5 84.7 87.9 91.1 94.4 23 75.9 79.1 82.4 85.6 88.9 92.1 95.3 AÑOS/MESES 2/0 74.9 78.1 81.3 84.5 87.7 90.9 94.1 2/01 75.6 78.8 82.1 85.4 88.6 91.9 95.1 2/02 76.3 79.6 82.9 86.2 89.5 92.8 96.2 2/03 77.0 80.3 83.7 87.0 90.4 93.8 97.1 2/04 77.6 81.0 84.5 87.9 91.3 94.7 98.1
- 51. 2/05 78.3 81.8 85.2 88.7 92.1 95.6 99.0 2/06 79.0 82.5 86.0 89.5 93.0 96.5 100.0 2/07 79.6 83.2 86.7 90.2 93.8 97.3 100.9 2/08 80.3 83.8 87.4 91.0 94.6 98.2 101.7 2/09 80.9 84.5 88.1 91.7 95.4 99.0 102.6 2/10 81.5 85.2 88.8 92.5 96.1 99.8 103.4 2/11 82.1 85.8 89.5 93.2 96.9 100.6 104.3 3/0 82.8 86.5 90.2 93.9 97.6 101.4 105.1 3/01 83.4 87.1 90.9 94.6 98.4 102.1 105.9 3/02 84.0 87.7 91.5 95.3 99.1 102.9 106.6 3/03 84.5 88.4 92.2 96.0 99.8 103.6 107.4 3/04 85.1 89.0 92.8 96.6 100.5 104.3 108.2 3/05 85.7 89.6 93.4 97.3 101.2 105.0 108.9 3/06 86.3 90.2 94.0 97.9 101.8 105.7 109.6 3/07 86.8 90.7 94.7 98.6 102.5 106.4 110.3 3/08 87.4 91.3 95.3 99.2 103.1 107.1 111.0 3/09 87.9 91.9 95.8 99.8 103.8 107.8 111.7 3/10 88.4 92.4 96.4 100.4 104.4 108.4 112.4 3/11 89.0 93.0 97.0 101.0 105.1 109.1 113.1 4/0 89.5 93.5 97.6 101.6 105.7 109.7 113.8 4/01 90.0 94.1 98.1 102.2 106.3 110.4 114.4 4/02 90.5 94.6 98.7 102.8 106.9 111.0 115.1 4/03 91.0 95.1 99.3 103.4 107.5 111.6 115.8 4/04 91.5 95.6 99.8 104.0 108.1 112.3 116.4 4/05 92.0 96.1 100.3 104.5 108.7 112.9 117.1 4/06 92.4 96.7 100.9 105.1 109.3 113.5 117.7 4/07 92.9 97.1 101.4 105.6 109.9 114.1 118.4 4/08 93.4 97.6 101.9 106.2 110.5 114.8 119.0 4/09 93.8 98.1 102.4 106.7 111.1 115.4 119.7 4/10 94.3 98.6 102.9 107.3 111.6 116.0 120.3 4/11 94.7 99.1 103.5 107.8 112.2 116.6 121.0 Fuente: Medición del Cambio del Estado Nutricional. OMS. Ginebra, 1983. Tomadas de NCHS.Growth curves for Children. Birth - 18 years, 1977. APENDICE B TABLAS DE REFERENCIA PARA VALORAR TALLA/EDAD EN NIÑAS Y NIÑOS MENORES DE 5 AÑOS TABLA 2
- 52. TALLA (cm) POR EDAD 0 MESES A 4 AÑOS 11 MESES NIÑOS EDAD -3 D.E. -2 D.E. -1 D.E. MEDIANA +1 D.E. +2 D.E. +3 D.E. MESES 0 43.6 45.9 48.2 50.5 52.8 55.1 57.4 1 47.2 49.7 52.1 54.6 57.0 59.5 61.9 2 50.4 52.9 55.5 58.1 60.7 63.2 65.8 3 53.2 55.8 58.5 61.1 63.7 66.4 69.0 4 55.6 58.3 61.0 63.7 66.4 69.1 71.7 5 57.8 60.5 63.2 65.9 68.6 71.3 74.0 6 59.8 62.4 65.1 67.8 70.5 73.2 75.9 7 61.5 64.1 66.8 69.5 72.2 74.8 77.5 8 63.0 65.7 68.3 71.0 73.6 76.3 78.9 9 64.0 67.0 69.7 72.3 75.0 77.6 80.3 10 65.7 68.3 71.0 73.6 76.3 78.9 81.6 11 66.9 69.6 72.2 74.9 77.5 80.2 82.9 12 68.0 70.7 73.4 76.1 78.8 81.5 84.2 13 69.0 71.8 74.5 77.2 80.0 82.7 85.5 14 70.0 72.8 75.6 78.3 81.1 83.9 86.7 15 70.9 73.7 76.6 79.4 82.3 85.1 88.0 16 71.7 74.6 77.5 80.4 83.4 86.3 89.2 17 72.5 75.5 78.5 81.4 84.4 87.4 90.4 18 73.3 76.3 79.4 82.4 85.4 88.5 91.5 19 74.0 77.1 80.2 83.3 86.4 89.5 92.7 20 74.7 77.9 81.1 84.2 87.4 90.6 93.8 21 75.4 78.7 81.9 85.1 88.4 91.6 94.8 22 76.1 79.4 82.7 86.0 89.3 92.5 95.8 23 76.8 80.2 83.5 86.8 90.2 93.5 96.8 AÑOS/MESES 2/0 76.0 79.2 82.4 85.6 88.8 92.0 95.2 2/01 76.7 79.9 83.2 86.4 89.7 92.9 96.2 2/02 77.3 80.6 83.9 87.2 90.6 93.9 97.2 2/03 78.0 81.3 84.7 88.1 91.4 94.8 98.1 2/04 78.6 82.0 85.4 88.9 92.3 95.7 99.1
- 53. 2/05 79.2 82.7 86.2 89.7 93.1 96.6 100.1 2/06 79.9 83.4 86.9 90.4 94.0 97.5 101.0 2/07 80.5 84.1 87.6 91.2 94.8 98.3 101.9 2/08 81.1 84.7 88.3 92.0 95.6 99.2 102.8 2/09 81.7 85.4 89.0 92.7 96.4 100.1 103.7 2/10 82.3 86.0 89.7 93.5 97.2 100.9 104.6 2/11 82.9 86.7 90.4 94.2 98.0 101.7 105.5 3/0 83.5 87.3 91.1 94.9 98.7 102.5 106.3 3/01 84.1 87.9 91.8 95.6 99.5 103.0 107.2 3/02 84.7 88.6 92.4 96.3 100.2 104.1 108.0 3/03 85.2 89.2 93.1 97.0 101.0 104.9 108.8 3/04 85.8 89.8 93.8 97.7 101.7 105.7 109.7 3/05 86.4 90.4 94.4 98.4 102.4 106.4 110.5 3/06 86.9 91.0 95.0 99.1 103.1 107.2 111.2 3/07 87.5 91.6 95.7 99.7 103.8 107.9 112.0 3/08 88.0 92.1 96.3 100.4 104.5 108.7 112.8 3/09 88.6 92.7 96.9 101.0 105.2 109.4 113.5 3/10 89.1 93.3 97.5 101.7 105.9 110.1 114.3 3/11 89.6 93.9 98.1 102.3 106.6 110.8 115.0 4/0 90.2 94.4 98.7 102.9 107.2 111.5 115.7 4/01 90.7 95.0 99.3 103.6 107.9 112.2 116.5 4/02 91.2 95.5 99.9 104.2 108.5 112.8 117.2 4/03 91.7 96.1 100.4 104.8 109.1 113.5 117.8 4/04 92.2 96.6 101.0 105.4 109.8 114.2 118.5 4/05 92.7 97.1 101.6 106.0 110.4 114.8 119.2 4/06 93.2 97.7 102.1 106.6 111.0 115.4 119.9 4/07 93.7 98.2 102.7 107.1 111.6 116.1 120.5 4/08 94.2 98.7 103.2 107.7 112.2 116.7 121.2 4/09 94.7 99.2 103.7 108.3 112.8 117.3 121.8 4/10 95.2 99.7 104.3 108.8 113.4 117.9 122.5 4/11 95.7 100.2 104.8 109.4 114.0 118.5 123.1 Fuente: Medición del Cambio del Estado Nutricional. OMS. Ginebra, 1983. Tomadas de NCHS. Growth curves for Children. Birth - 18 years, 1977. APENDICE C TABLAS DE REFERENCIA PARA VALORAR PESO/TALLA EN NIÑAS Y NIÑOS TABLA 1
- 54. PESO (kg) POR LONGITUD (cm) 50 cm A 100 cm NIÑAS LONGITUD -3 D.E. -2 D.E. -1 D.E. MEDIANA +1 D.E. +2 D.E. +3 D.E. cm 50 2.3 2.6 3.0 3.4 3.8 4.2 4.6 51 2.3 2.7 3.1 3.5 4.0 4.4 4.9 52 2.4 2.8 3.3 3.7 4.2 4.7 5.1 53 2.5 3.0 3.4 3.9 4.4 4.9 5.4 54 2.7 3.1 3.6 4.1 4.6 5.2 5.7 55 2.8 3.3 3.8 4.3 4.9 5.5 6.0 56 3.0 3.5 4.0 4.5 5.1 5.7 6.3 57 3.1 3.7 4.2 4.8 5.4 6.0 6.6 58 3.3 3.9 4.4 5.0 5.7 6.3 7.0 59 3.5 4.1 4.7 5.3 5.9 6.6 7.3 60 3.7 4.3 4.9 5.5 6.2 6.9 7.6 61 3.9 4.6 5.2 5.8 6.5 7.2 7.9 62 4.1 4.8 5.4 6.1 6.8 7.5 8.2 63 4.4 5.0 5.7 6.4 7.1 7.8 8.5 64 4.6 5.3 6.0 6.7 7.4 8.1 8.9 65 4.8 5.5 6.3 7.0 7.7 8.4 9.2 66 5.1 5.8 6.5 7.3 8.0 8.7 9.5 67 5.3 6.0 6.8 7.5 8.3 9.0 9.8 68 5.5 6.3 7.1 7.8 8.6 9.3 10.1 69 5.8 6.5 7.3 8.1 8.9 9.6 10.4 70 6.0 6.8 7.6 8.4 9.1 9.9 10.7 71 6.2 7.0 7.8 8.6 9.4 10.2 11.0 72 6.4 7.2 8.1 8.9 9.7 10.5 11.2 73 6.6 7.5 8.3 9.1 9.9 10.7 11.5 74 6.8 7.7 8.5 9.4 10.2 11.0 11.8 75 7.0 7.9 8.7 9.6 10.4 11.2 12.0 76 7.2 8.1 8.9 9.8 10.6 11.4 12.3 77 7.4 8.3 9.1 10.0 10.8 11.7 12.5 78 7.6 8.5 9.3 10.2 11.1 11.9 12.7
- 55. 79 7.8 8.7 9.5 10.4 11.3 12.1 13.0 80 8.0 8.8 9.7 10.6 11.5 12.3 13.2 81 8.1 9.0 9.9 10.8 11.7 12.6 13.4 82 8.3 9.2 10.1 11.0 11.9 12.8 13.7 83 8.5 9.4 10.3 11.2 12.1 13.0 13.9 84 8.7 9.6 10.5 11.4 12.3 13.2 14.1 85 8.8 9.7 10.6 11.6 12.5 13.4 14.3 86 9.0 9.9 10.8 11.8 12.7 13.6 14.6 87 9.2 10.1 11.0 11.9 12.9 13.9 14.8 88 9.4 10.3 11.2 12.2 13.1 14.1 15.0 89 9.5 10.5 11.4 12.4 13.3 14.3 15.3 90 9.7 10.7 11.6 12.6 13.6 14.5 15.5 91 9.9 10.9 11.8 12.8 13.8 14.8 15.8 92 10.1 11.1 12.1 13.0 14.0 15.0 16.0 93 10.3 11.3 12.3 13.3 14.3 15.3 16.3 94 10.5 11.5 12.5 13.5 14.5 15.6 16.6 95 10.7 11.8 12.8 13.8 14.8 15.9 16.9 96 11.0 12.0 13.0 14.0 15.1 16.1 17.2 97 11.2 12.2 13.3 14.3 15.4 16.5 17.5 98 11.5 12.5 13.5 14.6 15.7 16.8 17.9 99 11.7 12.8 13.8 14.9 16.0 17.1 18.2 100 12.0 13.1 14.1 15.2 16.3 17.4 18.6 Fuente: Medición del Cambio del Estado Nutricional. OMS. Ginebra, 1983. Tomadas de NCHS. Growth curves for Children. Birth - 18 years, 1977. TABLAS DE REFERENCIA PARA VALORAR PESO/TALLA EN NIÑAS Y NIÑOS TABLA 1 PESO (kg) POR TALLA (cm) 55 cm A 135 cm NIÑAS TALLA -3 D.E. -2 D.E. -1 D.E. MEDIANA +1 D.E. +2 D.E. +3 D.E. cm 55 2.3 3.0 3.6 4.3 5.5 6.7 7.9 56 2.5 3.2 3.9 4.7 5.9 7.1 8.3
- 56. 57 2.7 3.5 4.2 5.0 6.2 7.4 8.6 58 3.0 3.8 4.5 5.3 6.6 7.8 9.0 59 3.2 4.0 4.8 5.7 6.9 8.1 9.3 60 3.4 4.3 5.1 6.0 7.2 8.4 9.6 61 3.6 4.5 5.4 6.3 7.5 8.7 9.9 62 3.9 4.8 5.7 6.6 7.8 9.0 10.2 63 4.1 5.0 5.9 6.9 8.1 9.3 10.5 64 4.3 5.2 6.2 7.1 8.4 9.6 10.8 65 4.5 5.5 6.4 7.4 8.6 9.8 11.1 66 4.7 5.7 6.7 7.7 8.9 10.1 11.3 67 5.0 5.9 6.9 7.9 9.1 10.4 11.6 68 5.2 6.2 7.2 8.2 9.4 10.6 11.9 69 5.4 6.4 7.4 8.4 9.6 10.9 12.1 70 5.6 6.6 7.6 8.6 9.9 11.1 12.4 71 5.8 6.8 7.9 8.9 10.1 11.4 12.6 72 6.0 7.1 8.1 9.1 10.3 11.6 12.8 73 6.2 7.3 8.3 9.3 10.6 11.8 13.1 74 6.5 7.5 8.5 9.5 10.8 12.1 13.3 75 6.7 7.7 8.7 9.7 11.0 12.3 13.6 76 6.9 7.9 8.9 10.0 11.2 12.5 13.8 77 7.1 8.1 9.1 10.2 11.5 12.7 14.0 78 7.3 8.3 9.3 10.4 11.7 13.0 14.3 79 7.5 8.5 9.5 10.6 11.9 13.2 14.5 80 7.7 8.7 9.8 10.8 12.1 13.4 14.7 81 7.9 8.9 10.0 11.0 12.3 13.6 15.0 82 8.1 9.1 10.2 11.2 12.5 13.9 15.2 83 8.3 9.3 10.4 11.4 12.8 14.1 15.4 84 8.4 9.5 10.6 11.6 13.0 14.3 15.7 85 8.6 9.7 10.8 11.8 13.2 14.6 15.9 86 8.8 9.9 11.0 12.0 13.4 14.8 16.2 87 9.0 10.1 11.2 12.3 13.7 15.1 16.4 88 9.2 10.3 11.4 12.5 13.9 15.3 16.7 89 9.3 10.5 11.6 12.7 14.1 15.6 17.0 90 9.5 10.7 11.8 12.9 14.4 15.8 17.3 91 9.7 10.8 12.0 13.2 14.6 16.1 17.5 92 9.9 11.0 12.2 13.4 14.9 16.3 17.8
- 57. 93 10.0 11.2 12.4 13.6 15.1 16.6 18.1 94 10.2 11.4 12.6 13.9 15.4 16.9 18.4 95 10.4 11.6 12.9 14.1 15.6 17.2 18.7 96 10.6 11.8 13.1 14.3 15.9 17.5 19.0 97 10.7 12.0 13.3 14.6 16.2 17.8 19.3 98 10.9 12.2 13.5 14.9 16.5 18.1 19.7 99 11.1 12.4 13.8 15.1 16.7 18.4 20.0 100 11.3 12.7 14.0 15.4 17.0 18.7 20.3 101 11.5 12.9 14.3 15.6 17.3 19.0 20.7 102 11.7 13.1 14.5 15.9 17.6 19.3 21.0 103 11.9 13.3 14.7 16.2 17.9 19.6 21.4 104 12.1 13.5 15.0 16.5 18.2 20.0 21.7 105 12.3 13.8 15.3 16.7 18.5 20.3 22.1 106 12.5 14.0 15.5 17.0 18.9 20.7 22.5 107 12.7 14.3 15.8 17.3 19.2 21.0 22.9 108 13.0 14.5 16.1 17.6 19.5 21.4 23.3 109 13.2 14.8 16.4 17.9 19.8 21.8 23.7 110 13.4 15.0 16.6 18.2 20.2 22.2 24.1 111 13.7 15.3 16.9 18.6 20.6 22.6 24.6 112 14.0 15.6 17.2 18.9 20.9 23.0 25.0 113 14.2 15.9 17.5 19.2 21.3 23.4 25.5 114 14.5 16.2 17.9 19.5 21.7 23.8 26.0 115 14.8 16.5 18.2 19.9 22.1 24.3 26.5 116 15.0 16.8 18.5 20.3 22.5 24.8 27.0 117 15.3 17.1 18.9 20.6 23.0 25.3 27.6 118 15.6 17.4 19.2 21.0 23.4 25.8 28.2 119 15.9 17.7 19.6 21.4 23.9 26.4 28.9 120 16.2 18.1 20.0 21.8 24.4 27.0 29.6 121 16.5 18.4 20.3 22.2 24.9 27.6 30.3 122 16.8 18.8 20.7 22.7 25.5 28.3 31.1 123 17.1 19.1 21.1 23.1 26.1 29.0 31.9 124 17.4 19.5 21.6 23.6 26.7 29.7 32.8 125 17.8 19.9 22.0 24.1 27.3 30.5 33.7 126 18.1 20.2 22.4 24.6 28.0 31.3 34.7 127 18.4 20.6 22.9 25.1 28.6 32.2 35.7 128 18.7 21.0 23.3 25.7 29.4 33.1 36.8
- 58. 129 19.0 21.4 23.8 26.2 30.1 34.0 37.9 130 19.4 21.8 24.3 26.8 30.9 35.1 39.2 131 19.7 22.3 24.8 27.4 31.8 36.1 40.5 132 20.0 22.7 25.4 28.0 32.6 37.2 41.8 133 20.4 23.1 25.9 28.7 33.6 38.4 43.3 134 20.7 23.6 26.5 29.4 34.5 39.7 44.8 135 21.0 24.0 27.0 30.1 35.5 41.0 46.4 Fuente: Medición del Cambio del Estado Nutricional. OMS. Ginebra, 1983. Tomadas de NCHS. Growth curves for Children. Birth - 18 years, 1977. TABLAS DE REFERENCIA PARA VALORAR PESO/TALLA EN NIÑAS Y NIÑOS TABLA 2 PESO (kg) POR LONGITUD (cm) 50 cm A 100 cm NIÑOS LONGITUD -3 D.E. -2 D.E. -1 D.E. MEDIANA +1 D.E. +2 D.E. +3 D.E. cm 50 2.2 2.5 2.9 3.3 3.8 4.4 4.9 51 2.2 2.6 3.1 3.5 4.0 4.6 5.1 52 2.3 2.8 3.2 3.7 4.2 4.8 5.4 53 2.4 2.9 3.4 3.9 4.5 5.0 5.6 54 2.6 3.1 3.6 4.1 4.7 5.3 5.9 55 2.7 3.3 3.8 4.3 5.0 5.6 6.2 56 2.9 3.5 4.0 4.6 5.2 5.9 6.5 57 3.1 3.7 4.3 4.8 5.5 6.1 6.8 58 3.3 3.9 4.5 5.1 5.8 6.4 7.1 59 3.5 4.1 4.8 5.4 6.1 6.7 7.4 60 3.7 4.4 5.0 5.7 6.4 7.1 7.8 61 4.0 4.6 5.3 5.9 6.7 7.4 8.1 62 4.2 4.9 5.6 6.2 7.0 7.7 8.4 63 4.5 5.2 5.8 6.5 7.3 8.0 8.8 64 4.7 5.4 6.1 6.8 7.6 8.3 9.1 65 5.0 5.7 6.4 7.1 7.9 8.7 9.4 66 5.3 6.0 6.7 7.4 8.2 9.0 9.8 67 5.5 6.2 7.0 7.7 8.5 9.3 10.1
- 59. 68 5.8 6.5 7.3 8.0 8.8 9.6 10.4 69 6.0 6.8 7.5 8.3 9.1 9.9 10.7 70 6.3 7.0 7.8 8.5 9.4 10.2 11.1 71 6.5 7.3 8.1 8.8 9.7 10.5 11.4 72 6.8 7.5 8.3 9.1 9.9 10.8 11.7 73 7.0 7.8 8.6 9.3 10.2 11.1 12.0 74 7.2 8.0 8.8 9.6 10.5 11.4 12.3 75 7.4 8.2 9.0 9.8 10.7 11.6 12.5 76 7.6 8.4 9.2 10.0 11.0 11.9 12.8 77 7.8 8.6 9.4 10.3 11.2 12.1 13.1 78 8.0 8.8 9.7 10.5 11.4 12.4 13.3 79 8.2 9.0 9.9 10.7 11.7 12.6 13.6 80 8.3 9.2 10.1 10.9 11.9 12.9 13.8 81 8.5 9.4 10.2 11.1 12.1 13.1 14.1 82 8.7 9.6 10.4 11.3 12.3 13.3 14.3 83 8.8 9.7 10.6 11.5 12.5 13.5 14.6 84 9.0 9.9 10.8 11.7 12.8 13.8 14.8 85 9.2 10.1 11.0 11.9 13.0 14.0 15.0 86 9.3 10.3 11.2 12.1 13.2 14.2 15.3 87 9.5 10.5 11.4 12.3 13.4 14.4 15.5 88 9.7 10.6 11.6 12.5 13.6 14.7 15.7 89 9.9 10.8 11.8 12.8 13.8 14.9 16.0 90 10.0 11.0 12.0 13.0 14.0 15.1 16.2 91 10.2 11.2 12.2 13.2 14.3 15.3 16.4 92 10.4 11.4 12.4 13.4 14.5 15.6 16.7 93 10.6 11.6 12.6 13.7 14.7 15.8 16.9 94 10.8 11.9 12.9 13.9 15.0 16.1 17.1 95 11.0 12.1 13.1 14.1 15.2 16.3 17.4 96 11.3 12.3 13.3 14.4 15.5 16.6 17.7 97 11.5 12.5 13.6 14.7 15.7 16.8 17.9 98 11.7 12.8 13.9 14.9 16.0 17.1 18.2 99 11.9 13.0 14.1 15.2 16.3 17.4 18.5 100 12.1 13.3 14.4 15.5 16.6 17.7 18.8 Fuente: Medición del Cambio del Estado Nutricional. OMS. Ginebra, 1983. Tomadas de NCHS. Growth curves for Children. Birth - 18 years, 1977.
- 60. TABLAS DE REFERENCIA PARA VALORAR PESO/TALLA EN NIÑAS Y NIÑOS TABLA 2 PESO (kg) POR TALLA (cm) 55 cm A 145 cm NIÑOS TALLA -3 D.E. -2 D.E. -1 D.E. MEDIANA +1 D.E. +2 D.E. +3 D.E. Cm 55 2.0 2.8 3.6 4.3 5.5 6.7 7.9 56 2.3 3.1 3.9 4.7 5.9 7.1 8.3 57 2.6 3.4 4.2 5.0 6.2 7.4 8.6 58 2.8 3.7 4.5 5.4 6.6 7.8 9.0 59 3.1 4.0 4.8 5.7 6.9 8.1 9.3 60 3.4 4.3 5.1 6.0 7.2 8.4 9.6 61 3.6 4.5 5.4 6.3 7.5 8.7 9.9 62 3.9 4.8 5.7 6.6 7.8 9.0 10.2 63 4.1 5.1 6.0 6.9 8.1 9.3 10.6 64 4.4 5.3 6.3 7.2 8.4 9.6 10.9 65 4.6 5.6 6.5 7.5 8.7 9.9 11.2 66 4.9 5.8 6.8 7.7 9.0 10.2 11.5 67 5.1 6.1 7.0 8.0 9.3 10.5 11.8 68 5.3 6.3 7.3 8.3 9.5 10.8 12.1 69 5.6 6.6 7.5 8.5 9.8 11.1 12.4 70 5.8 6.8 7.8 8.8 10.1 11.4 12.7 71 6.0 7.0 8.0 9.0 10.3 11.6 12.9 72 6.3 7.2 8.2 9.2 10.6 11.9 13.2 73 6.5 7.5 8.5 9.5 10.8 12.1 13.5 74 6.5 7.7 8.7 9.7 11.0 12.4 13.8 75 6.9 7.9 8.9 9.9 11.3 12.7 14.0 76 7.1 8.1 9.1 10.1 11.5 12.9 14.3 77 7.3 8.3 9.3 10.4 11.8 13.2 14.5 78 7.5 8.5 9.6 10.6 12.0 13.4 14.8 79 7.7 8.7 9.8 10.8 12.2 13.6 15.1 80 7.9 8.9 10.0 11.0 12.4 13.9 15.3 81 8.1 9.1 10.2 11.2 12.7 14.1 15.5
- 61. 82 8.3 9.3 10.4 11.5 12.9 14.3 15.8 83 8.5 9.5 10.6 11.7 13.1 14.6 16.0 84 8.7 9.7 10.8 11.9 13.3 14.8 16.2 85 8.9 9.9 11.0 12.1 13.6 15.0 16.5 86 9.0 10.1 11.2 12.3 13.8 15.3 16.7 87 9.2 10.3 11.5 12.6 14.0 15.5 16.9 88 9.4 10.5 11.7 12.8 14.3 15.7 17.2 89 9.6 10.7 11.9 13.8 14.5 16.0 17.4 90 9.8 10.9 12.1 13.3 14.7 16.2 17.6 91 9.9 11.1 12.3 13.5 15.0 16.4 17.9 92 10.1 11.3 12.5 13.7 15.2 16.7 18.1 93 10.3 11.5 12.8 14.0 15.4 16.9 18.4 94 10.5 11.7 13.0 14.2 15.7 17.2 18.6 95 10.7 11.9 13.2 14.5 15.9 17.4 18.9 96 10.9 12.1 13.4 14.7 16.2 17.7 19.2 97 11.0 12.4 13.7 15.0 16.5 17.9 19.4 98 11.2 12.6 13.9 15.2 16.7 18.2 19.7 99 11.4 12.8 14.1 15.5 17.0 18.5 20.0 100 11.6 13.0 14.4 15.7 17.3 18.8 20.3 101 11.8 13.2 14.6 16.0 17.5 19.1 20.6 102 12.0 13.4 14.9 16.3 17.8 19.4 20.9 103 12.2 13.7 15.1 16.6 18.1 19.7 21.3 104 12.4 13.9 15.4 16.9 18.4 20.0 21.6 105 12.7 14.2 15.6 17.1 18.8 20.4 22.0 106 12.9 14.4 15.9 17.4 19.1 20.7 22.4 107 13.1 14.7 16.2 17.7 19.4 21.1 22.7 108 13.4 14.9 16.5 18.0 19.7 21.4 23.1 109 13.6 15.2 16.8 18.3 20.1 21.8 23.6 110 13.8 15.4 17.1 18.7 20.4 22.2 24.0 111 14.1 15.7 17.4 19.0 20.8 22.6 24.5 112 14.4 16.0 17.7 19.3 21.2 23.1 24.9 113 14.6 16.3 18.0 19.6 21.6 23.5 25.4 114 14.9 16.6 18.3 20.0 22.0 24.0 25.9 115 15.2 16.9 18.6 20.3 22.4 24.4 26.5 116 15.5 17.2 18.9 20.7 22.8 24.9 27.0 117 15.8 17.5 19.3 21.1 23.2 25.4 27.6
- 62. 118 16.1 17.9 19.6 21.4 23.7 26.0 28.2 119 16.4 18.2 20.0 21.8 24.2 26.5 28.8 120 16.7 18.5 20.4 22.2 24.6 27.1 29.5 121 17.0 18.9 28.7 22.6 25.1 27.6 30.2 122 17.4 19.2 21.1 23.0 25.6 28.3 30.9 123 17.7 19.6 21.5 23.4 26.2 28.9 31.6 124 18.0 20.0 21.9 23.9 26.7 29.5 32.4 125 18.4 20.4 22.3 24.3 27.2 30.2 33.1 126 18.7 20.7 22.8 24.8 27.8 30.9 33.9 127 19.1 21.1 23.2 25.2 28.4 31.6 34.8 128 19.4 21.5 23.6 25.7 29.0 32.3 35.6 129 19.8 21.9 24.1 26.2 29.7 33.1 36.5 130 20.1 22.3 24.5 26.8 30.3 33.9 37.5 131 20.4 22.7 25.0 27.3 31.0 34.7 38.4 132 20.8 23.1 25.5 27.8 31.7 35.5 39.4 133 21.1 23.6 26.0 28.4 32.4 36.4 40.4 134 21.5 24.0 26.5 29.0 33.2 37.3 41.5 135 21.8 24.4 27.0 29.6 33.9 38.2 42.5 136 22.1 24.8 27.5 30.2 34.7 39.2 43.7 137 22.4 25.3 28.1 30.9 35.5 40.2 44.8 138 22.8 25.7 28.6 31.6 36.4 41.2 46.0 139 23.1 26.1 29.2 32.3 37.2 42.2 47.2 140 23.4 26.6 29.8 33.0 38.1 43.3 48.5 141 23.7 27.0 30.4 33.7 39.1 44.4 49.8 142 24.0 27.5 31.0 34.5 40.0 45.6 51.1 143 24.2 27.9 31.6 35.2 41.0 46.7 52.5 144 24.5 28.4 32.2 36.1 42.0 48.0 53.9 145 24.8 28.8 32.8 36.9 43.0 49.2 55.4 Fuente: Medición del Cambio del Estado Nutricional. OMS. Ginebra, 1983. Tomadas de NCHS. Growth curves for Children. Birth - 18 years, 1977. APENDICE D VALORACION DE LA NUTRICION Y EL CRECIMIENTO DEL NIÑO MENOR DE UN AÑO Y DE UNO A CUATRO AÑOS Una vez comparados los índices antropométricos de peso para la edad, talla para la edad y peso para la talla con las tablas de referencia recomendadas (OMS), el niño se debe clasificar según los cuadros siguientes, considerando los síntomas y signos clínicos del niño.
- 63. Cuadro 1 PESO POR EDAD Desviaciones estándar con Indicador relación a la mediana Peso / Edad + 2 a + 3 Obesidad + 1 a + 1.99 Sobrepeso más-menos 1 Peso normal - 1 a - 1.99 Desnutrición leve - 2 a - 2.99 Desnutrición moderada - 3 y menos Desnutrición grave Cuadro 2 TALLA EN RELACION CON LA EDAD Desviaciones estándar con Indicador relación a la mediana Talla / Edad + 2 a + 3 Alta + 1 a + 1.99 Ligeramente alta más-menos 1 Estatura normal - 1 a - 1.99 Ligeramente baja - 2 y menos Baja Cuadro 3 PESO EN RELACION CON LA TALLA Desviaciones estándar con Indicador relación a la mediana Peso / Talla + 2 a + 3 Obesidad + 1 a + 1.99 Sobrepeso más-menos 1 Peso normal - 1 a - 1.99 Desnutrición leve - 2 a - 2.99 Desnutrición moderada - 3 y menos Desnutrición grave Una vez clasificado, se debe mantener el control subsecuente de acuerdo con los hallazgos: - Si el crecimiento y estado nutricional del niño es normal (más, menos 1 D.E.) se debe citar a control subsecuente con la periodicidad establecida en esta Norma y orientar sobre la alimentación, higiene, inmunizaciones e hidratación oral.
- 64. - Si el crecimiento y el estado nutricional del niño se encuentra con desnutrición leve, moderada o sobrepeso, talla ligeramente baja (entre 1 y 2 D.E. cuadros 1, 2 y 3), citar a intervalos más cortos (cada 30 días en menores de 5 años o por periodos de dos meses en mayores de esa edad). - En caso de encontrar alteraciones en el crecimiento y en el estado de nutrición, investigar las causas probables (enfermedades o mala técnica de alimentación, entre otras) e indicar tratamiento y medidas complementarias; en caso de no corregirse las alteraciones con el tratamiento indicado, se le enviará a un servicio de atención médica especializada y, una vez resuelto el problema, continuar el control en el primer nivel de atención. - Si el niño se encuentra con desnutrición grave u obesidad, y/o talla baja (más de 3 D.E. cuadros 1 y 2), se derivará al niño a un servicio de atención médica especializada y, una vez restablecido el estado nutricional, se continuará el control en el primer nivel de atención. APENDICE E TABLAS DE REFERENCIA PARA VALORAR EL PERIMETRO CEFALICO TABLA 1 PERIMETRO CEFALICO (cm) POR EDAD (MESES) 1 MES A 36 MESES NIÑAS PERCENTILES EDAD 3 10 25 50 75 90 97 MESES 1 33.6 34.7 35.7 36.4 37.3 38.4 39.8 2 35.8 36.6 37.3 37.9 38.9 39.7 41.6 3 37.4 38.0 38.6 39.2 40.1 41.1 42.8 4 38.5 39.2 39.7 40.4 41.3 42.3 43.6 5 39.3 40.0 40.7 41.5 42.4 43.2 44.4 6 40.0 40.7 41.5 42.4 43.1 44.0 45.5 7 40.6 41.3 42.1 43.2 43.9 44.7 45.6 8 41.1 41.9 42.7 43.8 44.5 45.3 46.2 9 41.6 42.5 43.3 44.4 45.0 45.8 46.7 10 42.1 43.0 43.8 44.9 45.4 46.3 47.1 11 42.5 43.3 44.2 45.2 45.8 46.6 47.5 12 42.8 43.6 44.6 45.6 46.2 47.0 47.8 13 43.2 44.0 45.0 45.9 46.5 47.3 48.1 14 43.5 44.3 45.2 46.2 46.8 47.6 48.4 15 43.7 44.6 45.4 46.4 47.1 47.9 48.7 16 44.0 44.8 45.7 46.7 47.3 48.1 48.9
- 65. 17 44.2 45.0 45.9 46.9 47.6 48.3 49.1 18 44.4 45.2 46.1 47.1 47.8 48.5 49.3 19 44.5 45.4 46.3 47.3 48.0 48.7 49.5 20 44.7 45.5 46.5 47.4 48.2 49.0 49.7 21 44.9 45.7 46.6 47.5 48.4 49.1 49.8 22 45.0 45.9 46.8 47.7 48.5 49.3 50.0 23 45.2 46.0 46.9 47.8 48.7 49.4 50.1 24 45.3 46.2 47.1 48.0 48.8 49.6 50.3 27 45.6 46.5 47.4 48.3 49.2 50.0 50.7 30 46.0 46.8 47.7 48.6 49.5 50.3 51.1 33 46.2 47.1 48.0 48.9 49.7 50.6 51.4 36 46.4 47.4 48.3 49.3 50.0 50.9 51.7 Fuente: Archivos de Investigación Médica, 6, sup 1, 1975. Somatometría Pediátrica, IMSS. TABLAS DE REFERENCIA PARA VALORAR EL PERIMETRO CEFALICO TABLA 2 PERIMETRO CEFALICO (cm) POR EDAD (MESES) 1 MES A 36 MESES NIÑOS PERCENTILES EDAD 3 10 25 50 75 90 97 MESES 1 35.0 35.7 36.3 37.2 38.0 39.0 40.0 2 37.3 37.8 38.4 39.0 39.9 40.7 42.0 3 38.7 39.2 3938.0 40.5 41.4 42.3 43.6 4 39.7 40.3 41.0 41.7 42.5 43.4 44.6 5 40.7 41.2 42.0 42.7 43.5 44.2 45.5 6 41.6 42.1 42.8 43.6 44.5 45.0 46.3 7 42.2 42.8 43.5 44.2 45.1 45.8 47.0 8 42.8 43.5 44.0 44.9 45.8 46.5 47.5 9 43.3 44.0 44.6 45.5 46.2 47.0 48.0 10 43.8 44.4 45.1 46.0 46.7 47.4 48.5 11 44.2 44.8 45.5 46.4 47.2 47.9 48.9
- 66. 12 44.5 45.3 46.0 46.9 47.6 48.3 49.3 13 44.8 45.6 46.3 47.2 47.9 48.6 49.6 14 45.1 45.8 46.6 47.5 48.2 48.9 49.9 15 45.3 46.1 46.9 47.8 48.5 49.2 50.1 16 45.6 46.4 47.2 48.0 48.8 49.5 50.3 17 45.8 46.6 47.4 48.2 49.1 49.8 50.5 18 46.0 46.9 47.6 48.5 49.3 50.0 50.7 19 46.2 47.0 47.8 48.7 49.4 50.1 50.9 20 46.4 47.2 48.0 48.9 49.6 50.3 51.1 21 46.6 47.4 48.2 49.1 49.8 50.4 51.3 22 46.7 47.5 48.4 49.3 49.9 50.6 51.5 23 46.8 47.6 48.5 49.4 50.0 50.8 51.6 24 46.9 47.7 48.6 49.5 50.1 50.9 51.7 27 47.2 48.1 48.9 49.8 50.5 51.2 52.1 30 47.5 48.3 49.2 50.0 50.7 51.5 52.4 33 47.6 48.5 49.4 50.2 50.9 51.8 52.6 36 47.8 48.7 49.6 50.4 51.1 52.0 52.8 Fuente: Archivos de Investigación Médica, 6, sup 1, 1975. Somatometría Pediátrica, IMSS. VALORACION DEL PERIMETRO CEFALICO EN EL NIÑO MENOR DE TRES AÑOS (CLASIFICACION) Debido a la trascendencia de los problemas derivados de malformaciones congénitas, ya sea por disfunción orgánica o alteraciones genéticamente determinadas a nivel craneal, se recomienda, en forma complementaria, medir el perímetro cefálico desde el nacimiento hasta los dos años de edad en que se completa el crecimiento del sistema nervioso central. El dato obtenido de la medición del perímetro cefálico en relación con la edad del niño, se compara con los patrones de referencia específicos contenidos en las tablas 1 y 2, mismos que pueden utilizarse para elaborar gráficas a partir de ellas. Se deben utilizar para su valoración inicial y para evaluar la tendencia del crecimiento en el tiempo; posteriormente debe hacerse un control subsecuente, de acuerdo a los hallazgos, recomendándose que la valoración sea mensual. - Si el perímetro cefálico se encuentra dentro de los percentiles 3 y 97 se considerará como valor normal. - Si el perímetro cefálico se sitúa por fuera de los valores percentiles mencionados, o si cambia dos carriles centilares hacia arriba o hacia abajo, se debe enviar a una unidad médica especializada, para su atención. APENDICE F EVALUACION DEL DESARROLLO PSICOMOTOR DEL NIÑO MENOR DE CINCO AÑOS
- 67. Los datos de cada área (conductas) son consecutivos. EDAD CONDUCTAS De 0 a 3 meses LENGUAJE Llora. Ríe. Emite sonidos. SOCIAL Mira la cara. Sonríe espontáneamente. COORDINACION Sigue con la mirada objetos móviles. Busca con la mirada la fuente del sonido. Mueve la cabeza y los ojos, en busca del sonido. MOTORA Boca abajo, levanta 45 grados la cabeza. Tracciona hasta sentarse. Mantiene erguida y firme la cabeza. De 4 a 6 meses LENGUAJE Balbucea. "da-da", "ma-ma" SOCIAL Atiende con interés el sonido. Busca con la mirada la fuente del sonido. Sonríe espontáneamente. COORDINACION Intenta la presión de objetos. Presión global a mano plena (barrido). MOTORA Eleva el tronco y la cabeza, apoyándose en manos y antebrazos. Mantiene erguida y firme la cabeza. Se mantiene sentado, con apoyo. Se mantiene solo, sin apoyo. De 7 a 9 meses LENGUAJE Lalea, "da-da", "ma-ma", "agu", utiliza consonantes. SOCIAL Encuentra objetos que se le ocultan bajo el pañal. Es inicialmente tímido con extraños. COORDINACION Prensión entre la base del pulgar y el meñique. Prensión entre el pulgar y la base del dedo índice. Prensión en pinza fina. Opone el índice con el pulgar.
- 68. MOTORA Se sienta solo, sin apoyo. Consigue pararse, apoyado en muebles. Gatea. Camina apoyado en muebles. De 10 a 12 meses LENGUAJE Dadá, mamá, pan, agua oso. SOCIAL Bebe de la taza. Juega "palmitas", "tortillitas". Detiene la acción a la orden de ¡No!. COORDINACION Prensión en pinza fina. Opone el índice con el pulgar. MOTORA Gatea. Camina apoyado en muebles. Camina tomado de la mano. De 13 a 18 meses LENGUAJE Utiliza más palabras. SOCIAL Se alimenta con cuchara derramando parte del contenido. Se viste con ayuda. Juega solo. COORDINACION Construye torres de tres cubos. Introduce objetos grandes en otros. Introduce objetos pequeños en frascos o botellas. MOTORA Sube escaleras, gateando. Camina bien sólo, sin ayuda. De 19 a 24 meses LENGUAJE Señala alguna parte del cuerpo. Cumple órdenes simples. Nombra a las figuras de un dibujo. SOCIAL Se alimenta con cuchara derramando parte del contenido. Ayuda en tareas simples de la casa. Juega en paralelo (imitando). COORDINACION Construye torres de tres cubos. Construye torres de cuatro cubos.
- 69. Construye torres de cinco cubos. MOTORA Patea la pelota. Salta. Lanza la pelota. Sube escaleras, con ayuda. Sube escaleras, tomado del pasamanos. De 2 a 4 años LENGUAJE Construye frases. Cumple órdenes complejas. SOCIAL Lava y seca sus manos. Controla esfínteres. Se pone alguna ropa. Se quita alguna ropa. Se viste sin ayuda. Comparte juegos. COORDINACION Construye torres de más de cinco cubos. Copia el círculo. Copia la cruz. MOTORA Salta en un pie. Sube escaleras sin apoyo. De 4 a 5 años SOCIAL Compite jugando. COORDINACION Copia el cuadrado. Una vez realizada la valoración de las conductas que ejecutan el menor de un año y el de uno a cuatro años, con la evaluación de desarrollo psicomotor del niño menor de cinco años, se clasifican de la siguiente manera: - Normal, si ejecuta todas las conductas correspondientes a su edad cronológica. - Limítrofe, si no ejecuta todas las conductas correspondientes a su edad cronológica, pero si a la inmediata anterior. - Anormal, si no ejecuta todas las conductas correspondientes a su edad; ni las conductas correspondientes a la inmediata anterior. - Se debe mantener el control subsecuente, de acuerdo con los siguientes hallazgos: - Cuando el desarrollo corresponda a su edad se dará orientación sobre técnicas de estimulación para favorecer el desarrollo, y citar a consultas subsecuentes con la periodicidad que se establece en esta Norma. - Si el desarrollo no corresponde a su edad, pero sí a la inmediata inferior, se dará orientación para favorecer el desarrollo del niño, y citar a consulta subsecuente a las dos semanas siguientes en el infante y tres meses después al preescolar; si no logra mejoría, se le enviará a una unidad de salud de mayor complejidad para su atención oportuna.
- 70. - Si el desarrollo no corresponde a su edad ni a la inmediata inferior, se le derivará a una unidad médica especializada para su atención. FUENTE: Evaluación del desarrollo psicomotor del niño menor de cinco años (Centro Latinoamericano de Perinatología y Desarrollo Humano CLAP-OPS/OMS).