Presentacion Cordoba
- 50. Las Tres Rs: Reduzca, Reuse y Recicle El principio de las tres R s es simple: No compre lo que no necesita, y todo lo que pueda vuélvalo a usar.
- 73. Eterilización por sustancias químicos Cuando se trata de elegir un esterilizante químico es importante conocer su toxicidad, su efectividad y su compatibilidad con los materiales a ser procesados. En cuanto a la toxicidad, el ususario debe agotar las fuentes de información a fin de tener un conocimiento actualizado en lo que respecta a los riesgos para el paciente y el operador.
- 74. Efectividad del Esterilizante Esta dada por su capacidad de destruir los microorganismos, incluyendo los esporos. El nivel de garantia de esterilidad (NGE) aceptado para dispositivos médicos e implantes es de 1 x 10 . Mientras que el el NGE requerido para los materiales que sólo entran en contacto con piel y mucosa intacta es de 1 x 10 . Uno de los métodos para fijar el NGE de un proceso consiste en cuantificar la actividad esporicida del agente frente a un indicador biológico. -6 -4
- 75. El NGE se determina habitualmente por extrapolación de una curva de muerte de una población de esporos, de reconocida resistencia, expuesta al agente esterilizante,ya sea en forma de gas ó en solución . Por más efectivo que sea el esterilizante químico, ello no libera al ususario de la responsabilidad de limpiar escrupulosamente el dispositivo (ya que es requisito imprescindible trabajar según normas standarizadas de limpieza).
- 76. Oxido de Etileno Es un compuesto imflamable y toxico, su uso debe ser controlado para protección y seguridad de la salud de los operarios y pacientes. Su temperatura de autoignición es cercana a la del formaldehido y del alcohol etílico con 440 °C mientras que la del éter es de 170 °C . Es utilizado en la esterilización de dispositivos médicos que no resisten altas temperaturas.
- 77. Caracteristicas Nombre Químico y Sinónimo Oxido de Etileno, Oxirano, . Familia Química Eter cíclico Fórmula C2H4O N° CAS registro (Chemical Abstracts Substance) 75-21-8
- 78. Punto de Ebullición 10.7°C Punto de Fusión -111°C Densidad (20°C/4°C agua 0.8694 Solubilidad Soluble en alcohol, agua y éter Apariencia, olor Liquido por debajo de los 11°C, incoloro, olor característico Presión de vapor a 30°C 1560 mmHg Presión de vapor a 50°C 2967 mmHg
- 79. Temperatura Crítica 195.8°C Es la temperatura por encima de la cual es imposible convertir el gas en líquido sin importar cuanta presión se aplique Presión Crítica 70.2 atm Es la presión requerida para elevar la temperatura del OE líquido a 195.8°C.
- 82. Datos sobre riesgo de explosión e incendio Temp. de ignición en aire a 1 atm. 429° C Temp. de autoignición en aire a 1 atm. 571° C Limite máx. de inflamación en aire a 1 atm 100° C Limite mín. de inflamación en aire a 1 atm 3° C
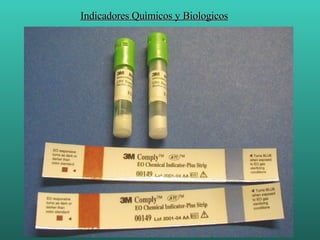
- 83. Indicadores Quìmicos y Biologicos
- 84. Procesado NO Procesado Indicadores Quìmicos y Biologicos Procesado NO Procesado
- 85. Riesgos inusuales de explosión e incendio Los vapores de óxido de etileno se encenderán en presencia de aire u oxidantes. Los vapores de OE son más pesados que el aire u otro oxidante y por ello se depositan a ras del suelo y pueden encenderse en forma de llamas o por chispas en un lugar remoto al sitio donde fue usado. Es clasificado como gas inflamable por cumplir con los requerimientos de 29CFR 1910.106
- 86. Relacion entre valor D, carga microbiana inicial 1 2 3 4 5 6 1 2 3 4 5 6 7 1 2 3 4 5 6 0 Tiempo (min) 0 Log D valor = 1 minuto 10 Log 10 Recuento de viables Probabilidad de supervivencia
- 87. Algunas reacciones del Oxido de Etileno H C CH + 2(H) CH CH OH Etanol O Agte. Reductor O.E + H O HOH C CH OH Glicol Etilenico (Etilenglicol) n[O.E] + H O HO[H C CH O ]H Polietilenglicoles 2 2 2 3 O.E 2 2 2 2 2 2 n
- 88. O.E + HCL CLCH CH OH Etilenclorhidrina O.E + HBr BrCH CH OH 2-Bromoetanol O.E + R NH R NH CH5 2 2 2 2 2 2
- 89. Factores que afectan al proceso de Esterilización por Oxido de Etileno Entrenamiento del personal Condiciones de carga % de OE absorbido por el material. Humedad relativa en el sector de preparación. Densidad de la carga. Preparación y embalaje correcto. Efectividad del poceso de esterilización – resultado del indicador químicos y biológico
- 90. Funcionamiento del esterilizados Indicadores Biológicos Su almacenamiento. Humedad relativa. Tiempo. Temperatura. Envase. Ubicación Humedad de camara. Tiempo de acond. Concentración de OE. Tiempo de Esterilización. Calidad de OE. Temperatura de Esterilización
- 91. Metabolismo del Oxido de Etileno GSCH CH OH S-2-(hidroxi-Ethilglutation 2 2 G. Transferasa Glutatione (GHS) CH CH O Agua HOOCCHNH CH SCH CH OH S-2-(hidroxietil) Cisteina 2 2 2 2 HOCH CHO hidroxiacetaldheido 2 Orina HOOCCNHRCH SCH CH OH Ac. N-Acetil-S-(2hidroxietil) Cisteina (S-(2-hidroxietil) mercapturico) 2 2 2 HOCH COOH Acido hydroxiacetico (acido glicolico) 2 COOHCOOH Acido etanodioico (Acido oxalico) HCOOC Acido formico + CO HCOCOOH Acido glioxilico 2 2 2 HOCH CH OH 1,2-Etanodiol 2 2
- 92. Esterilización por Peroxido de Hidrogeno H O 2 2
- 94. PLASMA –GAS DE PEROXIDO DE HIDRÓGENO Patentado en 1968. En 1972 es usado para esterilizar material biomédico. La actividad microbicida del H2O2 data de 100 años atrás.
- 95. PROPIEDADES DEL H2O2 Agente oxidante inestable. Las catalasas de los tejidos bloquean su acción a bajas concentraciones, al igual que peroxidasas.
- 96. PLASMA: Cuarto estado de la materia Gas + Energía Gas ionizado o PLASMA Puede obtenerse por: altas temperaturas fuertes campos eléctricos o magnéticos.
- 97. Hay 3 elementos necesarios para crear el plasma del gas: 1. Gas seleccionado que regula las propiedades del estado plasma. 2. Vacío profundo necesario para la creación del plasma que requiere un equipo especial. 3. Fuente de energía que puede ser radiofrecuencia.
- 98. MECANISMO DE ACCION BIOCIDA Producción de radicales libres HO altamente reactivos con lípidos de membrana, ADN y otros componentes celulares.
- 99. OPERACIÓN DEL SISTEMA STERRAD 100 1. Fase de vacío: evacuación del aire de la cámara. 2. Inyección de 1.8 ml de solución acuosa de H2O2 al 58%. Vaporización. 3. Difusión durante 50 min de gas de H2O2 en la cámara de esterilización, a través de toda la carga. 4. Fase de plasma: generación de plasma de gas de baja temperatura con 400W de radio-frecuencia a una presión de 500 mTorr. 5. Fase de ventilación: retorno de la cámara de esterilización a presión atmosférica.
- 100. LIMITACIONES DEL PROCESO -Humedad de los materiales -Materiales de acondicionamiento: polipropileno no tejido Pouch de poliolefin (tyvek) y polietileno laminado con poliéster.
- 101. -Penetrabilidad: para lúmenes > 40 cm y < 2 m de longitud y > 1mm y < 3 mm de diámetro es necesario usar dispositivos que contienen cápsulas de H2O2 al 50%.
- 102. --Características de los materiales: Incompatibles con: Derivados de celulosa, papel, lino, algodón, maderas, líquidos, aceites y polvos.
- 103. - Compatibilidad con: Teflón, silicona, Poliuretano, nylon, Látex, Polietileno de alta densidad, PVC, Acetato de vinilo, Vidrio, Policarbonato, Ópticas, Materiales eléctricos, motores etinilvinilacetato.
- 104. OPERACIÓN DEL SISTEMA STERRAD 100S Paso Parámetros del ciclo Tiempo de Ciclo corto Tiempo de Ciclo largo 1 Vacío hasta 700 mTorr 5 minutos (aprox) 5 minutos (aprox) 2 Pre-plasma a 800 mTorr 10 minutos 15 minutos 3 Vent. Hasta 760 Torr 1 minutos 1 minutos 4 Vacío hasta 400 mTorr 5 minutos (aprox) 5 minutos (aprox)
- 105. 5 Inyacción 1 a 400 mTorr 6 minutos 6 minutos 6 Difusión 1 a 760 Torr 2 minutos 10 minutos 7 Vacío hasta 500 mTorr 5 minutos (aprox) 5 minutos (aprox) 8 Plasma a 50 mTorr 2 minutos 2 minutos 9 Vacío hasta 400 mTorr 0.1 minutos 0.1 / 0.2 minutos
- 106. 10 Inyección 2 a 400 mTorr 6 minutos 6 minutos 11 Difusión 2 a 760 Torr 2 minutos 10 minutos 12 Vacío hasta 500 mTorr 5 minutos (aprox) 5 minutos (aprox) 13 Plasma a 500 mTorr 2 minutos 1 / 2 minutos 14 Vent. Hasta 760 mTorr 0.3 minutos 0.3 minutos Tiempo total (aprox) 51 minutos 72 minutos
- 107. Las ventajas de la esterilización con peroxido de hidrógeno en fase plasma son: La instalación del equipo es sencilla y la operación es simple. Se trabaja con un proceso automatizado y rápido. No quedan residuos tóxicos en el material esterilizado.
- 108. No se genera toxicidad en el ambiente de trabajo (limite ambiental TWA 8hs. 1 ppm) Como se trabaja a presión subatmosférica dentro de la cámara, no existe riesgo que el peróxido ú otras especies reactivas presentes en el plasma, difundan hacia el ambiente.
- 109. Tiempos de proceso en el Sterrad 100 S -25 -20 -15 -10 -5 5 10 15 20 25 30 35 40 45 50 60 1000 10000 100 Minutos 100000 Presión en mTorr
- 110. Indicadores de Proceso Medio de Cultivo Tapa Contenedor Etiqueta de datos Soporte con Esporos
- 111. Práctica del tratamiento con hidróxido de sodio para la decontaminación de material con priones
- 123. Consideraciones para el Reuso de Dispositivos Médicos Helga Sager de Agostini Farmacéutica Especialista en Esterilización
- 124. 1.Diseño de Dispositivos Médicos Reusables Definición de un dispositivo médico reusable. Es un dispositivo para ser usado en forma repetida en diferentes pacientes con previa decontaminación apropiada y otro procedimiento, por ejemplo , esterilización entre usos
- 125. 2.Consideraciones del diseño: El dispositivo debe responder en cuanto a seguridad y efectividad para una vida útil. Debe ser apto para ser limpiado y esterilizado repetidas veces.
- 126. 3.Existen cuatro aspectos importantes del diseño: Físicos. Del material. Del sistema. Del usuario.
- 127. 4.El diseño responde a una función del producto final. ¿Quién lo usa? ¿ Qué función debe cumplir? ¿Dónde es usado? ¿Por qué es usado? Cómo funciona?
- 128. 5.Consideraciones físicas del diseño Diseño que facilite su limpieza. Diseño que permita su esterilización. Debe evitarse diseños que permitan la retención de esterilizantes. El diseño debe considerar su vulnerabilidad al abuso del usuario. El diseño debe cumplir en cuanto a tamaño y configuración para ser usado en un campo estéril.
- 129. 6.Consideraciones del embalaje. Compatibilidad del embalaje con los materiales que componen el dispositivo médico. Uso de materiales de embalaje disponibles en el comercio.
- 130. 7. ¿El dispositivo médico requiere de un contenedor protectivo? Selección del contenedor más adecuado a la forma del dispositivo médico y el más conveniente para el método de Esterilización a aplicar.
- 131. 8.Diseño para la remoción del aire, la penetración del agente esterilizante y la aireación. -Diseño para la presentación aséptica en un campo estéril. -Compatibilidad del dispositivo empaquetado con el proceso de esterilización.
- 132. 9. Evaluación del diseño Stress interno Stress potencial externo Efectos de la limpieza y de la reesterilización
- 133. 10. Consideraciones del material. Estabilidad del material con: Compuestos químicos. Condiciones ambientales. Estabilidad no toxica después de la limpieza y reesterilización. Impacto de la limpieza y esterilización sobre la vida útil del dispositivo.
- 134. 11.Consideraciones del diseño del dispositivo en su forma integral. Evalué los elementos del diseño con el sistema del dispositivo biomédico. Evalué la compatibilidad del dispositivo médico con el sistema operativo. Seguridad ambiental para el descarte del dispositivo.
- 135. 12.Consideraciones del diseño para el usuario: Organice la asistencia a riego de daño potencial inducido por el usuario al dispositivo médico. Coloque permanentemente adventicias al dispositivo médico cuando corresponda.
- 136. Concepción Y Diseño Fabricación Embalaje Y Rotulación Promoción Venta Descarte Uso 50% Fabricante Premercado Vendedor Mercado Fases en la Vida Útil de los Dispositivos Médicos:
- 137. Estrella . Esquema que ilustra la responsabilidad compartida en la seguridad y efectividad de los dispositivos médicos. Manufactur a Usuario Publico Vendedor Responsabilidad compartida Comunicación Participación Educación Asistencia de riesgo/costo Gobierno
- 138. REGULACIÓN DE DISPOSITIVOS MÉDICOS Un producto biomédico tiene por finalidad: “ contribuir al tratamiento, al diagnóstico, prevención y alivio de las enfermedades en los seres humanos”.
- 139. REGULACIÓN DE DISPOSITIVOS MÉDICOS LEY 16463 (1984) ARTÍCULO 1°: Quedan sometidos a la presente ley y a los reglamentos que en su consecuencia se dicten, la importación, exportación, producción, elaboración, fraccionamiento, comercialización o depósito en jurisdicción nacional o con destino al comercio interprovincial de las drogas, productos químicos, reactivos, formas farmacéuticas, medicamentos, elementos de diagnóstico y todo otro producto de uso y aplicación en la medicina humana y las personas de existencia visible o ideal que intervengan en dichas actividades.
- 140. REGULACIÓN DE DISPOSITIVOS MÉDICOS DECRETO 2505 (1985), consta de 20 artículos y un anexo. ANEXO I: Materiales que entran en contacto con sangre. Equipos y/o dispositivos para transfusión y contenedores de sangre; equipos para hemodiálisis, para soluciones parenterales, para nutrición enteral. Agujas para inyección y cánulas intravenosas. Sondas, jeringas, material de sutura.
- 141. REGULACIÓN DE DISPOSITIVOS MÉDICOS DECRETO 2505 (1985): Presencia de un profesional universitario, como Director Técnico de los establecimientos elaboradores, importadores y que comercialicen productos biomédicos. Creación del Registro de Productores y Productos.
- 142. REGULACIÓN DE DISPOSITIVOS MÉDICOS RESOLUCIÓN SS N° 551 (1986): Consta de 13 artículos y 9 anexos. Establece la Dirección Técnica de un Profesional Farmacéutico en los establecimientos relacionados con productos que requieran la condición de ser estériles, atóxicos y apirógenos.
- 143. REGULACIÓN DE DISPOSITIVOS MÉDICOS DISPOSICIÓN 1335 (1986): Queda prohibida la reutilización de los materiales e instrumental quirúrgico rotulado como estéril, los cuales deben ser utilizados una sola vez.
- 144. REGULACIÓN DE DISPOSITIVOS MÉDICOS DISPOSICIÓN 607 (1993): Se crea, en el ámbito de la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica, ANMAT, el Registro de Productores y Productos de equipos, dispositivos y materiales de uso médico y odontológico.
- 145. REGULACIÓN DE DISPOSITIVOS MÉDICOS ANMAT Administración Nacional de Medicamentos, Alimentos y Tecnología Médica. Es la Autoridad de Aplicación para Fabricantes, Importadores y Exportadores de Dispositivos Médicos.
- 146. REGULACIÓN DE DISPOSITIVOS MÉDICOS FUNCIONES DE LA DIRECCIÓN DE TECNOLOGÍA MÉDICA Controlar y fiscalizar la calidad de los dispositivos médicos. Normalizar la fabricación, importación, exportación y depósito de estos productos. Realizar tecnovigilancia en la utilización de estos productos.
- 147. REGULACIÓN DE DISPOSITIVOS MÉDICOS DISPOSICIÓN 607 (1993): Se regula la importación de productos biomédicos mediante certificado otorgado por ANMAT, que obra como constancia de registro del importador y del producto frente a la Administración Nacional de Aduanas, que permite la liberación del despacho a plaza.
- 148. REGULACIÓN DE DISPOSITIVOS MÉDICOS ANEXO IV: Buenas Prácticas de Fabricación. Requerimiento para los Rótulos. ANEXO V: Condiciones para los Procedimientos de esterilización.
- 149. REGULACIÓN DE DISPOSITIVOS MÉDICOS RESOLUCIÓN 255 (1994): Se encuentra en plena vigencia. Logra fiscalizar todas las actividades relacionadas con los dispositivos médicos. Todas las actividades de producción, fraccionamiento y exportación de dichos productos.
- 150. REGULACIÓN DE DISPOSITIVOS MÉDICOS Todas las empresas y/o establecimientos relacionados con estas actividades deberán estar habilitadas por la Autoridad de Aplicación. La Dirección Técnica de un profesional Farmacéutico en los establecimientos de producción y/o importación de los productos mencionados en el artículo 1°, puntos a) y b).
- 151. REGULACIÓN DE DISPOSITIVOS MÉDICOS RESOLUCIÓN 255/94, ARTÍCULO 1°: A productos para ser usados una única vez y cuyo rótulo los define como atóxicos, estériles y apirógenos. Aquellos incluidos en el Anexo I, que podrán ser utilizados un número limitado de veces. Todos aquellos productos comprendidos en el artículo 1° del decreto 2505, que no se encuentren incluidos en los puntos a y b, y que permiten un reiterado.
- 152. REGULACIÓN DE DISPOSITIVOS MÉDICOS MERCOSUR GMC/RESOLUCIÓN N° 131/96. DISPOSICIÓN N° 698 (1999). ANEXO I: Guía de verificación del cumplimiento de las buenas prácticas de fabricación para productos médicos.
- 153. REGULACIÓN DE DISPOSITIVOS MÉDICOS MERCOSUR GMC/RESOLUCIÓN N°72/98 DISPOSICIÓN N° 4306 Requisitos esenciales de seguridad y eficacia de los productos médicos.
- 154. REGULACIÓN DE DISPOSITIVOS MÉDICOS RÓTULO: Leyenda de “material de un sólo uso”, atóxico, estéril y apirógeno. Instrucciones para el correcto uso. Contraindicaciones o incompatibilidades si correspondiera. Debe estar impreso o de ser de papel, entre dos coberturas. Rótulo en el idioma del país de comercialización.
- 155. REGULACIÓN DE DISPOSITIVOS MÉDICOS MERCOSUR GMC/RESOLUCIÓN N° 4/95 DISPOSICIÓN 191 (1999) Buenas Prácticas de Fabricación de Productos Médicos. Tienden a garantizar niveles de calidad, seguridad y eficacia de los productos médicos comercializados en el ámbito de los Estados Parte.
- 156. REGULACIÓN DE DISPOSITIVOS MÉDICOS RÓTULO: Denominación del producto. Razón social, domicilio y origen. N° de lote o partida. Método y fecha de esterilización. Fecha de elaboración y fecha de vencimiento. Nombre y matrícula de Director Técnico. N° de registro y/o Habilitación conferido por Autoridad de Aplicación.
- 157. REGULACIÓN DE DISPOSITIVOS MÉDICOS RECORDAR: Habilitación de establecimientos de fabricación y/o importación de Dispositivos Médicos. Dirección Técnica de un profesional universitario. Productos rotulados convenientemente. Relación con distribuidor y/o representante.





















































































![Algunas reacciones del Oxido de Etileno H C CH + 2(H) CH CH OH Etanol O Agte. Reductor O.E + H O HOH C CH OH Glicol Etilenico (Etilenglicol) n[O.E] + H O HO[H C CH O ]H Polietilenglicoles 2 2 2 3 O.E 2 2 2 2 2 2 n](https://image.slidesharecdn.com/presentacion-cordoba-1223260284417619-9/85/Presentacion-Cordoba-87-320.jpg)





































































