Prsentación analítica-final-2 (2)
- 1. DEPARTAMENTO DE BIOTECNOLOGIA Reporte practica 2 Equipo: Biotecnologos Khatia Berenice López Ahumada. ID: 165404 Itzel A. Gómez Leyva ID: 163840 Carmen M. Félix Pablos ID: 165161 Ángel J. Félix Sastre ID: 165165 José Emilio González Jara ID: 165274 Víctor Estrella ID: 165105 Roberto García Rodríguez. Equipo 1 Lab. Química Analítica (Miercoles 7am-10am) Cd. Obregón, Sonora a 15 de febrero del 2017
- 2. Introducción En esta práctica se va a valorar la acidez de un vinagre comercial, de una solución de NaOH y de HCL que se elaborarán durante la misma. Esto mediante el proceso teórico de neutralización por medio del método analítico de titulación. En este caso nos centraremos en obtener la Normalidad de estas soluciones utilizando otras ya tituladas, con el fin conseguir el conocimiento necesario par realizar este tipo de procesos en el futuro.
- 3. Materiales Material por equipo: • Bureta 25ml • 3 Matraces Erlenmeyer 250ml • 1 Probeta 50ml • 1 Pipeta 2ml • 1 Embudo Cónico • 1 Frasco Gotero • 1 Vaso de Precipitado 50ml • 1 Vaso de Precipitado 250ml 1 Agitador Magnético y Barra Afitadora 1 Soporte y Pinzas de Bureta 2 Matraz volumétricos 25 ml 1 Varilla de vidrio 1 Vial 20ml 2 Matraces Erlenmeyer 125ml 4 Tubos de Ensayo 22x175 Reactivos: Tampones de calibración del pH – metro 4, 7 y 10 Hidróxido Sódico (250ml) 0.1M 1.0g Ácido Clorhídrico (250ml) 0.1M 2.15ml HCL 36%, d: 1.18g/ml Anaranjado de metilo 0.1% Hidróxido de Amonio 5ml 0.1M Fertilizante Amoniacal 10ml Fenolftaleína al 0,20% en etanol Ftalato Ácido de Potasio 0.1M 5.1g
- 4. Procedimiento Normalización de la disolución de NaOH Primero se prepararon 250 ml de NaOH de concentración aproximada de 0.1 M. Se empleó la disolución patrón 0.1 M de ftalato ácido de potasio, se prepararon 5.1 g (previa sequedad) en 250 ml de agua destilada . Preparación de la primera bureta En un Matraz Erleen Meyer se colocaron 10 ml de hidróxido sódico con 5 gotas de indicador. Verter el ácido muy lentamente gota a gota. (colocado previamente en la bureta) Cuando la decoloración tarda en desaparecer está cerca del punto final de valoración. El ácido debe ser añadido gota a gota agitando bien el matraz entre cada adición. Cuando se torne un color rosa pálido será el punto final. Agitar bien menos de medio minuto. Repetir en 3 ocasiones y calcular concentración de NaOH como la media de los 3 experimentos.
- 6. Normalización de la disolución de HCl 0.1M Medir 2.15 ml de la solución de HCl en un vaso de 25ml, diluir con agua destilada y vaciar en un matraz vol. De 250 ml Medir 10 ml de esta disolución, añadirle 20 ml de agua destilada, luego 5-6 gotas de fenolftaleína y valorar con la disolución de NaOH previamente valorada y contenida en la bureta. Titulación de NaOH Ensayo 1 . 10 ml de ftalato con 40 ml de agua destilada se le agregaron 5 gotas de fenolftaleína y de 25 ml de NaOH que se tenian en la probeta se logro titular a los 9.5 ml Ensayo 2. Se le agregan 5 gotas de fenolftaleína a los 10 ml de ftalato con 40 ml de agua destilada y se logra titular con 12.4ml de NaOH Ensayo 3. A 10 ml de ftalato con 40 ml de agua destilada se le agregan 5 gotas de fenolftaleína y logra la titulación a los 12.1 ml de NaOH. Procedimiento
- 8. Ensayos de Titulación del Vinagre Ensayo 1. A 50 ml de agua destilada con 1 ml de vinagre se le agregaron 5 gotas de fenolftaleína se logra una titulación a 9.7 ml de NaOH. Ensayo 2. A 50 ml de agua destilada con 1 ml de vinagre se le agregan 5 gotas de fenolftaleína se logra una titulación a 9.7 ml de NaOH Ensayo 3. A 50 ml de agua destilada con 1 ml de vinagre con 5 gotas de fenolftaleína se logra una titulación a 9.6 ml de NaOH Procedimiento
- 10. *Acido arriba / Base abajo* Titulación de HCL Ensayo 1. A 50 ml de agua destilada con 1ml de hidróxido de amoniaco con 5 gotas de fenolftaleína se logro una titulación a 1.6ml de HCl Ensayo 2. A 50 ml de agua destilada con 1 ml de hidróxido de amoniaco con 5 gotas de fenolftaleína se logro una titulación a 0.9 ml de HCl Ensayo 3. A 50 ml de agua destilada con 1 ml de hidróxido de amoniaco con 5 gotas de fenolftaleína se logro una titulación a 1.2 ml de HCl. Procedimiento
- 12. Resultados y discusión • Cálculo de N de NaOH con Ftalato • NaOH – Vg = 10.33ml • Ftalato – Vg = 10ml • V1 * N1 = V2 * N2 • 10.33ml * N = 10ml * .1N • N = (10ml*.1N) / 10.33ml • Na0H = 0.096N Cálculo N de HCL con NaOH HCL – Vg = 10ml NaOH – Vg = 10.7ml 10ml * N = 10.7ml * .096N N = (10.7ml * .096N) / 10ml HCL = 0.102N Titulación de NaOH y HCLVg = Media de Volumen en 3 Ensayos
- 13. Titulación de Vinagre y HCL Resultados y discusión Cálculo N de Vinagre con NaOH Vinagre – Vg = 1ml NaOH – Vg = 9.66ml 1ml * N = 9.66ml * 0.096N N = (9.66ml * 0.096N) / 1ml Vinagre = 0.92N Cálculo N de HCL con NH4OH HCL – Vg = 1.23ml NH4OH – 1ml 1.23ml * N = 1ml * .1N N = (1ml * .1N) / 1.23ml HCL = .81N
- 14. Resultados y discusiónConcentración de Ácido Acético en Vinagre 1N de Ácido Acético → 60g → 1000ml 0.92N de Ácido Acético → Xg → 1000ml (0.92N Ácido Acético * 60g) / 1N de Ácido Acético = 55.2g cada 1000ml 0.92 * (60/1000) * 100 = 5.56% de Ácido Acético en Vinagre.
- 15. Resultados y discusiónConcentración de Ácido Acético en Vinagre .1N de NH4OH → 35g → 1000ml 1N de NH4OH → Xg → 1000ml (1N Ácido Acético * 35g) / .1N de Ácido Acético = 350g cada 1000ml
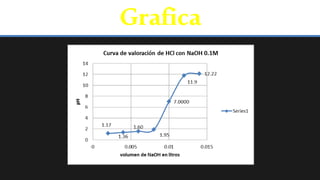
- 16. Grafica
- 17. Conclusiones El equipo logró obtener el valor de la Normalidad de las soluciones preparadas y del vinagre utilizando el método analítico conocido como titulación. También cabe destacar que se adquirió el conocimiento sobre como obtener el porcentaje de acidez en una solución mediante métodos analíticos. En este caso particular pudo obtenerse el valor porcentual del Ácido Acético en el vinagre comercial y los valores de la Normalidad en las soluciones de Ácido Clorhídrico e Hidróxido de Sodio.