Espectroscopia L
- 1. Introducción
- 2. Espectroscopia Es una importante herramienta utilizada para investigar la estructura de las moléculas. Estudia las transiciones que se producen entre los estados cuánticos de un sistema material inducidas por la radiación electromagnética
- 3. Radiación electromagnética ¿Cómo se propaga? ¿Cómo está compuesta? ¿Cuáles son sus propiedades?
- 4. Magnetismo y Electricidad En 1820 Crhistian Oersted descubre que la corriente eléctrica produce magnetismo Hans Crhistian Oersted (1777-1851) 1820
- 5. En 1831 Michael Faraday produce electricidad a partir de magnetismo Magnetismo y Electricidad 1831
- 6. Ondas Electromagnéticas En 1865 James Clerk Maxwell descubre la conexión entre los dos fenómenos Formula la teoría de las Ondas Electromagnéticas La luz es una de ellas 1865
- 7. http:// www.maloka.org /f2000/ waves_particles /wavpart4. html VELOCIDAD Longitud de onda ONDAS DE MATERIA ELECTRO- MAGNÉTICAS MECÁNICAS ELÁSTICAS FRECUENCIA
- 8. El campo eléctrico y el magnético vibran en fase Son perpendiculares entre sí y con la dirección de propagación Onda electromagnética
- 9. Onda electromagnética Longitud de onda (λ): Distancia entre dos puntos sucesivos en igual fase de vibración Frecuencia (ν): Número de ondas por unidad de tiempo c = λ . c = 300.000 Km/s
- 10. Frecuencia de una onda EM
- 11. Energía de una Onda EM En 1900 descubre la relación entre energía y frecuencia (teoría del cuanto) 1900
- 12. Ein s tein postulaba que la luz no llega de una manera continua, sino que está compuesta por pequeños paquetes de energía, a los que llamó “cuantos” . Por medio de la hipótesis cuántica, formulada por M. Planck cinco años antes, Einstein logró dar una explicación al fenómeno según el cual la energía de los electrones emitidos no depende de la intensidad de la luz incidente Albert Einstein (1879-1955) E xplicación del fenómeno fotoeléctrico 1905
- 13. Si la energía del fotón h es muy pequeña, ningún electrón se libera y no hay señal de corriente en el instrumento. S i los fotones tienen energías mayores que las requeridas para "sacar" electrones de la superficie, este "exceso" se transforma en "energía cinética y hay corriente
- 14. Cuando la luz llega a la superficie del metal la energía no se reparte equitativamente entre los átomos, la energía es absorbida y emitida en forma discontinua, ella se transmite e impacta de manera también discontinua o discreta: en paquetes o cuantos (fotones)
- 15. Espectro de radiación electromagnética
- 16. Espectroscopía
- 17. Esquema de la Clase Espectroscopias Descomposición de la luz Espectros atómicos Aplicaciones Fotometría de llama Absorción atómica Espectrofotometría Ley de Lambert-Beer Fluorescencia y Fosforescencia Formación de Colores
- 18. La Luz del Sol
- 19. Descomposición de la Luz En 1666 Isaac Newton descompone la luz utilizando un prisma Isaac Newton (1642-1727) 1666
- 20. El espectroscopio básico Implementado en 1814 por el óptico alemán Joseph von Fraunhofer 1666 1814
- 21. Espectro de Luz Solar ¿Qué encontró Joseph von Fraunhofer al hacer un espectro de la luz solar con mayor resolución?
- 22. Espectro de Luz Solar Aparecen líneas negras Descubrió 324 de las 500 existentes Espectro de Luz Solar Espectro de Luz blanca
- 23. Se sabia que: luz Material a alta temperatura
- 24. Átomos en la Llama Llama Sodio Litio Cobre Cobalto Calcio
- 25. Espectroscopio En 1860 Bunsen (químico) y Kirchhoff (óptico) crean un espectroscopio para analizar compuestos químicos en las llamas del mechero 1860 1860 1860
- 26. Espectros de Emisión Espectros Continuos (Luz natural) Espectros Discontinuos o de Líneas (Emisión Atómica) Átomos en la llama Luz blanca
- 27. ESPECTROS DE EMISIÓN calentar el gas a alta temperatura colocar en una llama los vapores de una sustancia producir una descarga eléctrica en el interior de un gas provocar la circulación de una corriente eléctrica en el interior de un gas a baja presión ¿Hay absorción de enrgía? E
- 28. ESPECTROS DE ABSORCIÓN -Interponer la sustancia entre la fuente de luz y el detector ¿Hay emisión de la energía absorbida?
- 29. Espectroscopía Astronómica Se puede establecer la composición química de los astros analizando sus : Espectros de absorción Fuente continua Fuente continua
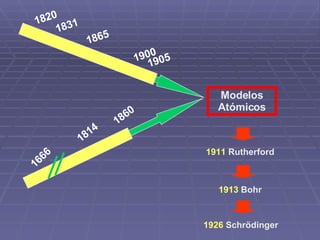
- 30. 1814 1666 1860 1905 1900 1865 1831 1820 Modelos Atómicos 1913 Bohr 1911 Rutherford 1926 Schrödinger
- 31. INTERACCIÓN Materia Radiación electromagnética Absorción Emisión Espectro INFORMACIÓN DE LA ESTRUCTURA DE LA MATERIA
- 32. La ecuación de Rydberg Johannes Robert Rydberg deduce una fórmula empírica Esta ecuación fue vista por Bohr...
- 33. Modelo Atómico de Rutherford L os átomos eran como sistemas solares en miniatura. El centro, o núcleo contenía la mayor parte de la masa del sistema –99,98 por ciento de ella– y llevaba una gran carga; los electrones, orbitaban corno planetas a una distancia de unos 10.000 diámetros nucleares ( su movimiento debería de estar en espiral hasta caer al núcleo ) . (1871-11937)
- 34. Modelo Atómico de Bohr En 1913 crea el modelo del átomo basado en el de su maestro Rutherford
- 35. Modelo Atómico de Bohr Postulados: Los electrones giran alrededor del núcleo sin emitir energía en “estados estacionarios” (no resuelve el colapso) Bohr introduce en su modelo los conceptos cuánticos ideados por Max Planck en 1900 La energía solo podría cambiar en pequeños saltos. Por lo tanto la radiación emitida es igual a: http://www.maloka.org/f2000/quantumzone/ debroglie.html
- 37. El modelo de Schrödinger No se puede establecer la posición de un electrón, existen “Orbitales” (1913) Erwin Schrödinger (1887–1961) http:// www.maloka.org /f2000/ quantumzone / schroedinger.html
- 38. “ ONDA ” CUANTOS ONDAS ELECTROMAGNÉTICAS “ LUZ”
- 39. “ ONDA ” VELOCIDAD ONDAS ELECTROMAGNÉTICAS REFLEXION REFRACCIÓN INTERFERENCIA POLARIZACIÓN MATERIA DISPERSIÓN DIFRACCIÓN
- 40. VELOCIDAD MATERIA CUANTO ESPECTROS NIVELES DE ENERGÍA EMISIÓN ABSORCIÓN EQUIPOS DE DETECCIÓN ESPECTROS NIVELES DE ENERGÍA ONDAS ELECTROMAGNÉTICAS
- 41. INSTRUMENTAL REFRACTÓMETRO RMN EPR ABSORCIÓN ATÓMICA ESPECTROFOTÓMETRO DIFRACCIÓN DE RAYOS X ESPECTROSCOPIO FOTÓMETRO DE LLAMA POLARÍMETRO
- 42. Interacción de la radiación con la materia
- 43. Dependiendo de la cantidad de energía involucrada esta puede producir cambios en el estado: Electrónico Vibracional - Rotacional
- 44. Transiciones vibracionales Modos de vibración de moléculas triatómicas
- 45. Espectro IR del 1-propanol
- 48. Absorción y emisión de radiación Espectro solar Hidrógeno Helio Mercurio Uranio
- 49. Espectros del Hidrógeno Emisión Absorción
- 51. Uso de la Emisión Atómica Identificación de elementos (espectros) Cálculos de concentración La intensidad de las líneas de emisión es proporcional a la concentración
- 52. Fotometría de Llama Catión en Solución Solución Muestra Combustible Emisión de Luz Detector Lectura de intensidad Comburente I Excitación Atomización Filtro 589 nm Sodio 766 nm Potasio Nebulización Evaporación del solvente Disociación Atomización Desexcitación Emisión Excitación
- 53. Equipo de Fotometría de Llama
- 55. Espectrofotómetro clásico I Io
- 56. Ley de Lambert-Beer Concentration I Io
- 57. Ley de Lambert-Beer A = a l c
- 58. Ley de Lambert-Beer Si no hay absorción : Si hay absorción total: I Io
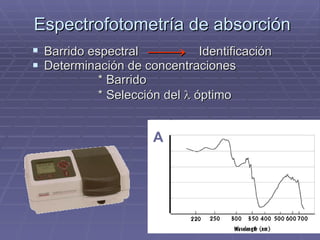
- 59. Espectrofotometría de absorción Barrido espectral Identificación Determinación de concentraciones * Barrido * Selección del óptimo A
- 60. Ley de Lambert-Beer A = a l c
- 61. La longitud de onda absorbida es distinta de la emitida Fluorescencia y Fosforescencia
- 63. El color de las cosas Depende de: La composición fisicoquímica del objeto La composición de la luz incidente sobre el objeto El fenómeno será distinto para: Cuerpos opacos Cuerpos transparentes
- 64. Método aditivo de producción de colores Fenómeno generado por las luces
- 65. Método sustractivo de producción de colores Pigmentos primarios: Absorción sustractiva
- 66. Conos de la retina: respuestas generales a la radiación visible (sensibilidad al color)
- 67. Muchas gracias