Proteínas
- 1. AMINOACIDOS, PÉPTIDOS Y PROTEÍNAS ESTRUCTURA Y FUNCIONES BIOQ. VALERIA OLMEDO MSC
- 3. AMINOÁCIDOS (AA): TIPOS Mckee, 3ra ed. Pag. 111
- 4. AA APOLARES NEUTROS • El término neutro se utiliza debido a que estos grupos R no llevan cargas positivas o negativas. Dado que interaccionan poco con el agua, los aminoácidos apolares (es decir, hidrófobos) participan de forma importante en el mantenimiento de la estructura tridimensional de las proteínas. En este grupo se encuentran dos tipos de cadenas R hidrocarbonadas: aromáticas y alifáticas. • En la metionina los electrones no enlazantes del átomo de azufre pueden formar enlaces con electrófilos con los iones metálicos. • Aunque el grupo sulfhidrilo (- SH) de la cisteína es apolar, puede formar enlaces de hidrógeno débiles con el oxígeno y el nitrógeno. • Los grupos sulfhírilo de dos moléculas de cisteína pueden oxidarse espontáneamente para formar un compuesto disulfuro denominado cistina. • Existe un AA número 21 llamado Selenocisteína que se encuentra en unas pocas proteínas
- 5. AMINOÁCIDOS: CLASES Mckee, 3ra ed. Pag. 111
- 6. AA POLARES NEUTROS • Poseen grupos funcionales capaces de formar enlaces de hidrógeno, por lo que se describen como «hidrófilos». • La serina, la treonina y la tirosina contienen un grupo hidroxilo polar, que los capacita para participar en enlaces de hidrógeno, importante en la estructura proteica. • Los grupos hidroxilo tienen otras funciones en las proteínas. Por ejemplo, serina y treonina son puntos a los que se unen los hidratos de carbono. La asparagina y la glutamina son derivados amida de los aminoácidos ácidos: ácido aspártico y ácido glutámico, respectivamente. Dado que el grupo funcional amida es muy polar, la capacidad de formar enlaces de hidrógeno de la asparagina y la glutamina posee un efecto significativo en la estabilidad proteica.
- 7. AA ácidos Las cadenas laterales del ácido aspártico y del ácido glutámico están cargadas negativamente a pH fisiológico, por lo que suele llamárseles aspartato y glutamato. AA básicos Pueden formar enlaces iónicos con los aminoácidos ácidos. La lisina, que tiene un grupo amino en la cadena lateral, acepta un protón del agua para formar el ácido conjugado (- NH~). Cuando se oxida la cadena lateral de la lisina en las proteínas como el colágeno, se forman enlaces cruzados fuertes intramoleculares e intermoleculares. El grupo guanidino de la arginina tiene un intervalo de pKa en las proteínas entre 11.5 y 12.5, por lo cual se encuentra permanentemente protonado a pH fisiológico y no actúa en las reacciones acido-básicas La histidina es una base débil, ya que sólo está ionizada parcialmentea pH 7. Como consecuencia de esto, los residuos de histidina actúan como amortiguadores. Desempeñan también un papel importante en la actividad catalítica de numerosas enzimas.
- 8. AA CON ACTIVIDAD BIOLÓGICA Neurotrasmisores Hormonas Son precursores de diversas moléculas complejas como las bases nitrogenadas, el grupo hemo o la clorofila Intermediario metabólico en la síntesis de urea La D-serina y el D-aspartato están libres en el tejido cerebral, la D-alanina y el D-glutamato en las paredes celulares de bacterias grampositivas, y D-aminoacidos en ciertos peptidos y antibioticos producidos por bacterias, hongos, reptiles y otras especies no mamiferas.
- 9. AA: PROPIEDADES INFLUENCIA DEL PH • Equilibrios protónicos del ácido aspártico • Los valores de pKa de todos los grupos funcionales de un AA dictan su carga neta a un pH dado. • A su pH isoeléctrico (pI), un AA no porta carga neta y así no se mueve en un campo eléctrico de corriente directa. • El conocimiento del punto isoeléctrico sirve para determinar las condiciones en las separaciones por electroforesis
- 10. AA: PROPIEDADES La forma iónica predominante de los AA en solución depende del pH Poseen carbonos quirales, estereoisómeros.
- 11. AA: REACCIONES • Formación del enlace peptídico Todos los AA que forman las proteínas son L
- 12. PROTEÍNAS ALGUNAS FUNCIONES Lehninger, 5ta ed. Pag 71
- 13. PROTEÍNAS: FUNCIONES • Estructural.- Fibras, membranas, estructuras subcelulares • Metabólico.- Enzimas • Transporte.- Canales iónicos, Transportadores • Reconocimiento celular.- Proteínas de adhesión, Integrinas • Expresión génica.- Factores de transcripción, coactivadores, correpresores • Transducción de señales.- Proteínas quinasas, proteínas G • Defensa e Inmunidad.- Inmunoglobulinas, sistema complemento
- 14. Diversidad de formas y tamaños de proteínas
- 16. MÉTODOS DE SEPARACIÓN PROTEÍNAS (1) Precipitación isoeléctrica: se aprovechan las diferencias de la solubilidad relativa de proteínas individuales en función del pH. Precipitación con alcohol o acetona: polaridad Separación por adición de sulfato de amonio: concentración de sal Separaciones cromatográficas: Separación por tamaño
- 17. Separación por diferencia de carga superficial de la proteína
- 18. Separación por afinidad anticuerpo para proteínas específicas
- 19. AMINOÁCIDOS ESENCIALES Y SU INGESTA RECOMENDADA
- 20. La calidad nutricional de un alimento esta dada tanto por su contenido de proteína como por la composición aminoacídica de su proteína. USDA nutrient data base: http://ndb.Nal.Usda.Gov/
- 21. FUENTES DE AA ESENCIALES
- 22. Estructuras primaria, secundaria, terciaria y cuaternaria de las proteínas
- 23. Estabilización de las estructuras Estructura α-hélice Puentes de Hidrógeno
- 24. Estructura de hoja
- 26. Modelo de cinta: Estructura ,
- 28. Estabilización de la estructura de proteínas de estructura terciaria y cuaternaria (globulares) Interacciones hidrofóbicas Puentes de hidrógeno Interacciones iónicas o puente salino (AA básico con AA ácido) Puentes disulfuro (entre cisteínas) Fuerza catión (AA básicos con neutros aromáticos) Todas estas fuerzas son atracciones que pueden romperse al cambiar las condiciones nativas de la proteína (desnaturalización)
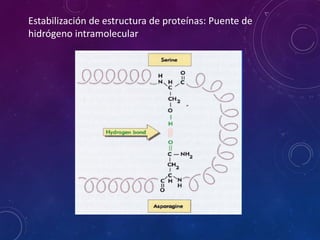
- 29. Estabilización de estructura de proteínas: Puente de hidrógeno intramolecular
- 30. Estabilización de estructura de proteínas: Interacciones iónicas
- 31. Estabilización de estructura de proteínas: Puente disulfuro
- 32. Estabilización de estructura de proteínas: Puentes disulfuro intracadenas o intercadenas
- 33. Interacciones moleculares que contribuyen a la estabilidad de una proteína: Interacciones hidrofóbicas>puentes de H2 >interacciones Ionicas >Puentes disulfuro El plegamiento de la proteína genera la estructura termodinámicamente más estable
- 34. a.-El plegamiento comienza con la formación espontánea de un núcleo estructural que consiste de unas pocas regiones particularmente estables de estructura secundaria. b.-A medida que otras regiones adoptan una estructura secundaria, estas se estabilizan a través de interacciones de largo alcance con el núcleo estructural precedente. c.-El plegamiento continúa hasta que la mayor parte del polipéptido alcanza una estructura secundaria regular que va estabilizándose. d.-La estructura final representa la conformación termodinámicamente más estable Plegamiento de proteínas: modelo jerárquico
- 35. Plegamiento correcto de proteínas tanto invivo como invitro, está en constante competencia con: Plegamiento incorrecto en diversos grados. Agregación. Formación de complejos poco solubles Denaturación química o térmica En contraste a lo que sucede invitro las células minimizan eventos indeseables utilizando una maquinaria molecular que facilita el proceso de plegamiento previniendo la agregación y otras interacciones desfavorables
- 36. Factores que influencian el correcto plegamiento in vivo de una proteína para alcanzar una estructura terciaria estable y funcional. Enzima Proteína Disulfuro Isomerasa (PDI) Chaperonas Moleculares (Hsp con diferentes PMs) Chaperoninas Complejo Proteico (Sistema GroEL/GroEs) Potencial redox del medio ambiente celular (Glutatión Ox/red) Enzima Peptidil prolil cis/trans Isomerasa (Prolina trans/cis)
- 38. PROTEÍNAS: CLASIFICACIÓN Según su composición: Pueden ser simples o conjugadas Según su morfología y solubilidad: Pueden ser fibrosas o globulares
- 39. Clasificación según su composición: Simples a. Albúminas.- solubles en agua y en sales. Pertenecen a las P. globulares. Se encuentran en tejidos animales y vegetales, toman su nombre de acuerdo al tejido del cual provienen, ej ovoalbúmina, legumelina, seroalbúmina etc. b. Globulinas.- insolubles en agua, son globulares. Ej: ovoglobulina, lactoglobulina. c. Histonas.- Fuertemente básicas y se asocian al ADN. d. Protaminas.- Son también proteínas de carácter básico, de molécula relativamente pequeña, están asociadas a ácidos nucleicos de esperma de peces. e. Glutelinas y gliadinas.- Se encuentran en granos de cereales son nutricionalmente incompletas. f. Escleroproteínas.- Albuminoides, proteínas fibrosas de sostén y estructura. Son queratinas, colágeno y elastina.
- 40. Los grupos prostéticos estabilizan dominios funcionales de las proteínas Clasificación de proteínas: conjugadas
- 41. Clasificación según su morfología y solubilidad Proteínas fibrilares: Estructura de la región fibrilar del colágeno Tipos de proteínas Proteinas globulares: Inmunoglobulinas
- 43. DESNATURALIZACIÓN Se llama desnaturalización de las proteínas a la pérdida de las estructuras de orden superior (secundaria, terciaria y cuaternaria), quedando la cadena polipeptídica reducida a un polímero estadístico sin ninguna estructura tridimensional fija.
- 44. TÉCNICAS DE SEPARACIÓN Y RECONOCIMIENTO DE PROTEÍNAS (2) Electroforesis en el caso de proteínas, técnica de separación de proteínas basada en el punto isoeléctrico (pH al cual la proteína tiene una carga neta de 0) Electroforesis es la técnica para la separación de moléculas según la movilidad de éstas en un campo eléctrico.
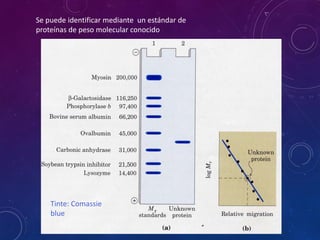
- 45. Electroforesis En la práctica se cubre a toda la mezcla de proteínas con un detergente (SDS) para desnaturalizar la proteína y cubrirlas con carga negativa y se puede separar por tamaño.
- 46. Tinte: Comassie blue Se puede identificar mediante un estándar de proteínas de peso molecular conocido
- 47. La Hemoglobina