04 Gases 21 03 05
- 1. Clase 4. Marzo 21 Gases QUIMICA GENERAL E INORGANICA Primer Cuatrimestre 2005 http:// www.ffyb.uba.ar/qcagral/default.htm
- 2. Gases Son los 11 elementos gaseosos en condiciones normales
- 3. Composición del aire seco a nivel del mar
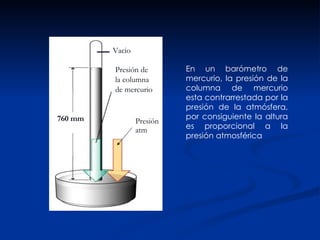
- 4. Presión atm Presión de la columna de mercurio Vacio En un barómetro de mercurio, la presión de la columna de mercurio esta contrarrestada por la presión de la atmósfera, por consiguiente la altura es proporcional a la presión atmosférica 760 mm
- 5. Manómetro Tubo abierto Tubo cerrado
- 6. Cuando las moléculas de gas chocan con las paredes del recipiente que las contiene, ejercen una fuerza sobre dichas paredes. La fuerz a media por unidad de superficie es la presión del gas Fuerza P = _____ área Unidades de presión Unidad del SI : pascal (Pa) 1 Pa= 1 kg/(m s 2 ) = 1 N/ m 2 Presión Presión
- 7. Factores de conversión.
- 8. Ley de Boyle
- 9. Ley de Boyle La presión de una cantidad determinada de gas a temperatura constante es inversamente proporcional al volumen (1660) P α 1/V Volumen pequeño, Presión alta Volumen grande Presión baja
- 10. Ley de Boyle P 1 /P 2 = V 2 / V 1 Volumen pequeño, Presión alta
- 11. La presión de una cantidad fija de gas a temperatura constante es inversamente proporcional al volumen PV= constante
- 12. Ley de Charles Para una misma masa de gas a presión constante el volumen, es proporcional a su temperatura absoluta (1787) T v Frecuencia de las colisiones
- 13. Ley de Charles P1 P2 P3 P4
- 14. La presion de una cantidad determinadad de gas contenida en un recipienrte a volumen constante es proporcional a su temperature absoluta.
- 15. Ley de Gay –Lussac de los volumenes que se combinan (1808) + 1 vol de N 2 (g) + 3 vol de H 2 (g) 2 vol de NH 3 (g) 1 L + 3 L 2 L 5 L + 15 L 10 L A temperatura y presion constante , los volumenes de los gases que intervienen en reacciones químicas forman relaciones iguales a números enteros y pequeños
- 16. Principio de Avogadro (1811) El volumen ocupado por una muestra de gas a presión y temperatura constante es proporcional al número de moles presentes. V n o V= constante x n
- 17. Ley de los gases ideales P V = nRT Colocando a temperatura de 273,15 K volumen de 22,4 L, n= 1 mol presión = 1 atmosfera R= 0,082 L atm / K mol Ley de Boyle Ley de Charles Ley de Avogadro V 1/P V T V n n, T contante n, P contante P, T contante
- 19. Volumen molar Vm = V/ n= ( n RT/P) / n Vm = RT/ P El volumen molar de un gas ideal a 1 atm y 298 K es de 24,47 L/ mol El volumen molar de un gas ideal a 1 atm y 273 K es de 22,41 L/ mol
- 20. Densidad de los gases La densidad de los gases aumenta al aumentar la presion y al disminuir la temperatura, y eso es proporcional a la masa molar del gas PV = nRT = ( masa / Masa molar) RT d = Masa / volumen= n x masa / n x volumen d = masa / volumen= PxMasa molar/(RxT)
- 21. Estequiometria Cantidad de reactivo (masa o volumen) Moles de reactivo Moles de producto Cantidad de producto (masa o volumen)
- 22. 2 NaN 3 (s) 2Na (s) + 3 N 2 (g)
- 23. Ley de Dalton (1804) Pt = Pa + Pb na(RT/V) + nb (RT/V) Pt = n totales (RT/V) na + nb Xa = na/ n totales ntotales = na/Xa Pt= na RT = Pa Xa V Xa Pa = Xa Pt
- 24. Bibliografía Química . Moleculas-Materia-Cambio. P.Atkins y L. Jones. Ed. Omega . 3ra edicion (1997). Capítulo 5 . Química. R Chang. Ed. Mc Graw-Hill. 6ta edicion (1998). Capitulo 5.