05 Gases 23 03 05
- 1. Clase 5. Marzo 23 Gases Movimientos moleculares QUIMICA GENERAL E INORGANICA Primer Cuatrimestre 2005 http:// www.ffyb.uba.ar/qcagral/default.htm
- 2. Ley de Dalton (1804) Pt = Pa + Pb na(RT/V) + nb (RT/V) Pt = n totales (RT/V) na + nb Xa = na/ n totales ntotales = na/Xa Pt= na RT = Pa Xa V Xa Pa = Xa Pt
- 3. Aplicación de la ley de Dalton 2 HCl (ac) + Zn (s) ZnCl 2 (ac) + H 2 (g) Pt= P H2 + Pv H2O
- 4. Difusión gaseosa NH 3 (ac) Papel indicador
- 5. La difusión gaseosa es el proceso mediante el cual un gas se esparce fuera a través de otro gas para ocupar el espacio uniformemente. Difusión v 1 Mm 2 v 2 Mm 1 t 1 Mm 1 t 2 Mm 2
- 6. Efusión Se coloca un vaso que contiene H 2 (g) sobre el recipiente de arcilla porosa. El hidrogeno efunde dentro del recipiente poroso mas rápido que el aire efunde hacia fuera. Como resultado ,la presión dentro del recipiente poroso y el matraz conectado a él aumenta , forzando al agua coloreada ha salir fuera del tubo lateral.
- 7. Efusión Velocidad de efusión 1- área del orificio 2- nº de moléculas por unidad de volumen v 1 Mm 2 v 2 Mm 1 t 1 Mm 1 t 2 Mm 2
- 8. En la difusion, las moleculas de una sustancia se esparcen por la region ocupada por otras moleculas, colisionando y moviendose aleatoriamente. En la efusion, las moleculas de una sustancia se fugan a traves de un pequeño orificio. En ambos casos la velocidad aumenta al subir la T y disminuye al aumentar la masa molar.
- 9. Teoría cinético molecular 5- La energía cinética promedio de una molécula es proporcional a la temperatura absoluta. 1- El volumen de las moléculas es despreciable comparado con el volumen total en el que esta el gas 2- Los moléculas se mueven al azar pero en línea recta en todas las direcciones a velocidades variables. 3- Las fuerzas intermoleculares (repulsión y atracción) son débiles ó despreciables. Salvo en el momento de la colisión. 4- Cuando las moléculas chocan, las colisiones son elásticas. Postulados
- 10. Ley de Boyle Ley de Charles Para una misma masa de gas a presión constante el volumen, es proporcional a su temperatura absoluta (1787) T v Frecuencia de las colisiones Para una misma masa de gas a temperatura constante el volumen, es proporcional a la inversa de la presión (1660) PV= constante= 1/3n Mm v 2
- 11. Presión del gas Frecuencia de las Colisiones · Fuerza Promedio Frecuencia de las Colisiones = velocidad · (1/V · Número de moléculas) Fuerza Promedio = masa · velocidad P V n (Mm v 2 ) nT V
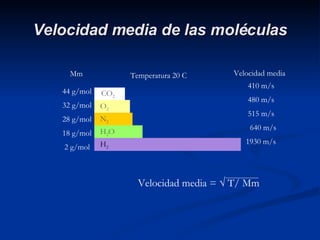
- 12. Velocidad media de las moléculas Temperatura 20 C Velocidad media = √ T/ Mm 410 m/s 480 m/s 515 m/s 640 m/s 1930 m/s Velocidad media CO 2 O 2 N 2 H 2 H 2 O 44 g/mol 32 g/mol 28 g/mol 18 g/mol 2 g/mol Mm
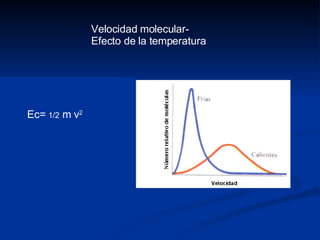
- 13. Distribución de Maxwell Moleculas pesadas Intermedias Moleculas ligeras Velocidad Numero de moléculas Temperatura baja Intermedias Temperatura alta Velocidad Numero de moléculas
- 14. Velocidad Molecualr - Ley de Maxwell V= 3RT V v1 = Mm2 Mm v2= Mm1
- 15. Velocidad molecular- Efecto de la temperatura Ec= 1/2 m v 2
- 17. GASES REALES : No se cumplen con los siguientes postulados: Los gases se componen de moléculas cuyo tamaño es despreciable comparado con la distancia media entre ellas. V - nb Las fuerzas intermoleculares son débiles ó despreciables. Salvo en el momento de la colisión. P + n 2 a V 2 Ecuación de Van der Waals En la siguiente tabla se observan los índices a y b para distintos gases Gas a b CO 2 3.658 0.043 H 2 0.2453 0.026 O 2 1.382 0.032 [a] = L 2 atm / mol 2 [b] = L / mol
- 18. Factor de compresión Un gas ideal tiene un Z>1 o =1 para todas las presiones. Para estos gases la repulsión es mas importante que la atracción. El volumen molar es mayor que el esperado. La mayoría de los gases como el Amoniaco, tienen Z<1 a bajas presiones. Para estos gases la atracción es mas importante que la repulsión. El volumen molar es menor que el esperado. Z =P Vm / RT
- 19. Gases reales (P+ n 2 .a ) (V-nb)= nRT V 2
- 21. Licuefacción El Cl 2 puede ser condensado a liquido a Patm por enfriamiento a -35 C o debajo de este valor.
- 22. Bibliografía Química . Moléculas-Materia-Cambio. P.Atkins y L. Jones. Ed. Omega . 3ra edición (1997). Capítulo 5 . Química. R. Chang. Ed. Mc Graw-Hill. 6ta edición (1998). Capítulo 5.














![GASES REALES : No se cumplen con los siguientes postulados: Los gases se componen de moléculas cuyo tamaño es despreciable comparado con la distancia media entre ellas. V - nb Las fuerzas intermoleculares son débiles ó despreciables. Salvo en el momento de la colisión. P + n 2 a V 2 Ecuación de Van der Waals En la siguiente tabla se observan los índices a y b para distintos gases Gas a b CO 2 3.658 0.043 H 2 0.2453 0.026 O 2 1.382 0.032 [a] = L 2 atm / mol 2 [b] = L / mol](https://image.slidesharecdn.com/05gases-230305-1217296862965323-9/85/05-Gases-23-03-05-17-320.jpg)




