Chapitre 13 cours
- 1. Chapitre 13 : Les objectifs de connaissance : - Définir la concentration molaire ; - Définir la concentration massique. Les objectifs de savoir-faire : - Savoir calculer la concentration molaire d’une espèce chimique en solution ; - Savoir calculer la concentration massique d’une espècee chimique en solution ; - Préparer une solution de concentration donnée par dissolution ou par dilution. Thème : La Pratique du Sport Domaine : L’étude du mouvement
- 2. 1. Définitions Définition : Une solution est obtenue par dissolution d’une espèce chimique dans un solvant (constituant majoritaire). L’espèce chimique dissoute (molécules ou ions) s’appelle le soluté Une solution est le mélange d’un solvant et d’un soluté. A RETENIR : - Si le solvant est l'eau, la solution est appelée solution aqueuse ; - On dit qu’une solution est homogène si le soluté est également réparti dans toute la solution. - On dit qu’une solution est saturée lorsque, après agitation, tout le solide introduit ne s’est pas totalement dissous. 2. Concentration d’une espèce chimique
- 3. 2.1. Concentration molaire Définition : La concentration molaire c d'une espèce chimique en solution est la quantité de matière n de cette espèce présente dans un litre de solution : -1 soluté soluté solution concentrationmolaire(enmol.L ) n quantitédematièredesoluté(enmol) V volumedelasolution(enL) c c solution n = V Remarque : on admettra que la dissolution d’un soluté dans un solvant n’entraîne pas de variation de volume. Vsolution ≈ Vsolvant Exercice : calculez la concentration cNaCl d’une solution dans laquelle on a dissout 12,0 g de sel dans 1 L d’eau. Données : M(NaCl) = 58,44 g.mol1 Réponse :
- 4. 2.2. Concentration massique Définition : La concentration massique cm d'une espèce chimique en solution (soluté), parfois appelée titre massique et noté t, est la masse m de cette espèce chimique présente dans un litre de solution : -1 m soluté soluté solution concentrationmassique(eng.L ) m m massesoluté(eng) V V volumedelasolution(enL) c t cm solution = =t -1 NaCl 2,05.10 c = = 1 -1 -1 2,05.10 mol.L Remarque : il existe une relation entre la concentration massique et la concentration molaire. soluté soluté soluté so solué élut t M M M M M c m m c n n n nsoluté m soluté solution solution solution solution m m = n V V V= V cc 3. Préparation d’une solution 3.1. Par dissolution d’un composé solide
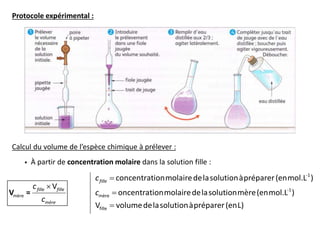
- 5. Voir TP n°12 : « Préparation d’une solution par dissolution d’un solide » Principe : Pour obtenir une solution de concentration donnée, une quantité donnée d’une espèce chimique est dissoute dans un volume donnée de solvant. Remarque : Pour que la mesure du volume de la solution à préparer soit précise, la dissolution s’effectue dans une fiole jaugée. Protocole expérimental :
- 6. Calcul de la masse de l’espèce chimique à dissoudre : À partir de la concentration massique de la solution à préparer : -1 m soluté soluté solution concentrationmassiquedelasolutionàpréparer(eng.L ) m masse(eng) V volumedelasolutionàpréparer(enL) c m solutionm = Vc À partir de concentration molaire dans la solution à préparer : -1 soluté soluté soluté solution soluté concentrationmolairedelasolutionàpréparer(enmol.L ) m masse(eng) M V volumedelasolutionàpréparer(enL) M masse molaire de l'espèc c c solutionm = V 1 e chimique à dissoudre (en g.mol ) À partir de la quantité de matière dans la solution à préparer : 1 soluté soluté soluté soluté soluté soluté m masse(eng) n M n quantité de matière de l'espèce chimique dans la solution(enmoL) M masse molaire de l'espèce chimique à dissoudre (en g.mol ) m =
- 7. Exemple n°1 : Pour préparer une solution de glucose de volume Vsolution = 100 mL et de concentration molaire c = 0,3 mol.L1, il faudra peser une masse de glucose de : glucose glucoseMc solutionm = V 3.2. Par dilution d’une solution mère Voir TP n°13 : « Préparation d’une solution par dilution » A.N. : mglucose = 0,3 180 0,1 = 5,4 g Exemple n°2 : Pour préparer une solution de glucose de volume Vsolution = 100 mL et de concentration massique cm = 75 g.L1, il faudra peser une masse de glucose de : glucose m solutionm = Vc A.N. : mglucose = 75 0,1 = 7,5 g Définitions :
- 8. Diluer une solution, c’est diminuer sa concentration en ajoutant de l’eau. Facteur de dilution fd : mère fille d fille mère V V c f c Lors d’une dilution, la quantité de matière de l’espèce chimique contenue dans le volume Vmère de l’échantillon de solution-mère prélevée se retrouve intégralement dans le volume Vfille de la solution fille préparée : nsolution-mère prélevée = nsolution-fille préparée (conservation de la quantité de matière) cmère Vmère = cfille Vfille Les concentrations sont exprimées en mol.L-1 et les volumes en L Principe
- 9. Protocole expérimental : Calcul du volume de l’espèce chimique à prélever : À partir de concentration molaire dans la solution fille : -1 -1 mère mère fille concentrationmolairedelasolutionàpréparer(enmol.L ) V oncentrationmolairedelasolutionmère(enmol.L ) V volumedelasolutionàpréparer(e fille fille fille mère c c c c V = nL)
- 10. À partir de la quantité de matière dans la solution fille : -1 -1 mère mère fille concentrationmolairedelasolutionàpréparer(enmol.L ) Vn oncentrationmolairedelasolutionmère(enmol.L ) V volumedelasolution fille fille fillesoluté mère mère c c c c c V = àpréparer(enL) Exemple : pour préparer 100 mL d’une solution fille de glucose de concentration c1 = 1,0 10–2 mol.L–1 à partir d’une solution mère aqueuse S0 de concentration c0 = 1,0 10–1 mol.L–1, il faut prélever un volume V0 de S0 tel que : c0 V0 = c1 V1 4. Détermination d’une concentration à partir d’une échelle de teinte Principe : Par dilution d’une solution mère, on peut fabriquer une échelle de teintes (ensemble de solutions contenant la même espèce chimique à des concentrations différentes) qui par simple comparaison permet d’évaluer la concentration inconnue d’une solution contenant la même espèce chimique colorée. Voir TP n°14 : « De la couleur à la concentration »
- 11. A RETENIR : Plus une solution colorée est concentrée, plus sa concentration en espèce colorante augmente et plus sa teinte s’obscurcit. Exercices : n°4 p191, n°8 p191, n°9 p191 n°16 p193 et n°19 p194 ( 2nd 2)